- 2021-07-06 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习离子反应作业(2)
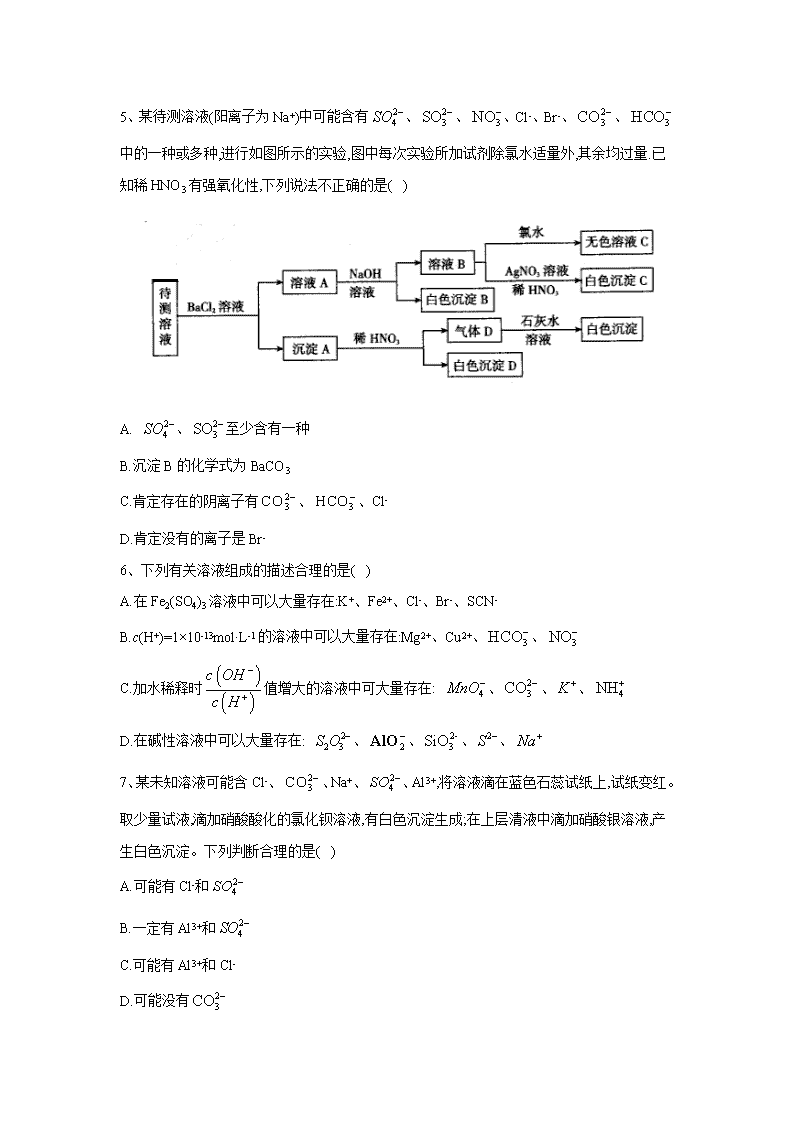
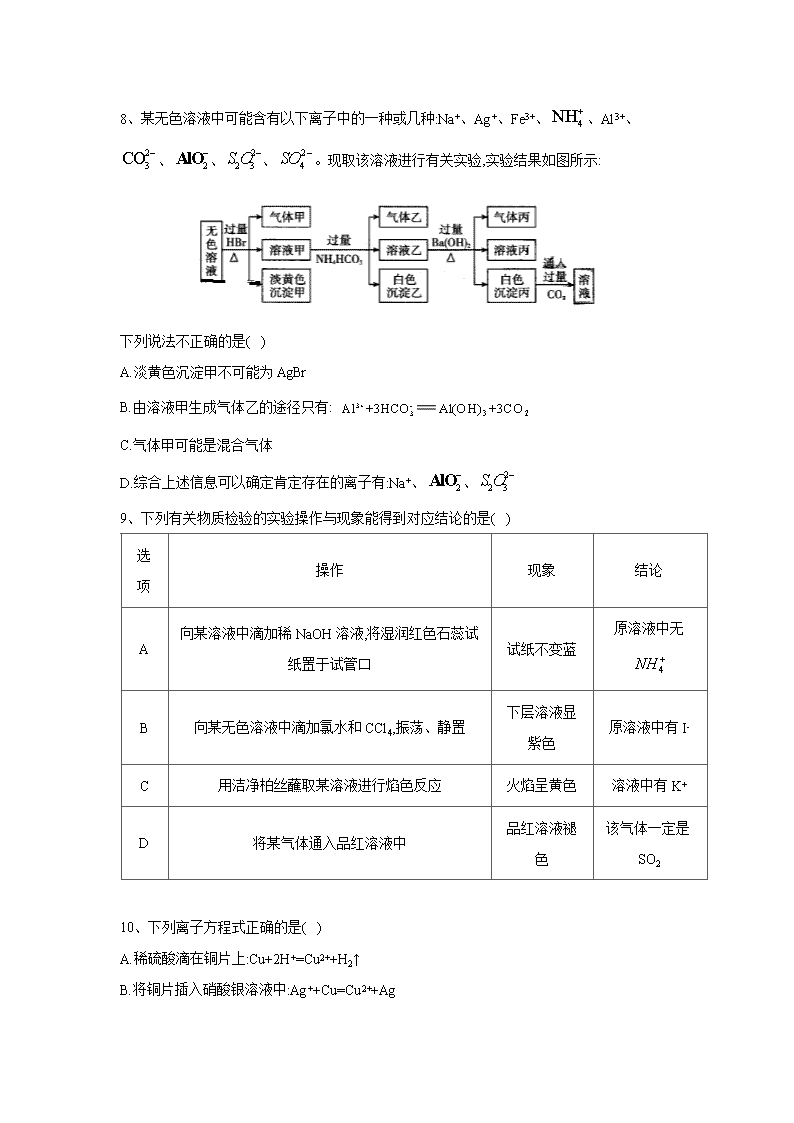
离子反应 1、下列说法中正确的是( ) A.NaCl 水溶液在电流的作用下电离出 Na+和 Cl- B.BaSO4 难溶于水,但 BaSO4 属于强电解质 C.CO2 溶于水能部分电离,故 CO2 属于弱电解质 D.0.1mol·L-1 溶液中 c(H+)=0.2mol·L-1 2、磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品。已知:1mol 磷酸、 亚磷酸、次磷酸最多消耗 NaOH 的物质的量依次为 3mol、2mol、1mol。下列推断正确的是 ( ) A.磷酸与 NaOH 反应能生成 2 种盐 B.NaH2PO4、NaH2PO3、NaH2PO2 都是酸式盐 C.H3PO4、H3PO3、H3PO2 都是含氧酸 D.H3PO3 既是三元酸又是还原性酸 3、某白色粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶 解; ②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。 该白色粉末可能为( ) A. 、 B. 、 C. 、 D. 、 4、常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A. 溶液: B.使甲基橙呈红色的溶液: C.pH=12 的溶液: D.与 反应产生大量 的溶液: 3NaHCO ( )3Al OH AgCl 3NaHCO 2 3Na SO 3BaCO 2 3Na CO 4CuSO 1 31.0 ·mol L KNO− 2 2 4, , ,H Fe Cl SO+ + − − 2 4 2, , ,NH Ba AlO Cl+ + − − 3, , ,K Na CH COO Br+ + − − Al 2H 2 3 3, , ,Na K CO NO+ + − − 5、某待测溶液(阳离子为 Na+)中可能含有 、 、 、Cl-、Br-、 、 中的一种或多种,进行如图所示的实验,图中每次实验所加试剂除氯水适量外,其余均过量.已 知稀 HNO3 有强氧化性,下列说法不正确的是( ) A. 、 至少含有一种 B.沉淀 B 的化学式为 BaCO3 C.肯定存在的阴离子有 、 、Cl- D.肯定没有的离子是 Br- 6、下列有关溶液组成的描述合理的是( ) A.在 Fe2(SO4)3 溶液中可以大量存在:K+、Fe2+、Cl-、Br-、SCN- B.c(H+)=1×10-13mol·L-1 的溶液中可以大量存在:Mg2+、Cu2+、 、 C.加水稀释时 值增大的溶液中可大量存在: 、 、 、 D.在碱性溶液中可以大量存在: 、 、 、 、 7、某未知溶液可能含 Cl-、 、Na+、 、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。 取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产 生白色沉淀。下列判断合理的是( ) A.可能有 Cl-和 B.一定有 Al3+和 C.可能有 Al3+和 Cl- D.可能没有 2 4SO − 2 3SO − 3NO− 2 3CO − 3HCO− 2 4SO − 2 3SO − 2 3CO − 3HCO− 3HCO− 3NO− ( ) ( ) c OH c H − + 4MnO− 2 3CO − K + 4NH+ 2 2 3S O − 2 −AlO 2- 3SiO 2S − Na+ 2 3CO − 2 4SO − 2 4SO − 2 4SO − 2 3CO − 8、某无色溶液中可能含有以下离子中的一种或几种:Na+、Ag+、Fe3+、 、Al3+、 、 、 、 。现取该溶液进行有关实验,实验结果如图所示: 下列说法不正确的是( ) A.淡黄色沉淀甲不可能为 AgBr B.由溶液甲生成气体乙的途径只有: C.气体甲可能是混合气体 D.综合上述信息可以确定肯定存在的离子有:Na+、 、 9、下列有关物质检验的实验操作与现象能得到对应结论的是( ) 选 项 操作 现象 结论 A 向某溶液中滴加稀 NaOH 溶液,将湿润红色石蕊试 纸置于试管口 试纸不变蓝 原溶液中无 B 向某无色溶液中滴加氯水和 CCl4,振荡、静置 下层溶液显 紫色 原溶液中有 I- C 用洁净柏丝蘸取某溶液进行焰色反应 火焰呈黄色 溶液中有 K+ D 将某气体通入品红溶液中 品红溶液褪 色 该气体一定是 SO2 10、下列离子方程式正确的是( ) A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ B.将铜片插入硝酸银溶液中:Ag++Cu=Cu2++Ag 4NH+ 2 3CO − 2 −AlO 2 2 3S O − 2 4SO − 3+ - 3Al +3HCO 3 2Al(OH) +3CO 2 −AlO 2 2 3S O − 4NH + C.氢氧化镁与稀盐酸混合:OH-+H+=H2O D.向浓 NaOH 溶液中滴入几滴氯化铵溶液并加热: +OH- NH3↑+H2O 11、下列实验设计及其对应的离子方程式均正确的是( ) A.向 溶液中加入过量氨水: B. 与 反应制备 : C.将 溶于水制备次氯酸: D.用浓盐酸酸化的 溶液与 反应,证明 具有还原性: 12、下列指定反应的离子方程式正确的是( ) A.将铜丝插入稀硝酸中: B.向 溶液中加入过量铁粉: C.向 溶液中加入过量氨水: D.向 溶液中滴加稀盐酸: 13、在两份相同的 Ba(OH)2 溶液中,分别滴入物质的量浓度相等的 H2SO4、NaHSO4 溶液,其 导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( ) A.①代表滴加 H2SO4 溶液的变化曲线 B.b 点,溶液中大量存在的离子是 Na+、OH- C.c 点,两溶液中含有相同量的 OH- D.a、d 两点对应的溶液均显中性 14、下列离子方程式及反应原理均正确的是( ) A.Fe2O3 溶于足量 HI 溶液中:Fe2O3+6H+ 2Fe3++3H2O B.除去 Fe2(SO4)3 溶液中的硫酸亚铁:2Fe2++Cl2 2Fe3++2Cl- 4NH + 3AlCl 3 3 23Al NH H O+ + ⋅ 3 4( ) 3Al OH NH ++ 2 2aN O 2H O 2O 2 2 2Na O H O+ 22 2Na OH O+ −+ + 2Cl 2 2Cl H O+ 2H Cl ClO+ − −+ + 4KMnO 2 2H O 2 2H O 4 2 22 6 5MnO H H O− ++ + 2 2 22 5 8Mn O H O+ + + 34 2Cu H NO+ −+ + 2 2 22Cu NO H O+ + ↑ + ( )2 4 3Fe SO 3Fe Fe+ + 22Fe + ( )2 4 3Al SO 3 3 23Al NH H O+ + ⋅ ( ) 43 3Al OH NH +↓ + 2 3Na SiO 2 3 2 Na SiO H ++ 2 3 2H SiO Na+↓ + C.向 溶液中加入过量的 溶液: D.向 溶液中加入过量的氨水: 15、下列实验的反应原理用离子方程式表示正确的是( ) A.室温下,测得氯化铵溶液 ,证明一水合氨的是弱碱: B.用氢氧化钠溶液除去镁粉中的杂质铝: C.用碳酸氢钠溶液检验水杨酸中的羧基: D.用高锰酸钾标准溶液滴定草酸: 16、下列指定反应离子方程式正确的是( ) A.向碳酸氢铵溶液中加入足量石灰水: B.向硫酸铝溶液中滴加碳酸钠溶液: C.少量 通入到过量的 溶液中: D.HS-的电离:HS-+H2O H3O++S2- 17、下列反应的离子方程式表达正确的是( ) A.1mol/L NaAlO2 溶液和 4mol/L 的 NaHSO4 溶液等体积混合: B.Fe2O3 与 HI 溶液反应:Fe2O3+6H+ 2Fe3++3H2O C.NH4HSO4 溶液中滴入少量 Ba(OH)2 溶液: D. 溶液中滴加过量的稀硫酸: 2( )Ba OH 4 4NH HSO 2 2 4 42Ba OH NH H SO+ − + + −+ + + + 4 3 2 2BaSO NH H O H O+ ⋅ + 3AlCl 3 3 23Al NH H O+ + ⋅ 3 4( ) 3Al OH NH ++ 7pH < 4 22NH H O+ + 3 2 3·NH H O H O++ 22 2 2 Al OH H O−+ + 2 22 3AlO H− + ↑ 32HCO−+ 2 22 2H O CO+ + ↑ 2 4 2 42 16 5MnO H C O− + −+ + 2 2 22 10 8Mn CO H O+ + ↑ + 2+ - - 3Ca +HCO +OH 3 2CaCO +H O 3+ 2- 32Al +3CO 2 3 3Al (CO ) 2Cl 2 3Na CO 2- 2 3 2Cl +CO +H O - - 3HCO +Cl +HClO - + 2AlO +4H 3+ 2Al +2H O + + 2- - 2+ 4 4NH +H +SO +2OH +Ba 4 3 2 2BaSO +NH H O+H O⋅ 2 2 3Na S O + 2- 2 32H +3S O 2- 4 22SO +4S+H O 18、在 FeCl3 溶液蚀刻铜箔制造电路板的工艺中,对废液处理和资源回收的过程简述如下: I.向废液中投入过量铁屑,充分反应后分离出固体和滤液。 II.向滤液中加入一定量的石灰水,调节溶液 pH,同时鼓入足量的空气。 回答下列问题: (1).FeCl3 蚀刻铜箔反应的离子方程式为__________ (2).过程 I 加入铁屑的主要作用是__________,分离得到固体的主要成分是__________,从 固体中分离出铜需采用的方法是__________ (3).过程 II 中发生反应的化学方程式为__________ 19、利用硫酸渣(主要含 Fe2O3、FeO,杂质为 MgO、Al2O3 和 SiO2 等)生产铁基颜料铁黄(FeOOH) 的制备流程如下: (1).“酸溶”时,MgO 与硫酸反应的离子方程式为__________ (2).滤渣 I 的主要成分是 FeS2、S 和__________(填化学式);Fe3+被 FeS2 还原的离子方程式 为__________ (3)."氧化"中,生成 FeOOH 的离子方程式__________ (4).滤液 II 中溶质是 Al2(SO4)3 和__________(填化学式);"洗涤"时,检验铁黄表面已洗涤干 净的操作是__________ 答案以及解析 1 答案及解析: 答案:B 解析:电解质电离不需要电流的作用,A 错误;强电解质完全电离,与溶解度大小无关,只要溶于 水的部分完全电离即可,B 正确:CO2 为非电解质,其溶于水与水化合产生 H2CO3,H2CO3 属于 弱电解质,C 错误;H2SO3 为弱酸,不能完全电离,D 错误 2 答案及解析: 答案:C 解析:1mol 最多消耗 3mol NaOH,H3PO4 是三元酸,其与 NaOH 反应生成 2 种酸式盐 NaH2PO4、 Na2HPO4,1 种正盐 Na3PO4,A 错误;H3PO2 是一元酸,NaH2PO2 不是酸式盐,B 错误;H3PO4、 H3PO3、H3PO2 中都含有氧元素,它们都是含氧酸,C 正确;1mol H3PO3 最多消耗 2mol NaOH,故 H3PO3 是二元酸,D 错误 3 答案及解析: 答案:C 解析: 、 中加入足量稀硫酸有气泡产生,生成硫酸钠、硫酸铝、二氧化 碳和水,最终无固体存在,A 项错误; 不溶于水和酸,加入水后,碳酸氢钠溶解,而 不 溶,再加入足量稀盐酸, 仍然不溶,固体不能全部溶解,B 项错误;C.亚硫酸钠和碳酸钡中 加入水,碳酸钡不溶于水使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应生成氯化钡、二氧 化碳和水,固体全部溶解,再将样品加入足量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀、二 氧化碳和水,符合题意,C 项正确; 、 中加热足量稀硫酸,振荡后无固体存 在,D 项错误;答案选 C。 4 答案及解析: 答案:C 3NaHCO ( )3Al OH AgCl AgCl AgCl 3NaHCO 4CuSO 解析: 在酸性条件下会氧化 ,A 错误;使甲基橙呈红色的溶液呈酸性, 在酸性 条件下不能大量存在,B 错误;与 Al 反应生成 的溶液可能显酸性也可能显碱性,酸性条件 下 不能大最存在,D 错误 5 答案及解析: 答案:C 解析:待测液和氯化钡溶液反应得到沉淀 A,则溶液中可能含有 、 、 ,向沉 淀 A 中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在 ,可能存在 、 中的两种或一种;滤液 A 中有 Ba2+,加入过量的 NaOH 溶液得到白色沉淀 B,则溶液中 一定含有 ,白色沉淀 B 为 BaCO3,滤液 B 中加入硝酸银、硝酸溶液得到白色沉淀,白色 沉淀为 AgCl,说明滤液 B 中含有 Cl-.由于加入氯化钡溶液,不能确定原溶液中是否含有 Cl-.A 项,根据以上分析可知,待测液中至少存在 、 中的一种,正确;B 项,根据分析可知,沉 淀 B 为碳酸氢根离子与钡离子、氢氧根离子反应生成的 BaCO3,正确;C 项,根据分析可知,肯 定存在的离子为 、 ,不能确定 Cl-是否存在,错误;D 项,根据分析可知,待测液中 一定不存在的离子为 Br-,正确. 6 答案及解析: 答案:D 解析:A 项,Fe3+和 SCN-反应生成 Fe(SCN)3,在溶液中不能大量共存,错误;B 项,c(H+)=1×10-13mol/L 的溶液中存在大量 OH-,Mg2+、Cu2+、 与 反应,在溶液中不 能大量共存,错误;C 项.加水稀释时 值增大,说明该溶液为酸性溶液, 与 反 应,在溶液中不能大量共存,错误;D 项,碱性溶液中存在大量 , 、 、 、 、 之间不反应,且都不与 反应,在溶液中能够大量共存,正确; 7 答案及解析: 答案:B 3NO− 2Fe + 2AlO− 2H 2 3CO − 2 3CO − 2 3SO − 2 4SO − 2 3CO − 2 3SO − 2 4SO − 3HCO− 2 3SO − 2 4SO − 2 3CO − 3HCO− 3HCO− OH − ( ) ( ) c OH c H − + 2 3CO − H + OH − 2 2 3S O − 2 −AlO 2- 3SiO 2S − Na+ OH − 解析:蓝色石蕊试纸变红,证明溶液呈酸性,所以溶液中一定不含有 ,一定含有 Al3+(水解 使溶液呈酸性);加入硝酸酸化的氯化钡后有沉淀生成,证明溶液中含有 ,由于加入的氯 化钡中含有 Cl-,不能由滴加硝酸银溶液产生白色沉淀的现象确定是否含有 Cl-,Na+是否存在 无法判定,故 B 正确; 8 答案及解析: 答案:B 解析:由于溶液为无色溶液,则一定不存在 Fe3+;与过量溴化氢反应生成了气体甲和淡黄色沉 淀,沉淀若是溴化银,则不存在 ,就不可能生成气体甲,所以淡黄色沉淀为单质 硫,HBr 和 反应生成 S 单质和 SO2 气体,溶液中一定存在 ,一定不存在 Ag+、 、 根据电荷守恒,Na+—定存在;溶液甲中含有过最的溴化氢,与过量的碳酸氢铵反 应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有偏铝酸根离 子;溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀通入过量 CO2 后可溶,则 白色沉淀为碳酸钡。所以溶液中一定存在的离子有 Na+、 、 ,—定不存在的离子 为 Ag+、Fe3+、Al3+、 ,可能存在的离子为 。根据以上分析可知 A、C、D 均正确; 还可以通过反应 生成 CO2,B 错误,故选 B。 9 答案及解析: 答案:B 解析:NaOH 稀溶液可能是用量不足,产生的极少量的 NH3 溶于水中,不能证明原溶液中不含 有 ,A 错误;B 选项发生反应 2I-+Cl2 I2+2Cl-证明原溶液中有 I-,B 正确;用洁净铂丝蘸 取某溶液进行焰色反应,火焰呈黄色,证明原溶液中有,而此时 K+的紫色会被黄色掩盖,需要透 过蓝色钴玻璃滤去黄光才能检验 K+,C 错误;使品红褪色的气体可能是 SO2、Cl2、O3 等,D 错 误 10 答案及解析: 答案:D 解析: 2 3CO − 2 4SO − 2- 2- 3 2 3CO ,S O 2 2 3S O − 2 2 3S O − 4NH+ 3Al + 2 2 3S O − 2 −AlO 2 4SO − 2 3CO − 3HCO +H− + 2 2H O CO+ 4NH + A 项,铜与稀硫酸不反应,错误;B 项,将铜片插入硝酸银溶液中发生反应的离子方程式为 Cu+2Ag+=Cu2++2Ag,错误;C 项,氢氧化镁难溶于水,不可拆分,错误。 11 答案及解析: 答案:A 解析:B 中不符合质量守恒定律,正确的离子方程式为 2Na2O2+2H2O 4Na++4OH-+O2;C 中 HCIO 是弱酸,不能拆成离子形式,且该反应为可逆反应;D 中的离子方程式本身没有问题,但 KMnO4 的强氧化性能将浓盐酸氧化,不能达到证明 H2O2 具有还原性的目的(还原性 HCl>H2O,HCl 先反应)。故选 A 12 答案及解析: 答案:C 解析:A、反应原理错,将铜插入稀硝酸中生成 ,反应的离子方程式为: ,A 错误; B、电荷不守恒,向 溶液中加入过量铁粉应为: B 错误; C、氨水是弱碱不能溶解氢氧化铝,则向 溶液中加入过量氨水的离子方程式为 ,C 正确; D、硅酸钠为可溶性盐,应该用化学式表示,向 溶液中滴加稀盐酸的离子方程式为 D 错误。答案选 C。 13 答案及解析: 答案:C 解析:由题图吋知曲线①在 a 点溶液导电能力最低,说明此时溶液中离子浓度最小,反应 是:Ba(OH)2+H2SO4 BaSO4+2H2O,A 正确;曲线②中 b 点进行的反应是:Ba(OH)2+NaHSO4 BaSO4+NaOH+H2O,生成 NaOH,B 正确;c 点曲线①表示 Ba(OH)2 已经完全反应,并剩余 H2SO4,溶液显酸性,c 点曲线②表示 NaOH 与 NaHSO4 反应,且 NaOH 还有剩余,溶液中的反 应为 NaOH+NaHSO4 Na2SO4+H2O,溶液显碱性,所以 c 点两溶液中含有 OH-的量不相同,C 错误;a 点为 Ba(OH)2 和 H2SO4 完全反应时生成 BaSO4 沉淀,溶液呈中性 d 点溶液中溶质只有 Na2SO4 溶液也呈中性,D 正确; 14 答案及解析: 答案:D NO 33 8 2Cu H NO+ −+ + 2 23 2 4Cu NO H O+ + ↑ + ( )2 4 3Fe SO 32Fe Fe+ + 23 ,Fe + ( )2 4 3Al SO 3 3 23Al NH H O+ + ⋅ ( ) 43 3Al OH NH +↓ + 2 3Na SiO 2 3 2SiO H− ++ 2 3 ,H SiO ↓ 解析:Fe3+与 I-会发生氧化还原反应,正确的为 ,A 错误;引入了 杂质.B 错误;NH4HSO4 过量,H+先反应,正确的离子方 程式为 ,C 错误;氨水是弱碱,不可拆写, 不溶于氨水,D 正确 15 答案及解析: 答案:B 解析:A. 的水解反应属于可逆反应,错误; B.铝能够与氢氧化钠反应而镁不能,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,正确; C.碳酸氢钠只能与羧基反应,与酚羟基不反应,错误; D.草酸属于弱酸,用化学式表示,错误;故选 B。 16 答案及解析: 答案:D 解析:加入足量石灰水,应该有一水合氨生成,A 错误;铝离子水解显酸性,碳酸根离子水解显碱 性,混合后水解相互促进,生成氢氧化铝和二氧化碳,反应的离子方程式为 ,B 错误;少量氯气通入碳酸钠溶液中,反应生成碳 酸氢钠、氯化钠和次氯酸钠,离子方程式为 ,C 错误;HS- 的电离:HS-+H2O H3O++S2-,D 正确; 17 答案及解析: 答案:A 解析:A 项, 与 以物质的量比为 1:4 反应生成 Al3+和 H2O,正确;B 项,Fe2O3 与 HI 发 生氧化还原反应,离子方程式为 Fe2O3+6H++2I- 2Fe2++I2+3H2O,错误;C 项,NH4HSO4 溶液滴 入少量 Ba(OH)2 溶液,OH-只与 H+反应,不与 反应,错误;D 项,硫代硫酸钠溶液与硫酸反 应生成硫酸钠、S、二氧化硫和水,离子方程式为 错误。 18 答案及解析: 2 3 6 2Fe O H I+ −+ + 2 2 22 3Fe I H O+ + + Cl − 2 2 42 2Ba OH H SO+ − + −+ + + 4 22BaSO H O+ 3( )Al OH 4NH + 3 2 3 22Al +3CO +3H O+ − 3 22Al(OH) +3CO 2- 2 2 3Cl +H O+2CO - - - 32HCO +Cl +ClO 2 −AlO H + 4NH+ 2- + 2 3S O +2H 2 2S+SO +H O 答案:1.2Fe3++Cu 2Fe2++Cu2+ 2.回收铜;Cu 和 Fe;加盐酸反应后过滤 3.FeCl2+Ca(OH)2 Fe(OH)2+CaCl2、4Fe(OH)2+O2+2H2O 4Fe(OH)3 解析:1.FeCl3 溶液蚀刻铜箔时的离子方程式为 2Fe3++Cu 2Fe2++Cu2+ 2.过程 I 加入铁屑时的离子方程式为 2Fe3++Fe 3Fe2+和 Fe+Cu2+ Fe2++Cu,其主要作用是 回收铜;固体的主要成分是 Fe 和 Cu,利用 Fe 能溶于稀硫酸或稀盐酸,而 Cu 不溶,将 Fe、Cu 混 合固体用稀硫酸或稀盐酸浸泡,待充分反应后过滤,即可分离出铜。 3.过程 II 中发生反应的化学方程式依次为 FeCl2+Ca(OH)2 Fe(OH)2+CaCl2、 4Fe(OH)2+O2+2H2O 4Fe(OH)3 19 答案及解析: 答案:1.MgO+2H+ Mg2++H2O 2.SiO2;2Fe3++FeS2 3Fe2++2S 3. 4.MgSO4、(NH4)2SO4;取最后一次洗涤液,先加入稀盐酸酸化,在加入 BaCl2 溶液,若无白色沉淀, 说明已洗干净 解析:1.MgO 不拆分,稀硫酸拆分,生成的 MgSO4 是可溶于水的盐要拆开 2.硫酸渣加硫酸酸溶.得 Fe3+、Fe2+、Al3+、Mg2+的溶液,加 FeS2 还原 Fe3+,SiO2 不溶于硫酸,滤 渣 I 中还有 SiO2。反应物为 Fe3+、FeS2(硫显-1 价,铁显+2 价),生成物有 Fe2+(Fe3+被还原为 Fe2+)、S(滤渣 I 成分之一),根据得失电子守恒配平。 3.滤液 I 中主要含 Fe2+、Mg2+、Al3+,加空气氧化 Fe2+为 Fe3+,加氨水调节 pH3~4,沉淀 Fe3+。生 成 FeOOH 的反应物为 Fe2+、O2、NH3·H2O,生成物有 FeOOH、 根据电子守恒、电荷守 恒、原子守恒即可配平。 4.由 3 中反应可判断滤液 II 中溶质为 Al2(SO4)3、(NH4)2SO4、MgSO4;由滤液 II 成分可知铁黄 表面可溶性杂质是 MgSO4、AI2(SO4)3、(NH4)2SO4,若洗涤干净,则洗涤液中无 2 3 2 24 8Fe NH H O O+ + ⋅ + 4 24 8 2FeOOH NH H O++ + 4NH + 2 4SO −查看更多