- 2021-07-06 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年吉林省长春外国语学校高二第一学期学期初考试化学试题
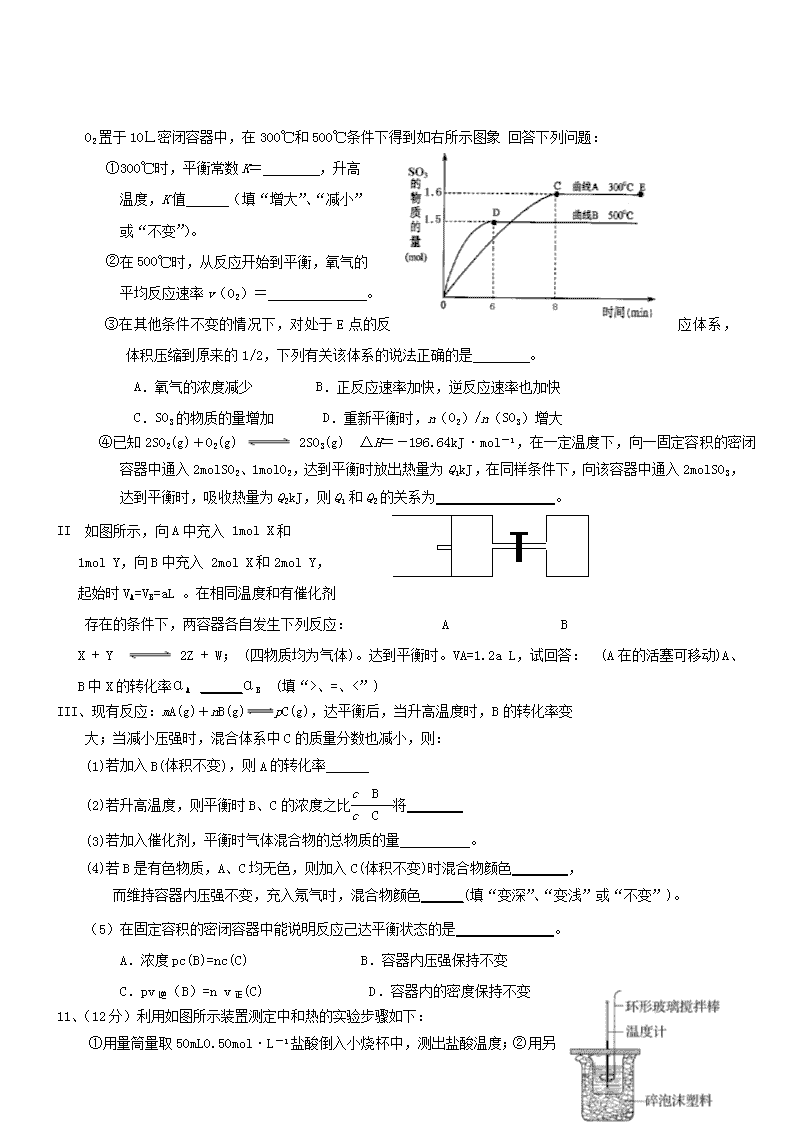
2017—2018学年度高二第一学期开学测试 理科化学试卷 一、单选题(每题6分 共42分) 1.下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的是 A.NH4Cl NH3↑+HCl↑ B.NH3+CO2+H2O===NH4HCO3 C.2NaOH+Cl2===NaCl+NaClO+H2O D.2Na2O2+2CO2===2Na2CO3+O2 2. .已知强酸与强碱在稀溶液中反应的中和热可表示为: H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ·mol-1对于下列反应: CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);ΔH= -Q1kJ·mol-1 1/2H2SO4(浓)+NaOH(aq)=1/2Na2SON4(aq)+H2O(l);ΔH= -Q2kJ·mol-1 HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH= -Q3kJ·mol-1上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是 A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1 3.对于可逆反应 A(g) +2B(g) 2C(g) △H>0,下列图像中正确的是 4、少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 ①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸 A、①⑥⑦ B、③⑤⑧ C、③⑦⑧ D、⑤⑦⑧ 5、下列五种烃:①2—甲基丁烷 ②2,2—二甲基丙烷 ③戊烷 ④己烷 ⑤丁 烷,按它们的沸点由高到低的顺序排列正确的是 A. ①>②>③>④>⑤ B.②>③>⑤>④>① C.③>①>②>⑤>④ D.④>③>①>②>⑤ 6、下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ①C(s)+O2(g)===CO2(g) ΔH1 C(s)+O2(g)===CO(g) ΔH2 ②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4 ③H2(g)+O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6 ④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8 A.① B.④ C.②③④ D.①②③ 7、某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。说法正确的是 A.a为CH4,b为CO2 B.CO向正极移动 C.此电池在常温时也能工作 D.正极电极反应式为O2+2CO2+4e-===2CO 二、填空题(共58分) 8.(8分)(1)将下列物质进行分类: ①H与H ②O2与O3 ③乙醇(C2H5OH) 与甲醚 (CH3—O—CH3) ④正丁烷与异丁烷 ⑤C60与金刚石;互为同分异构体的是 ; (2)若将反应Fe+H2SO4===FeSO4+H2↑设计成原电池铜为原电池某一极材料,则铜为______(填“正”或“负”)极。该极上发生的电极反应为 ,外电路中电子由______极(填“正”或“负”,下同)向 极移动。 9.(14分)下表为元素周期表的一部分请参照元素①-⑧在表中的位置,用化学用语回答下列问题: 族 周期 IA 0 1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ② ③ ④ 3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ (1)⑧、⑩的最高价含氧酸的酸性由强到弱的顺序是 。③的最高价氧化物为 ;⑨的最高价含氧酸是 (均填化学式) (2)④、⑤、⑥的形成的简单离子半径的大小顺序___________。(用离子符号表示)⑤与水反应的离子方程式 (3)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: 。 (4)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度_______(选填“更大”“更小”或“相同”)。 10、(24分)I、二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。 已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2 2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如右所示图象 回答下列问题: ①300℃时,平衡常数K= ,升高 温度,K值 (填“增大”、“减小” 或“不变”)。 ②在500℃时,从反应开始到平衡,氧气的 平均反应速率v(O2)= 。 ③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是 。 A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快 C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大 ④已知2SO2(g)+O2(g) 2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。 II 如图所示,向A中充入 1mol X和 1mol Y,向B中充入 2mol X和2mol Y, 起始时VA=VB=aL 。在相同温度和有催化剂 存在的条件下,两容器各自发生下列反应: A B X + Y 2Z + W; (四物质均为气体)。达到平衡时。VA=1.2a L,试回答: (A在的活塞可移动)A、B中X的转化率αA ______αB (填“>、=、<”) III、现有反应:mA(g)+nB(g)pC(g),达平衡后,当升高温度时,B的转化率变 大;当减小压强时,混合体系中C的质量分数也减小,则: (1)若加入B(体积不变),则A的转化率______ (2)若升高温度,则平衡时B、C的浓度之比将________ (3)若加入催化剂,平衡时气体混合物的总物质的量__________。 (4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色________, 而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、“变浅”或“不变”)。 (5)在固定容积的密闭容器中能说明反应己达平衡状态的是______________。 A.浓度pc(B)=nc(C) B.容器内压强保持不变 C.pv逆(B)=n v正(C) D.容器内的密度保持不变 11、(12分)利用如图所示装置测定中和热的实验步骤如下: ①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题: (1)为什么所用NaOH溶液要稍过量?_________________ ____________________________________________________ (2)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化 钠溶液和盐酸,理由是_________________________________________________。 (3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实 验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 (4)某实验小组配制0.50 mol/L NaOH溶液,若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。 1、D 2、C 3、D 4、C 5、D 6、C 7、D 8.(1) ③④ (2)正(1分) 2H++2e-===H2↑ 负 正 9. (1) HPO4>H3AsO4 N2O5 HClO4 (2)O2->Na+>Al3+ 2Na+2H2O=2Na++2OH-+H2↑ (3) (4)更小 10、I、①800 减小 ②0.0125mol·L-1·min-1 ③BC ④ Q1+Q2=196.64kJ II〉 III、(1)增大 (2)变小 (3)不变 (4)变深 变浅 (5)BC 11 (1)确保盐酸被完全中和 (2)不能 H2SO4与Ba(OH)2反应生成BaSO4沉淀,沉淀的生成热会影响反应的反应热 (3)不相等; 相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关(4) 5.0(写“5”不给分) 查看更多