福建省福清市华侨中学2018-2019学年高二下学期期中考试化学试题
2018-2019学年福清市 华侨中学第二学期期中考试高二化学试题
注意事项:
1.答卷前,考生务必将班级、姓名、座号填写清楚。
2.每小题选出答案后,填入答案卷中。
3.考试结束,考生只将答案卷交回,试卷自己保留。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Fe-56
第Ⅰ卷(选择题,48分)
一、选择题(本大题共16小题,每小题3分,共计48分。在每小题列出的四个选项中,只有一个选项是符合题目要求)
1.下列做法不利于环境保护的是( )
A. 为减少温室气体排放,应减少燃煤,大力发展新能源,如核能、风能、太阳能
B. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
C. 为节约垃圾处理的费用,大量采用垃圾的填埋
D. 在屋顶安装太阳能热水器为居民提供生活用热水
2.俄罗斯用“质子”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
如图:
下列说法正确的是
A. 2mol 与1mol 所具有的总能量比所具有的总能量低
B. 火箭中液氢燃烧的热化学方程式为:
C. 氢气的燃烧热为
D. 变成的过程中,断键吸收的能量小于成键放出的能量
3.在下列各说法中,正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 热化学方程式中的化学计量数只表示物质的量,可以是分数
C. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
4.下列说法正确的是( )
A. 反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57 kJ•mol﹣1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向
B. 能自发进行的反应一定能迅速发生
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据
D. CaCO3(s)=CaO(s)+CO2(g) △H>0,△S>0,不论在何种条件下都可能自发进行
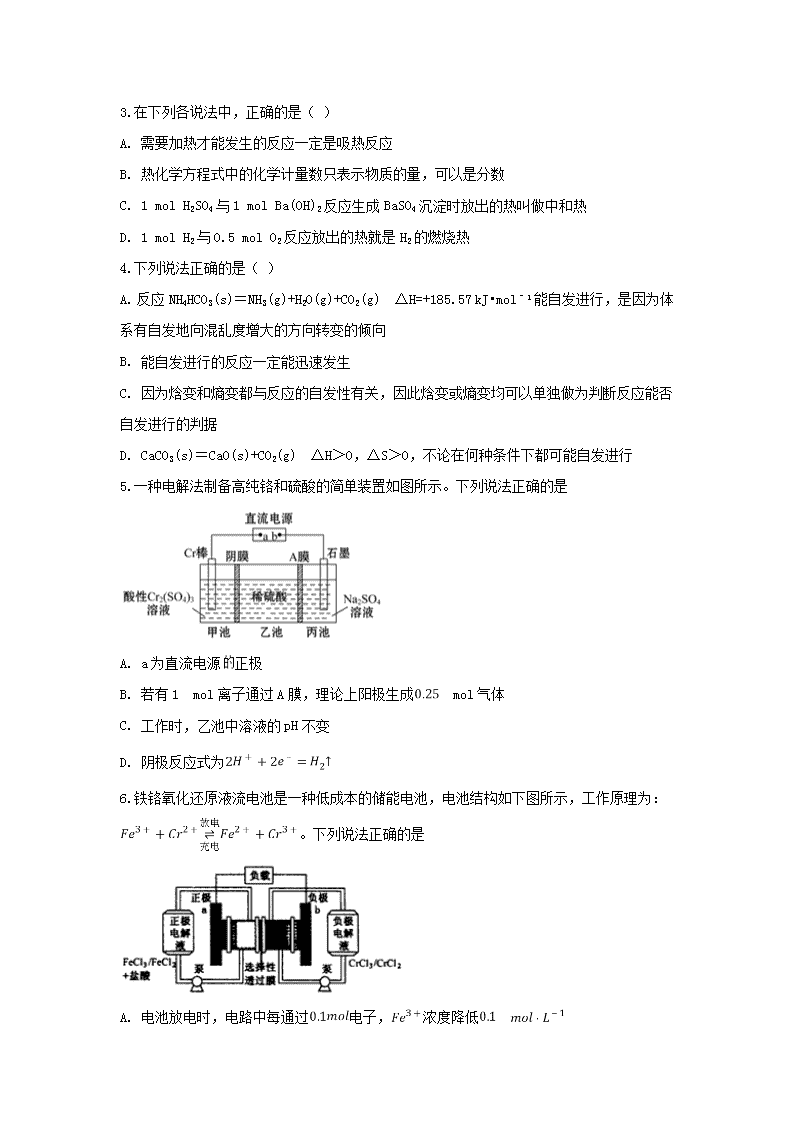
5.一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是
A. a为直流电源正极
B. 若有1 mol离子通过A膜,理论上阳极生成 mol气体
C. 工作时,乙池中溶液的pH不变
D. 阴极反应式为
6.铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:。下列说法正确的是
A. 电池放电时,电路中每通过电子,浓度降低
B. 电池充电时,从a极穿过选择性透过膜移向b极
C. 电池放电时,a极的电极反应式为
D. 电池充电时,b极的电极反应式为
7.下列有关金属腐蚀与防护的说法正确的是( )
A. 纯银器表面在空气中因电化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
D. “辽宁号”外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
8.SF6是一种优良的绝缘气体,分子结构中只存在S—F键,已知1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F—F、S—F键需吸收的能量分别为160 kJ、330kJ,则S(s) + 3F2(g) = SF6(g)的反应热△H为
A. —1780kJ/mol B. —1220kJ/mol
C. —450kJ/mol D. +430kJ/mol
9.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是( )
A. 燃料电池工作时,正极反应为O2+2H2O+4e﹣=4OH﹣
B. 此装置用于铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
C. 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同
10.一定条件下,在密闭容器里进行如下可逆反应:橙黄色液体气鲜红色液体。下列说法正确的是
A. 达到平衡时,单位时间里消耗n mol 的同时也生成n
B. 增大压强,平衡常数将增大
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
11.如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)下列有关说法不正确的是 ( )
A. 该电池的放电的反应式为Li1-xMnO2+LixC6=LiMnO2+C6
B. K与M相接时,A是阳极,发生氧化反应
C. K与N相接时,Li+由A极区迁移到B极区
D. 在整个充、放电过程中至少存在3种形式的能量转化
12.下列叙述及解释正确的是
A. 红棕色无色,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. 对于,在平衡后,加入碳,平衡向正反应方向移动
C. 红色,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于,平衡后,压强不变,充入,平衡向逆方向移动
13.下列事实,不能用勒夏特列原理解释的是( )
A. 在溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2HI(g) H2(g)+I2(g)平衡体系增加压强使颜色变深
C. 反应CO+NO2 CO2+NO △H<0, 升高温度使平衡向逆方向移动
D. 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率
14.在温度一定的条件下,N2(g)+ 3H2(g) 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为M g/mol,N2与NH3的浓度均为c mol·L−1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是 ( )
A. 新的平衡体系中,N2的浓度小于2c mol·L−1大于c mol·L−1
B. 新的平衡体系中,NH3的浓度小于2c mol·L−1大于cmol·L−1
C. 新的平衡体系中,混合体的平均摩尔质量大于M g/mol
D. 新的平衡体系中,气体密度是原平衡体系的2倍
15.在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是 ( )
A. T1
0, △ S>0,高温条件下能自发,故D错误。
考点:本题考查化学反应方向。
5.一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是
A. a为直流电源正极
B. 若有1 mol离子通过A膜,理论上阳极生成 mol气体
C. 工作时,乙池中溶液的pH不变
D. 阴极反应式为
【答案】B
【解析】
【详解】A.制备铬,则Cr3+被还原成Cr,Cr电极应该是阴极,即a为直流电源的负极,选项A错误;
B.石墨为阳极,根据放电顺序,阳极的电极反应为4OH--4e-=O2↑+2H2O,阳极附近水的电离平衡正向移动,产生的H+通过A膜进入乙池,若有1mol离子通过A膜,即丙池产生1mol氢离子,则理论上阳极生成0.25mol氧气,选项B正确;
C.工作时,甲池中硫酸根移向乙池,丙池中氢离子移向乙池,乙池中硫酸浓度增大,溶液的pH减小,选项C错误;
D.阴极反应式为Cr3++3e-=Cr,选项D错误;
答案选B。
6.铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:。下列说法正确的是
A. 电池放电时,电路中每通过电子,浓度降低
B. 电池充电时,从a极穿过选择性透过膜移向b极
C. 电池放电时,a极的电极反应式为
D. 电池充电时,b极的电极反应式为
【答案】D
【解析】
【分析】
铁铬氧化还原液流电池是一种低成本的储能电池,放电时为原电池原理,Cl-将移向负极,负极发生电极反应为:Cr2+-e-=Cr3+,逆反应和充电时的阴极反应相同;
充电时,在阳极上Fe2+离子失去电子发生氧化反应,即Fe2+失电子生成Fe3+,电极反应为:Fe2+-e-═Fe3+,逆反应和放电时正极上的反应相同,根据原电池和电解池的工作原理来回答判断即可。
【详解】A、放电时,电路中每流过0.1mol电子,就会有0.1mol的Fe3+得电子,Fe3+减小浓度和体积有关,选项A错误;
B、电池充电时,Cl-从阴极b极穿过选择性透过膜移向阳极a极,选项B错误;
C、电池放电时,是原电池的工作原理,a极为正极发生得电子的还原反应,电极反应式为Fe3++e-=Fe2+,选项C错误;
D、充电时是电解池工作原理,b极为阴极发生得电子的还原反应,电极反应式为Cr3++e-=Cr2+,选项D正确;
答案选D。
【点睛】本题考查二次电池的工作原理知识,考查学生对原电池和电解池工作原理的掌握,难度不大。
7.下列有关金属腐蚀与防护的说法正确的是( )
A. 纯银器表面在空气中因电化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
D. “辽宁号”外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
【答案】D
【解析】
A.发生电化学腐蚀时,金属应不纯,则纯银器主要发生化学腐蚀,故A错误;B.铁比锡活泼,当镀锡铁制品的镀层破损时,铁易被腐蚀,故B错误;C.防止金属被氧化,金属应连接电源的负极,如连接正极,会加剧腐蚀,故C错误;D.海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故D正确;故选D。
8.SF6是一种优良的绝缘气体,分子结构中只存在S—F键,已知1mol
S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F—F、S—F键需吸收的能量分别为160 kJ、330kJ,则S(s) + 3F2(g) = SF6(g)的反应热△H为
A. —1780kJ/mol B. —1220kJ/mol
C. —450kJ/mol D. +430kJ/mol
【答案】B
【解析】
【详解】反应热△H=反应物总键能-生成物总键能,所以对于S(s)+3F2(g)=SF6(g),其反应热△H=280kJ/mol+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,故合理选项是B。
9.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是( )
A. 燃料电池工作时,正极反应为O2+2H2O+4e﹣=4OH﹣
B. 此装置用于铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
C. 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同
【答案】C
【解析】
试题分析:A.因该燃料电池是在酸性电解质中工作,所以正极反应为:O2+4e-+4H+=2H2O,A项错误;B.a与电池正极相连,a为电解池阳极,b与电池的负极相连,b为电解池阳极,若用此装置在铁表面镀铜时,a为铜,b为铁,溶液中铜离子浓度不变,B项错误;C.a极是粗铜,b极是纯铜时,为粗铜的精炼,电解时,a极逐渐溶解,b极上有铜析出,符合精炼铜原理,C项正确;D.电解CuSO4溶液时,a极产生的气体为O2,产生1molO2需4mol电子,所以需要燃料电池的2molH2,二者的体积并不相等,D项错误;答案选C。
考点:考查原电池、电解池的工作原理。
10.一定条件下,在密闭容器里进行如下可逆反应:橙黄色液体气
鲜红色液体。下列说法正确的是
A. 达到平衡时,单位时间里消耗n mol 的同时也生成n
B. 增大压强,平衡常数将增大
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
【答案】A
【解析】
【详解】A、根据方程式可知单位时间里消耗 n mol S2Cl2的需要消耗n molCl2,同时生成n molCl2,Cl2的生成与消耗的物质的量相同,反应处于平衡状态,选项A正确;
B、平衡常数只与温度有关系,增大压强平衡常数不变,选项B错误;
C、正反应是放热反应,升高温度平衡向逆反应方向进行,氯气的含量增大,选项C错误;
D、加入氯气,平衡向正反应方向移动,S2Cl2的转化率增大,氯气的转化率降低,选项D错误。
答案选B。
【点睛】本题考查化学平衡状态的判断,影响平衡移动的因素。易错点为选项B,注意平衡常数只与温度有关。
11.如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)下列有关说法不正确的是 ( )
A. 该电池的放电的反应式为Li1-xMnO2+LixC6=LiMnO2+C6
B. K与M相接时,A是阳极,发生氧化反应
C. K与N相接时,Li+由A极区迁移到B极区
D. 在整个充、放电过程中至少存在3种形式的能量转化
【答案】C
【解析】
【详解】A、根据题意所知道的正极和负极反应,得出电池的总反应为Li1-xMnO2+LixC6LiMnO2+C6,选项A正确;
B、K和M相接时,形成电解池,A和电源的正极相接,是阳极,阳极发生失电子的氧化反应,选项B正确;
C、K与N相接时,形成原电池,A为正极,B为负极,此时电解质中的阳离子移向正极,即Li+从B极区迁移到A极区,选项C不正确;
D、放电时化学能转化为电能、光能等,充电时电能转化为化学能,故D正确;
答案选C。
12.下列叙述及解释正确的是
A. 红棕色无色,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. 对于,在平衡后,加入碳,平衡向正反应方向移动
C. 红色,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于,平衡后,压强不变,充入,平衡向逆方向移动
【答案】D
【解析】
【详解】A. 对于2NO2(g)(红棕色)N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强措施,因为平衡向正反应方向移动,但是平衡移动使物质浓度减小的趋势是微弱的,总的来说物质的浓度比增大压强前增大,因此体系颜色变深,故A错误;
B. 对于C(s) + O2(g) 2CO(g) ,在平衡后,加入碳,由于碳的浓度为定值,对该平衡无影响,平衡不发生移动,故B错误;
C. FeCl3+3KSCNFe(SCN)3(红色)+3KCl,该反应实质是:Fe3++3SCN-Fe(SCN)3,所以在平衡后,加少量KCl,没有影响反应体系的各种物质的浓度,所以平衡不发生移动,故体系颜色不变,故C错误;
D. 对于N2+3H22NH3,平衡后,压强不变,充入O2,则容器的容积增大,各种反应物的浓度减小,所以平衡左移,故D正确;
综上所述,本题选D。
13.下列事实,不能用勒夏特列原理解释的是( )
A. 在溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2HI(g) H2(g)+I2(g)平衡体系增加压强使颜色变深
C. 反应CO+NO2 CO2+NO △H<0, 升高温度使平衡向逆方向移动
D. 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率
【答案】B
【解析】
A.加入NaOH溶液时,NaOH和HBr、HBrO发生中和反应,从而影响化学平衡,促进溴和水的反应,可以用勒夏特列原理解释,故A不选;B.该反应的反应前后气体计量数之和不变,改变压强,平衡不移动,增大压强体积减小,碘浓度增大,从而气体颜色加深,与平衡移动无关,不能用勒夏特列原理解释,故B选;C.该反应是放热反应,升高温度,可逆反应向吸热反应方向逆反应方向移动,可以用勒夏特列原理解释,故C不选;D.加一种反应物,平衡向正反应方向移动,从而提高另一种物质的转化率,本身转化率降低,可以用勒夏特列原理解释,故D不选;故选B。
14.在温度一定的条件下,N2(g)+ 3H2(g) 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为M g/mol,N2与NH3的浓度均为c mol·L−1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是 ( )
A. 新的平衡体系中,N2的浓度小于2c mol·L−1大于c mol·L−1
B. 新的平衡体系中,NH3的浓度小于2c mol·L−1大于cmol·L−1
C. 新的平衡体系中,混合体的平均摩尔质量大于M g/mol
D. 新的平衡体系中,气体密度是原平衡体系的2倍
【答案】B
【解析】
将容器的体积压缩为原来的1/2,若平衡不移动,则N2 与NH3的浓度均为2c mol·L−1,体系的压强为原来的2倍。事实上将容器的体积压缩为原来的1/2时,气体压强增大,平衡右移,N2的浓度小于2c mol·L−1,又根据勒夏特列原理,新的平衡体系中,N2的浓度应大于c mol·L−1,A正确。平衡右移必定使NH3的浓度大于2c mol·L−1,B错误。平均摩尔质量=m(总)/ n(总),如果平衡不移动,则不变,事实上平衡正向移动,气体的物质的量减少,增大,故C正确。由于气体的质量不变而容器的体积为原来的1/2,故气体密度为原来的2倍,故D正确。
15.在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是 ( )
A. T10.18mol,升高温度平衡正向移动,可以知道PCl5的平衡转化率α1(T1) <α2(T2);
(2)a. 根据转化之比等于化学计量数之比n(N2O)恒等于n(NO2),n(N2O)=n(NO2)不能说明该反应已达到平衡状态;
b.该反应为气体体积减小反应,因此当容器内压强保持不变时,反应达到平衡状态;
c. υ正(N2O)=υ逆(NO2),表明正逆反应速率,且满足速率之比和化学计量数成正比时,才可以判定反应已达到平衡状态,但题中只有正反应速率,不能说明反应达到平衡状态;
d. 气体颜色保持不变,也就是有色气体的浓度不发生变化,反应达到平衡状态;
综上所述,本题选bd 。
19.钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
(1)根据表数据,请你判断该电池工作的适宜应控制在_____(填字母)范围内。
物质
Na
S
Al2O3
熔点/℃
97.8
115
2050
沸点/℃
892
444.6
2980
A. 100℃以下 B.100~300℃
C.300~350℃ D.350~2050℃
(2)放电时,电极A为_____极,电极B发生_____反应(填“氧化或还原”)。
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:__________。
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如(如图)所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:_____;试分析左侧溶液蓝色逐渐变浅的可能原因是:_____。
【答案】 (1). C (2). 负 (3). 还原 (4). Sx2﹣﹣2e﹣═xS (5). 2H2O+2e﹣=H2↑+2OH (6). 右侧溶液中生成的OH﹣通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应
【解析】
(1)原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有C符合,故答案为:C;
(2)放电时,Na被氧化,应为原电池负极,电极B是正极,发生还原反应,故答案为:负;还原;
(3)充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故答案为:Sx2--2e-=xS;
(4)根据以上分析,左侧溶液变蓝色,生成I2,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,右侧I-、OH-通过阴离子交换膜向左侧移动,发生反应3I2+6OH-=IO3-+5I-+3H2O,一段时间后,蓝色变浅,故答案为:2H2O+2e-= H2↑+2OH-;右侧溶液中生成的OH-通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应。
点睛:本题的易错点为(3),要注意充电时,阳极反应为原电池正极反应的逆反应,并且发生氧化反应,也可以 将总反应改为2Na++ Sx2-=2Na+xS,然后根据阳极发生氧化反应书写电极反应式。
20.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6mol SO3,如图表示SO3物质的量随时间的变化曲线。
①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) 2SO3(g) 的平衡常数为__________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) 2SO3(g) △H<0的化学平衡常数(K):
T/℃
T2
T3
K
20.5
4.68
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图所示:图中k1、k2、k3的大小顺序为____________。
【答案】 (1). 66.7% (2). 2.5 (3). c (4). T2 (5). k1>k2>k3
【解析】
(1)在容积为2L密闭容器中充入0.6molSO3,由图1平衡时SO3物质的量为0.2mol,
2SO2(g)+O2(g) ⇌2SO3(g),
起始量(mol) 0 0 0.6
变化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
①SO3的转化率为=×100%≈66.7%;K===2.5;其他条件不变,在8min时压缩容器体积至0.5L,平衡向正反应方向移动,n(SO3)变大,即为图像c,故答案为:66.7%;2.5; c;
②因为反应为放热反应,温度越低,平衡越向正反应方向移动,平衡常数越大,所以温度最低为K最大的,即T2,故答案为:T2;
(2)相同温度和压强下,K越小,氧气浓度越大,平衡正向移动,则二氧化硫的转化率越大,则k1>k2>k3,故答案为:k1>k2>k3。