- 2021-07-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省树德中学2021届高三化学10月阶段试题(Word版附答案)
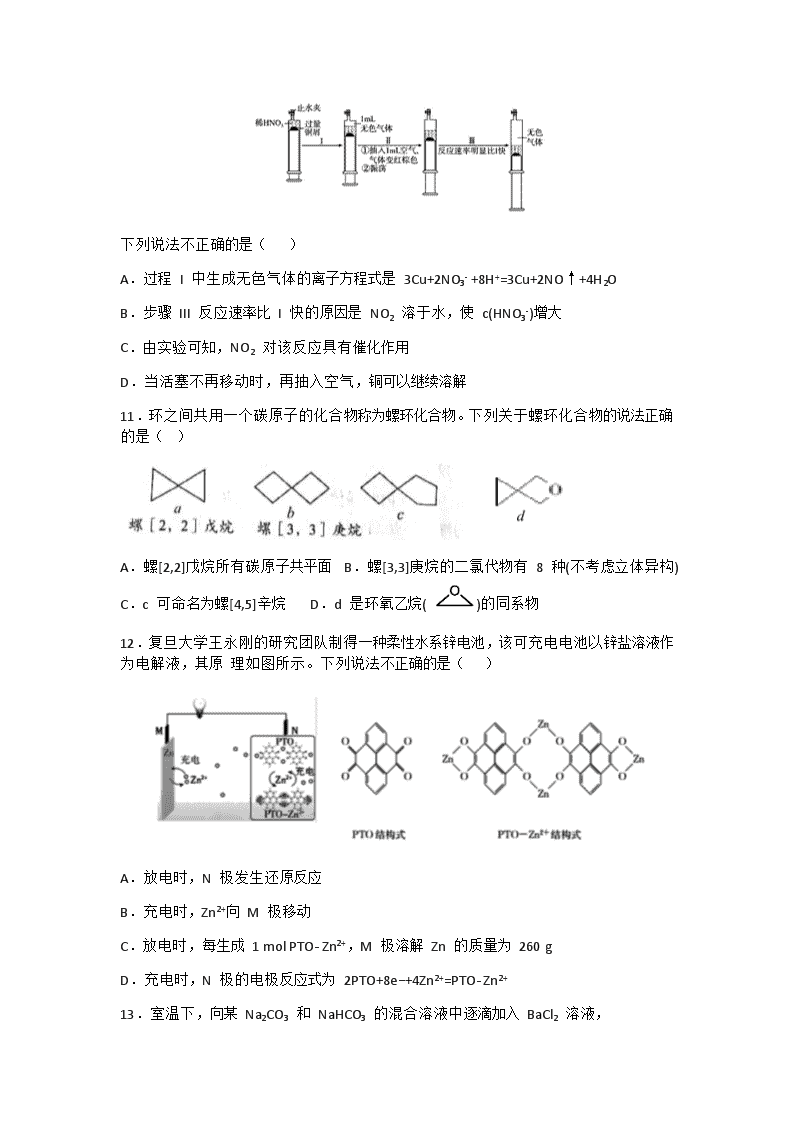
树德中学高 2018 级高三上学期 10 月阶段性测试 理综化学试题 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Co-59 Cu-64 Zn-65 第Ⅰ卷(选择题共 126分) 一、选择题:本大题共 13 小题,每小题 6 分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生产和生活密切相关。下列有关说法正确的是( ) A“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”具有胶体的性质 B“司南之杓(注:勺),投之于地,其柢(注:柄)指南。”司南中“杓”所用的材质为 FeO C.古代记载文字的器物“甲骨”与 “丝帛”成分相同 D.我国自主研发的“龙芯 4000 系列”CPU 芯片与光导纤维是同种材料 8.捕获二氧化碳生成甲酸的过程如图所示。下列说法不正确的是(NA 为阿 伏加德罗常数的值) ( ) A.10.1gN(C2H5) 3 中所含的共价键数目为 2.1NA B.标准状况下,22.4LCO2中所含的电子数目为 22NA C.在捕获过程中,二氧化碳分子中的共价键均断裂 D.100g 46%的甲酸水溶液中所含的氧原子数目为 5NA 9.原子序数依次增大的短周期元素 X、Y、Z、W、M 可形成 a、b 两种化合物(如图),a 为核磁共振氢谱 中常见的参照物,b 为有机合成中的一种还原剂。下列说法错误的是( ) A.原子半径:W>M>Z B.元素的非金属性:Z>M C.W 的最高价氧化物的水化物具有两性 D.常温常压下 X 与 Z 形成的化合物为气态 10.一定温度下,探究铜与稀 HNO3 的反应过程如下: 下列说法不正确的是( ) A.过程 I 中生成无色气体的离子方程式是 3Cu+2NO3- +8H+=3Cu+2NO↑+4H2O B.步骤 III 反应速率比 I 快的原因是 NO2 溶于水,使 c(HNO3-)增大 C.由实验可知,NO2 对该反应具有催化作用 D.当活塞不再移动时,再抽入空气,铜可以继续溶解 11.环之间共用一个碳原子的化合物称为螺环化合物。下列关于螺环化合物的说法正确的是( ) A.螺[2,2]戊烷所有碳原子共平面 B.螺[3,3]庚烷的二氯代物有 8 种(不考虑立体异构) C.c 可命名为螺[4,5]辛烷 D.d 是环氧乙烷( )的同系物 12.复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原 理如图所示。下列说法不正确的是( ) A.放电时,N 极发生还原反应 B.充电时,Zn2+向 M 极移动 C.放电时,每生成 1 mol PTO- Zn2+,M 极溶解 Zn 的质量为 260 g D.充电时,N 极的电极反应式为 2PTO+8e−+4Zn2+=PTO- Zn2+ 13.室温下,向某 Na2CO3 和 NaHCO3 的混合溶液中逐滴加入 BaCl2 溶液, 溶液中 lgc(Ba2+)与 的变化关系如图所示。下列说法正确的是( ) (已知:H2CO3 的 Ka1、Ka2 分别为 4.2×10−7、5.6×10−11) A.a 对应溶液的 pH 小于 b B.b 对应溶液的 c(H+)=4.2×10−7mol·L-1 C.a→b 对应的溶液中减小 D.a 对应的溶液中一定存在:2c(Ba2+)+c(Na+)+c(H+)=3c(HCO3 )+c(Cl )+c(OH ) 第Ⅱ卷 三、非选择题:包括必考题和选考题两部分。第 22 题~第 32 题为必考题,每个试题考生都必须做答。 第 33 题~第 38 题为选考题,考生根据要求做答。 26.(14 分)实验室利用如图装置探究 SO2 还原 CuO,并进一步检测产物含量。 已知 Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题: Ⅰ.SO2 还原 CuO 的探究 (1)装置 B 中宜放入的试剂为 , 消膜泡的作用是 (2)使用 98%的 H2SO4 溶液制备 SO2 的速率明显小于使用 65%的 H2SO4 溶液制备 SO2,原因是 (3)充分反应后,黑色固体变为红色。取 C 中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉 淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出 SO2 与 CuO 反应的方程式为 Ⅱ.生成物中 CuSO4 含量检测 (4)用“碘量法”测定产物中 CuSO4 含量。取 mg 固体溶解于水配制为 250mL 溶液,取 20.00mL 溶液滴加几滴稀硫酸,再加入过量 KI 溶液,以淀粉为指示剂用 Na2S2O3 标准溶液滴定,相关化学反应为 2Cu2++4I−=2CuI↓+I2,I2+I− I3−,I2+2S2O32-=S4O62-+2 I− ①Na2S2O3 标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、 、玻璃棒和试剂瓶。 ②若消耗 0.1000mol/LNa2S2O3 标准溶液 VmL,则产物中 CuSO4 质量分数为 (写表达式)。 ③CuI 沉淀物对 I3 −具有强的吸附能力,由此会造成 CuSO4质量分数测定值 _(填“偏大”或“偏小”)。为减 少实验误差,滴定过程中,常常在接近终点时加入 KSCN,使 CuI 转化为溶解度更小的 CuSCN,该沉淀物对 I3 吸附能力极弱,KSCN 加入太早,I2 的浓度较大,I2 会将 SCN 氧化生成 SO42-和 ICN,该反应的离子方程式为 27.(15 分)CO2 是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中 CO2 的平衡对生态环 境保护有着重要意义。 I.可利用 CH4 与 CO2 制备合成气(CO、H2),在某一钢性密闭容器中 CH4、CO2 的分压分别为 15kPa、20kPa, 加入 Ni/α-A12O3 催化剂并加热至 1123K 使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g) (1)研究表明 CO 的生成速率 v(CO)=1.28×10−2·p(CH4)·p(CO2)(kPa·s−1),某时刻测得 p(H2)=10kPa,则该时 刻 v(CH4)= kPa·s−1。 (2)达到平衡后,测得 CO 的产率为 50%,则该反应的平衡常数 Kp= (kPa)2 。 (3)科学家提出制备“合成气反应历程分两步: 反应①:CH4(g)=C(ads)+2H2(g)(慢反应) 反应②:C(ads)+CO2(g)=2CO(g)(快反应) 上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图所示: CH4 与 CO2 制备合成气的热化学方程式为 。 能量变化图中:E5+E1 E4+E2(填“>”、“<”或“=”)。 II.CO2 催化加氢制甲醇 5MPa 时,往某密闭容器中按投料比 n(H2):n(CO2)=3:1 充入 H2 和 CO2,发生以下反应: i.CO2 (g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.4kJ·mol−1 ii.CO2 (g)+H2(g) CO(g)+H2O(g) ΔH=+41.2kJ·mol−1 iii.CO(g)+2H2(g) CH3OH(g) ΔH=-90.6kJ·mol−1 反应达到平衡时,测得各组分的物质的量分数随温度变化的 曲线如右图所示。 (4)①体系中 CO2 的物质的量分数受温度的影响不大,原因是 ②下列措施中,无法提高甲醇平衡产率的是 _(填标号) A.加入适量 CO B.增大压强 C.循环利用原料气 D.升高温度 ③如上图 X、Y 分别代表 、 (填化学式)。 III.利用铜基配合物 1,10-phenanthroline-Cu 催化剂电催化 CO2 还原制备碳基燃料(包括 CO、烷烃和酸等)可减少 CO2 在大气中累积和实现可再生能源有效利用,其装置原理如图所示。 (5)①电池工作过程中,图中 Pt 电极附近溶液的 pH (填“变大”或“变小”),阴极的电极反应式为 。 ②每转移 2mol 电子,阴极室溶液质量增加 g。 28.(14 分)下面是一种从废电池正极材料(含铝箔、LiCoO2、Fe2O3 及少量不溶于酸碱的导电剂)中回收 各种金属的工艺流程: 资料: ①黄钠铁矾晶体颗粒粗大,沉淀速度快,易于过滤。 ②钴酸锂难溶于水,碳酸锂的溶解度随温度升高而降低。 回答下列问题: (1)从经济效益的角度考虑,为处理“碱溶”后所得滤液,可向其中通入过量 CO2,请写出所发生反应的化学反应方程式 。 (2)“酸浸”时有无色气体产生,写出发生反应的离子方程式 。 (3)“沉铁”时采用的“黄钠铁矾法”与传统的通过调整溶液 pH 的“氢氧化物沉淀法”相比,金属离子的损失少, 请分析并说明原因: 。 (4)“沉锂”后得到碳酸锂固体的实验操作为 。 (5)上述流程中用到“抽滤”操作,其原理装置图如下,“抽滤”时抽气泵的作用是 。 (6)下图为二水合草酸钴(CoC2O4·2H2O,M=183g/mo1)在空气中受热的质量变化曲线,曲线中 300 ℃及以 上所得固体均为钴氧化物。 ①加热到 150 ℃时,固体物质的化学式为 。 ②加热到 225~300 ℃过程中发生反应的化学方程式为 35.【化学——选修 3:物质结构与性质】(15 分) 2019 年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂 电池领域所做出的巨大贡献。请回答下列问题: (1)LiCoO2、LiFePO4 常用作锂离子电池的正极材料。基态 Co 原子核外电子排布式为 。 (2)[Co(NO3)4]2-中 Co2+的配位数为 4,配体中 N 的杂化方式为 ,该配离子中各元素的第一电离 能由小到大的顺序为 (填元素符号),1mol 该配离子中含s 键数目为 NA。 (3)Co3+在水中易被还原成 Co2+,而在氨水中可稳定存在,其原因为 。 (4)LiFePO4 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷 酸根离子、三磷酸根离子如图所示: 这类磷酸根离子的化学式可用通式表示为 (用 n 代表 P 原子数)。 (5)钴蓝晶体结构如图,该立方晶胞由 4 个 I 型和 4 个Ⅱ型小立方体构成,其化学式为 ,晶体中 Al3+占据 O2-形成的 (填“四面体空隙”或“八面体空隙”)。NA 为阿伏加德罗常数的值,钴蓝晶体的密度为 g·cm-3(列计算式)。 36.【化学——选修 5:有机化学基础】(15 分)(略) 答案查看更多