2021版高考化学一轮复习专题8溶液中的离子反应1弱电解质的电离平衡课件苏教版
专题
8
溶液中的离子反应
第一单元 弱电解质的电离平衡
考点
1:
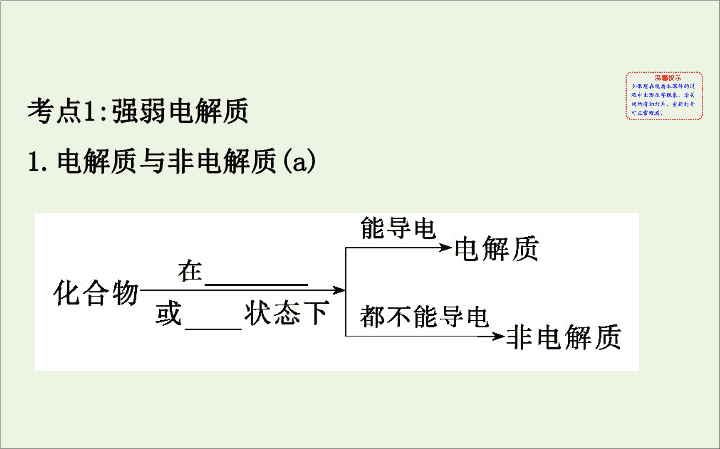
强弱电解质
1.
电解质与非电解质
(a)
2.
强电解质与弱电解质
(a)
强电解质
弱电解质
定义
在水溶液中能
_____
_____
的电解质
在水溶液中只能
___
_______
的电解质
电离程度
_____
电离
_____
电离
电离过程
_______
过程
,
无电
离平衡
_____
过程
,
存在电
离平衡
完全
电离
部
分电离
全部
部分
不可逆
可逆
强电解质
弱电解质
溶液中存
在粒子
(
水
分子不计
)
只有电离出的阴、
阳离子
,
不存在电
解质分子
既有电离出的阴、
阳离子
,
又有电解
质分子
与物质类
别的关系
(1)
绝大多数的盐
(
包括难溶性盐
)
(2)_____
(3)_____
(1)
水
(2)_____
(3)_____
强酸
强碱
弱酸
弱碱
3.
电离方程式的书写
(b)
(1)
强电解质
:
如
H
2
SO
4
:__________________
。
(2)
弱电解质。
①一元弱酸
,
如
CH
3
COOH:______________________
。
H
2
SO
4
====2H
+
+
CH
3
COOH CH
3
COO
-
+H
+
②
多元弱酸
,
分步电离
,
且第一步电离程度远远大于第
二步的电离程度
,
如
H
2
CO
3
:_____________________
_________________
。
③多元弱碱
,
一步完成
,
如
Fe(OH)
3
:
_____________________
。
H
2
CO
3
+H
+
,
+H
+
Fe(OH)
3
Fe
3+
+3OH
-
(3)
酸式盐。
①强酸的酸式盐
,
如
NaHSO
4
:
_____________________
。
②弱酸的酸式盐。如
NaHCO
3
:
___________________,________________
___
。
NaHSO
4
====Na
+
+H
+
+
NaHCO
3
====Na
+
+
H
+
+
【
典例精析
】
【
典例
】
(2018·
浙江
4
月学考真题
)
相同温度下
,
关于盐酸和醋酸两种溶液的比较
,
下列说法正确的是
(
)
世纪金榜导学号
A.pH
相等的两溶液中
:
c
(CH
3
COO
-
)=
c
(Cl
-
)
B.
分别中和
pH
相等、体积相等的两溶液
,
所需
NaOH
的物质的量相同
C.
相同浓度的两溶液
,
分别与金属镁反应
,
反应速率相同
D.
相同浓度的两溶液
,
分别与
NaOH
固体反应后呈中性的溶液中
(
忽略溶液体积变化
):
c
(CH
3
COO
-
)=
c
(Cl
-
)
【
解题思路
】
(1)
对于物质的量浓度均为
c
的一元强酸和一元弱酸
,
因为其电离程度不同
,
故有
c
(H
+
)
强酸
=
c
,
而
c
(H
+
)
弱酸
<
c
,
因此强酸的氢离子浓度大
,
与同种金属反应快。
(2)
所有溶液均为电中性
,
即阳阴离子所带正负电荷的总数相等
,
注意溶液中电荷守恒的应用。
【
解析
】
选
A
。电荷守恒
,
c
(H
+
) =
c
(CH
3
COO
-
)+
c
(OH
-
),
c
(H
+
)=
c
(Cl
-
)+
c
(OH
-
),pH
相等
,
所以溶液中的
c
(H
+
)
、
c
(OH
-
)
都相等
,
所以
c
(CH
3
COO
-
)=
c
(Cl
-
),A
正确
;pH
相等
的两溶液
,
酸性越弱
,
浓度越大
,
相同体积所含的物质的
量就越多
,
所以中和醋酸时需要更多的
NaOH,B
错误
;
溶
液中的
c
(H
+
)
越大
,
与镁反应速率越快
,
同浓度的两溶液
,
盐酸完全电离
,
醋酸部分电离
,
所以盐酸反应速率更快
,C
错误
;
相同浓度的两溶液
,
分别与
NaOH
固体反应后呈中性的溶液中
,
c
(CH
3
COO
-
)=
c
(Na
+
),
c
(Cl
-
)=
c
(Na
+
),
但盐酸需要消耗更多的
NaOH,
盐酸中和后的溶液中
c
(Na
+
)
更大
,
故
c
(CH
3
COO
-
)<
c
(Cl
-
),D
错误。
【
考题变式
】
在一定温度下
,
有
a.
盐酸
b.
醋酸两种酸
,
当二者
c
(H
+
)
相同且体积相同时
,
同时加入足量形状、密度、质量完全相同的锌
,
若产生相同体积的
H
2
(
相同状况
),
则开始时反应速率的大小关系为
____________,
反应所需时间的长短关系是
____________,
最终生成氢气的物质的量的多少关系为
____________
。
提示
:
a=b
a>b
b>a
。盐酸是强酸
,
完全电离
,
醋酸是弱酸
,
部分电离
,
相同温度下
,
相同
pH
的盐酸和醋酸溶液
,
醋酸浓度大
,
相同体积的两种溶液
,
加足量的锌充分反应后
,
刚开始时
c
(H
+
)
相同
,
反应速率相等
,
随着反应的进行
,
醋酸继续电离产生
H
+
,
使
c
(H
+
)
大于盐酸
,
所以反应速率快于盐酸
,
所用时间较短
,
最后醋酸产生的氢气也比盐酸多。
【
强化训练
】
1.
思维诊断
(
正确的打“√”
,
错误的打“
×”)
(1)
强电解质的溶液一定比弱电解质的溶液导电性强。
(
)
提示
:
×
。决定溶液导电性的是溶液中自由移动的离子浓度和离子所带电荷数。
(2)
强电解质都是离子化合物
,
而弱电解质都是共价化合物。
(
)
提示
:
×
。部分共价化合物也是强电解质
,
如强酸
(HCl)
。
(3)
稀醋酸加水稀释
,
醋酸电离程度增大
,
溶液的
pH
减小。
(
)
提示
:
×
。加水稀释虽然醋酸电离程度增大
,
n
(H
+
)
增大
,
但溶液体积也增大
,
体积增大是主要因素
,
故
pH
增大。
(4)
常温下由
0.1 mol·L
-1
一元碱
BOH
溶液的
pH=10,
可推知
BOH
溶液存在
BOH====B
+
+OH
-
。
(
)
提示
:
×
。一元碱
BOH
所电离的
c
(OH
-
)=10
-4
mol·L
-1
,
没有完全电离
,
所以是弱碱。
(5)
向
0.1 mol·L
-1
HF
溶液加水稀释或加入少量
NaF
晶体时都会引起溶液中
c
(H
+
)
减小。
(
)
提示
:
√
。加水会使
HF
溶液的酸性减弱
,
c
(H
+
)
减小
,
加入
NaF
晶体会使
HF
的电离平衡逆向进行
,
c
(H
+
)
减小。
2.(2017·
浙江
4
月选考真题
)
室温下
,
下列事实不能说明
NH
3
·H
2
O
为弱电解质的是
(
)
A.0.1 mol·L
-1
NH
3
·H
2
O
的
pH
小于
13
B.0.1 mol·L
-1
NH
4
Cl
溶液的
pH
小于
7
C.
相同条件下
,
浓度均为
0.1 mol·L
-1
的
NaOH
溶液和氨水
,
氨水的导电能力弱
D.0.1 mol·L
-1
NH
3
·H
2
O
能使无色酚酞试液变红色
【
解析
】
选
D
。若
NH
3
·H
2
O
为强电解质
,
则
0.1 mol·L
-1
NH
3
·H
2
O
电离出的
c
(OH
-
)=0.1 mol·L
-1
,pH=13,
而弱电
解质部分电离
,
电离出的
c
(OH
-
)<0.1 mol·L
-1
,pH<13,A
选项正确
;0.1 mol·L
-1
NH
4
Cl
溶液的
pH
小于
7,
说明
水解
,
即 为弱碱阳离子
,
则氨水为弱碱
,B
选项正确
;
相同条件下
,
相同浓度的
NaOH
溶液和氨水
,
氨水的导电
能力弱
,
说明氨水中自由移动的离子浓度小
,
则可以说明氨水为弱电解质
,C
选项正确
;
能使无色酚酞试液变红色
,
只能说明氨水呈碱性
,
不能说明氨水是强碱还是弱碱
,D
选项错误。
3.(2016·
上海高考
)
能证明乙酸是弱酸的实验事实是
(
)
A.CH
3
COOH
溶液与
Zn
反应放出
H
2
B.0.1 mol·L
-1
CH
3
COONa
溶液的
pH
大于
7
C.CH
3
COOH
溶液与
Na
2
CO
3
反应生成
CO
2
D.0.1 mol·L
-1
CH
3
COOH
溶液可使紫色石蕊变红
【
解析
】
选
B
。
CH
3
COOH
溶液与
Zn
反应放出
H
2
只能证明乙
酸是酸
,
不能证明是弱酸
, A
错误
;0.1 mol·L
-1
CH
3
COONa
溶液的
pH
大于
7,
证明
CH
3
COONa
溶液中的
CH
3
COO
-
能够发生水解反应
,
存在水解平衡
,
从而可以证
明乙酸是弱酸
,B
正确
; CH
3
COOH
溶液与
Na
2
CO
3
反应生成
CO
2
只能证明乙酸的酸性比碳酸强
,
不能证明乙酸是弱
酸
,C
错误
; 0.1 mol·L
-1
CH
3
COOH
溶液可使紫色石蕊变红只能证明乙酸是酸
,
不能证明乙酸是弱酸
,D
错误。
4.
将
0.1 mol·L
-1
CH
3
COOH
溶液加水稀释或加入少量
CH
3
COONa
晶体时都会引起
(
)
A.CH
3
COOH
电离程度变大
B.
溶液
pH
减小
C.
溶液的导电能力减弱
D.
溶液中
c
(H
+
)
减小
【
解析
】
选
D
。
CH
3
COOH CH
3
COO
-
+H
+
,
加水时
,
c
(CH
3
COOH)
、
c
(CH
3
COO
-
)
、
c
(H
+
)
都减小
,
平衡右移
,pH
增大
,
导电能力减弱
,
电离程度增大。加入少量
CH
3
COONa
晶体时
,
使
c
(CH
3
COO
-
)
增大
,
平衡左移
,
电离程度减小
,
c
(H
+
)
减小
,pH
增大
,
导电能力增强。
【
归纳总结
】
判断强弱电解质的“四个”依据
1.
依据弱电解质的定义判断
如测得
0.1 mol
·
L
-1
的
CH
3
COOH
溶液的
pH>1,
说明
CH
3
COOH
是弱酸。
2.
依据物质的类别进行判断
中学阶段
(
信息题除外
)
通常遇到的酸除
6
大强酸
(
盐酸、硫酸、硝酸、高氯酸、氢溴酸和氢碘酸
)
外
,
其余均为弱酸
;
碱中除
4
大强碱
(
氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡
)
外
,
其余均为弱碱
;
盐大多数为强电解质。
3.
依据电离平衡移动判断
弱电解质溶液中存在电离平衡
,
条件改变
,
平衡发生移动。如
pH=1
的
CH
3
COOH
加水稀释
10
倍
,1
7
。
考点
2:
外界因素对电离平衡的影响
1.
电离平衡的建立
(b)
在一定条件
(
如温度、浓度等
)
下
,
当弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等时
,
电离过程就达到平衡。平衡建立过程如图所示
:
2.
电离平衡的特征
(b)
3.
外界条件对电离平衡的影响
(b)
(1)
温度
:
温度升高
,
电离平衡
_____
移动
,
电离程度
___
___
。
(2)
浓度
:
稀释溶液
,
电离平衡
_____
移动
,
电离程度
___
___
。
向右
增
大
向右
增
大
(3)
同离子效应
:
加入与弱电解质具有相同离子的强电
解质
,
电离平衡
_____
移动
,
电离程度
_____
。
(4)
加入能反应的物质
:
电离平衡
_____
移动
,
电离程度
_____
。
向左
减小
向右
增大
【
典例精析
】
【
典例
】
(2016·
浙江高考
)
苯甲酸钠
( ,
缩
写为
NaA)
可用作饮料的防腐剂。研究表明苯甲酸
(HA)
的抑菌能力显著高于
A
-
。已知
25 ℃
时
,HA
的
K
a
=6.25×
10
-5
,H
2
CO
3
的
K
a1
=4.17×10
-7
,
K
a2
=4.90×10
-11
。在生产
碳酸饮料的过程中
,
除了添加
NaA
外
,
还需加压充入
CO
2
气
体。下列说法正确的是
(
温度为
25 ℃,
不考虑饮料中其
他成分
)
世纪金榜导学号
(
)
A.
相比于未充
CO
2
的饮料
,
碳酸饮料的抑菌能力较低
B.
提高
CO
2
充气压力
,
饮料中
c
(A
-
)
不变
C.
当
pH
为
5.0
时
,
饮料中
=0.16
D.
碳酸饮料中各种粒子的浓度关系为
c
(H
+
)=
c
(
)
+
c
(
)+
c
(OH
-
)-
c
(HA)
【
解题思路
】
(1)
电离平衡属于化学平衡
,
当外界条件改变时
,
弱电解质的电离平衡也会发生移动
,
平衡移动也遵循勒夏特列原理。
(2)
明确气体的溶解度与压强的关系。
(3)
灵活运用电离常数的表达式计算。
【
解析
】
选
C
。由题意知苯甲酸
(HA)
的抑菌能力显著高
于
A
-
,
因碳酸饮料溶液具有一定的酸性
,
会生成苯甲酸
(HA),
相比于未充
CO
2
的饮料
,
其抑菌能力较强
,
故
A
项错
误
;
增大压强会增大气体的溶解度
,
因此提高
CO
2
充气压
力
,
饮料的酸性增强
,
所以
c
(A
-
)
减小
,
故
B
项错误
;
根据
HA H
+
+A
-
,
K
a
= =6.25×10
-5
,
故当溶
液的
pH
为
5.0
时
,
饮料中
=0.16,
故
C
项
正确
;
由于饮料中加入的各种成分的量不知
,
且加入碳
酸的量也不知
,
因此无法比较饮料中各离子的浓度关
系。
【
考题变式
】
(1)
加压充入
CO
2
时
,HA
的
K
a
有变化吗
?
提示
:
没有。温度不变
,
K
a
不变。
(2)
冷藏保存的该饮料中
,
c
(A
-
)
有何变化
?
提示
:
减小。冷藏时温度降低
,HA
的电离平衡左移
,
c
(A
-
)
减小。
【
强化训练
】
1.
思维诊断
(
正确的打“√”
,
错误的打“
×”)
(1)
电离平衡右移
,
电解质分子的浓度一定减小
,
离子的浓度一定增大。
(
)
提示
:
×
。对于
CH
3
COOH CH
3
COO
-
+H
+
平衡后
,
加入
冰醋酸
,
再次平衡时
,
c
(CH
3
COOH)
比原平衡时大
;
加水稀
释或加少量
NaOH
固体
,
都会引起平衡右移
,
但
c
(CH
3
COOH)
、
c
(H
+
)
都比原平衡时要小。
(2)
某醋酸溶液的
pH=
a
,
将此溶液稀释
1
倍后
,
溶液的
pH=
b
,
则
a
>
b
。
(
)
提示
:
×
。醋酸溶液稀释后
,
c
(H
+
)
减小
pH
增大。
(3)
氨气溶于水
,
当
c
(OH
-
)=
c
(
)
时
,
表明
NH
3
·H
2
O
电
离处于平衡状态。
(
)
提示
:
×
。
NH
3
+H
2
O NH
3
·H
2
O +OH
-
,
NH
3
·H
2
O
电离出的
c
(OH
-
)
与
c
( )
永远相等
,
不能表
明
NH
3
·H
2
O
电离处于平衡状态。
2.
稀氨水中存在着电离平衡
:NH
3
·H
2
O
+OH
-
,
若要使平衡向逆反应方向移动
,
同时使
c
(OH
-
)
增大
,
应加
入适量的物质是
(
)
①NH
4
Cl
固体 ②硫酸 ③
NaOH
固体 ④水 ⑤加热
⑥加入少量
MgSO
4
固体
A.①②③⑤
B.③⑥
C.③
D.③④
【
解析
】
选
C
。若在氨水中加入
NH
4
Cl
固体
,
c
( )
增
大
,
平衡向逆反应方向移动
,
c
(OH
-
)
减小
,①
选项不合题
意
;
硫酸中的
H
+
与
OH
-
反应
,
使
c
(OH
-
)
减小
,
平衡向正反应
方向移动
,②
选项不合题意
;
当在氨水中加入
NaOH
固体
后
,
c
(OH
-
)
增大
,
平衡向逆反应方向移动
,③
项符合题意
;
若在氨水中加入水
,
稀释溶液
,
平衡向正反应方向移动
,
但
c
(OH
-
)
减小
,④
选项也不合题意
;
电离属吸热过程
,
加热平衡向正反应方向移动
,
c
(OH
-
)
增大
,⑤
不符合题意
;
加入
MgSO
4
固体发生反应
Mg
2+
+2OH
-
====Mg(OH)
2
↓,
溶液中
c
(OH)
-
减小
,
电离平衡正向移动
,⑥
不符合题意。
3.
已知
0.1 mol·L
-1
的醋酸溶液中存在电离平衡
:
CH
3
COOH CH
3
COO
-
+H
+
。要使溶液中
值增大
,
可以采取的措施是
(
)
A.
加入少量烧碱溶液
B.
降低温度
C.
加入少量冰醋酸
D.
加水
【
解析
】
选
D
。
A
项中加入少量的
NaOH
溶液
,
平衡向右移
动
,
c
(H
+
)
和
c
(CH
3
COOH)
的浓度都减小
,
但是前者减小的
程度更大
,A
项不正确
;
醋酸的电离是吸热的过程
,
降低
温度
,
平衡向左移动
,
c
(H
+
)
减小
,
c
(CH
3
COOH)
增大
,B
项错
误
;
加入少量冰醋酸
,
c
(H
+
)
和
c
(CH
3
COOH)
都增大
,
但是后
者增大的程度更大
,C
项错误
;
加水稀释
,
平衡向右移动
,
n
(H
+
)
增大
,
n
(CH
3
COOH)
减小
,
故 增大
,
值也增大
,D
项正确。
4.
在一定温度下
,
冰醋酸加水稀释过程中
,
溶液的导电能力如图所示
,
请回答
:
世纪金榜导学号
(1)“
O
”
点导电能力为
O
的理由是
_______________
___________________________________________
。
(2)a
、
b
、
c
三点溶液的
pH
由小到大的顺序为
______
____________________________________________
。
(3)a
、
b
、
c
三点溶液中
CH
3
COO
-
物质的量最大的是
________________
。
(4)
若使
c
点溶液中
c
(CH
3
COO
-
)
增大
,
溶液的
pH
也增大
,
可采取得措施是
____________________
。
(5)
现有
pH
均为
3
的醋酸、硫酸两瓶溶液
:
a.
设两种溶液的物质的量浓度依次为
c
1
、
c
2
,
则其关系式为
________________(
用“
<”“>”
或“
=”
表示
,
下同
)
。
b.
取相同体积的两种酸分别加入等体积的蒸馏水后
,
再分别加入等量的锌粉
,
反应开始时放出氢气的速率依次为
v
1
、
v
2
,
则其关系式为
____________________
。
【
解析
】
(1)
溶液的导电性与离子浓度有关
,
离子浓度
越大
,
导电性越强
,
冰醋酸中没有自由移动的离子
,
所以
冰醋酸不导电
;(2)
导电能力越强
,
离子浓度越大
,
氢离
子浓度越大
,a
、
b
、
c
三点的
c
(H
+
)
由小到大的顺序是
c
c
2
;b.
加水稀释促进
醋酸的电离
,
所以稀释后醋酸中氢离子的浓度大于硫酸中氢离子的浓度
,
则分别加入等量的锌粉
,
反应开始时放出氢气的速率
v
1
>
v
2
。
答案
:
(1)
冰醋酸中没有自由移动的离子
(2)b
c
2
b.
v
1
>
v
2
【
归纳总结
】
外界条件对电离平衡的影响
电离过程是可逆过程
,
可直接用化学平衡移动原理去分
析电离平衡。
以
0.1 mol
·
L
-1
CH
3
COOH
溶液为例
:
CH
3
COOH CH
3
COO
-
+H
+
。
实例
(
稀溶液
)
CH
3
COOH H
+
+CH
3
COO
-
Δ
H
>0
改变条件
平衡移
动方向
n
(H
+
)
c
(H
+
)
导电
能力
K
a
α
加水稀释
向右
增大
减小
减弱
不变
增大
加入少量
冰醋酸
向右
增大
增大
增强
不变
减小
加
HCl(g)
向左
增大
增大
增强
不变
减小
实例
(
稀溶液
)
CH
3
COOH H
+
+CH
3
COO
-
Δ
H
>0
加
NaOH(s)
向右
减小
减小
增强
不变
增大
加入镁粉
向右
减小
减小
增强
不变
增大
升高温度
向右
增大
增大
增强
增大
增大
考点
3:
有关电离平衡常数的计算
1.
电离平衡常数
(b)
(1)
表示方法
:
对于
AB A
+
+B
-
K
电离
=______________
。
(2)
特点
:
①
电离平衡常数只与温度有关
,
升温
,
K
值
_____
。
②多元弱酸分步电离逐级减弱
,
酸性强弱主要决定于
第一步电离
,
各级电离常数的大小关系为
________
______
。
增大
K
1
≫
K
2
≫
K
3
……
③
意义
2.
弱电解质的电离度
(c)
(1)
概念
:
弱电解质在溶液里达到电离平衡时
,
已电离的电解质分子数占原来总分子数的百分数。
(2)
计算公式
:
电离度
(
α
)=
_____________________
___×100%
=
×100%
=
×100%
【
典例精析
】
【
典例
】
(2017·
天津高考节选
)
已知
25 ℃,NH
3
·H
2
O
的
K
b
=1.8×10
-5
,H
2
SO
3
的
K
a1
=1.3×10
-2
,
K
a2
=6.2×10
-8
。
若氨水的浓度为
2.0 mol·L
-1
,
溶液中的
c
(OH
-
)=
________ mol·L
-1
。将
SO
2
通入该氨水中
,
当
c
(OH
-
)
降
至
1.0×10
-7
mol·L
-1
时
,
溶液中的
c
(
)/
c
(
)
=________
。 世纪金榜导学号
【
解题思路
】
(1)
正确运用电离常数的表达式计算。
(2)
碳酸是二元弱酸①电离方程式是
H
2
CO
3
H
+
+
,
H
+
+
;②
电离平衡常数表达式
:
K
a1
=
K
a2
=
③
比较大小
:
K
a1
>
K
a2
。
【
解析
】
根据
NH
3
·H
2
O
的
K
b
=1.8×10
-5
可知
,
c
( )·
c
(OH
-
)/
c
(NH
3
·H
2
O)=1.8×10
-5
,
若氨水的浓
度为
2.0 mol·L
-1
,
溶液中的
c
(OH
-
)=
c
( )=6.0×
10
-3
mol·L
-1
;
将
SO
2
通入该氨水中
,
当
c
(OH
-
)
降至
1.0
×10
-7
mol·L
-1
时
,
根据
H
2
SO
3
的
K
a2
=6.2×10
-8
可知
,
c
(H
+
)·
c
( )/
c
( )=6.2×10
-8
,
故当
c
(OH
-
)
降
至
1.0×10
-7
mol·L
-1
时
,
溶液中的
c
(
)/
c
(
)
=0.62
。
答案
:
6.0×10
-3
0.62
【
考题变式
】
(1)
将
SO
2
通入氨水时
,NH
3
·H
2
O
的
K
b
有变化吗
?
提示
:
没有。电离常数只与温度有关
,
与溶液的酸碱性无关。
(2)
将
SO
2
通入该氨水中
,
当
c
(OH
-
)
降至
1.0×
10
-7
mol·L
-1
时
,
溶液中的
c
(
)/
c
(H
2
SO
3
)
是多少
?
提示
:
8.06×10
4
。由
H
2
SO
3
的
K
a1
=
c
(H
+
)·
c
( )/
c
(H
2
SO
3
),
K
a2
=
c
(H
+
)·
c
( )/
c
( ),
c
(OH
-
)
降至
1.0×10
-7
mol·L
-1
时
,
c
(H
+
)=1.0×10
-7
mol·L
-1
,
可知
c
( )/
c
(H
2
SO
3
)=
K
a1
·
K
a2
/
c
2
(H
+
)=8.06×10
4
。
【
强化训练
】
1.
思维诊断
(
正确的打“√”
,
错误的打“
×”)
(1)H
2
CO
3
的电离常数表达式为
K
=
与
c
(
)
无关。
(
)
提示
:
×
。
H
2
CO
3
为多元弱酸
,
分两步电离
,
电离常数表达
式分别为
K
a1
=
K
a2
=
(2)
电离平衡常数可以表示弱电解质电离能力的相对强弱。
(
)
提示
:
√
。电离平衡常数越大
,
相同条件下弱电解质电离能力越强。
(3)
一定温度下
,
弱电解质加水稀释
,
电离度和电离平衡常数均不变。
(
)
提示
:
×
。加水稀释
,
电离度
(α)
增大
,
电离平衡常数不变。
(4)
对于
0.1 mol·L
-1
的氨水
,
加水稀释后
,
溶液中
c
(
)·
c
(OH
-
)
变小。
(
)
提示
:
√
。
c
( )
减小、
c
(OH
-
)
减小
,
乘积也减小。
(5)
向
CH
3
COOH
溶液中滴加相同浓度的氨水
,
先增大再减小。
(
)
提示
:
×
。因为
NH
3
·H
2
O
的电离常数
K
b
=
c
(OH
-
)·
c
( )
/
c
(NH
3
·H
2
O),
所以
c
( )/
c
(NH
3
·H
2
O)=
K
b
/
c
(OH
-
),
因为
K
b
不变
,
c
(OH
-
)
逐渐减小
,
所以
c
( )/
c
(NH
3
·H
2
O)
始终增大。
(6)
室温下
,
向
10 mL pH=3
的醋酸溶液中加水稀释后
,
溶
液中
不变。
(
)
提示
:
√
。
=
所以不变
(7)CH
3
COOH
溶液加水稀释后
,
溶液中
的值
减小。
(
)
提示
:
√
。此数值等于
c
(H
+
)/
K
,
c
(H
+
)
减小
,
K
不变
,
所以
此数值减小。
2.
已知室温时
,0.1 mol·L
-1
某一元酸
HA
在水中有
0.1%
发生电离
,
下列叙述错误的是
(
)
A.
该溶液的
pH=4
B.
升高温度
,
溶液的
pH
增大
C.
此酸的电离平衡常数约为
1×10
-7
D.
由
HA
电离出的
c
(H
+
)
约为水电离出的
c
(H
+
)
的
10
6
倍
【
解析
】
选
B
。由于
HA
中
c
(H
+
)=0.1 mol·L
-1
×0.1%
=1×10
-4
mol·L
-1
,
因此
pH=4,A
正确
;
由于弱电解质的电
离过程为吸热过程
,
温度升高
,
电离平衡向正反应方向
移动
,
从而使溶液中
c
(H
+
)
增大
,pH
减小
,B
错误
;
室温时
0.1 mol·L
-1
HA
溶液中
c
(H
+
)=
c
(A
-
)=1×10
-4
mol·L
-1
,
电离平衡常数
K
= ≈1×
10
-7
,C
正确
;
该溶液中
c
(H
+
)=1×10
-4
mol·L
-1
,
c
(OH
-
)
=1×10
-10
mol·L
-1
,
由
HA
电离出的
c
(H
+
)=1×
10
-4
mol·L
-1
,
由水电离出的
c
(H
+
)=1×10
-10
mol·L
-1
,
D
正确。
3.
已知下面三个数据
:7.2×10
-4
、
4.6×10
-4
、
4.9×
10
-10
分别是下列有关的三种酸的电离常数
(25 ℃),
若已知下列反应可以发生
:NaCN+HNO
2
====HCN+NaNO
2
NaCN+HF====HCN+NaF
NaNO
2
+HF====HNO
2
+NaF
。由此可判断下列叙述中不正确的是
(
)
A.
K
(HF)=7.2×10
-4
B.
K
(HNO
2
)=4.9×10
-10
C.
根据两个反应即可得出一元弱酸的强弱顺序为
HF>HNO
2
>HCN
D.
K
(HCN)<
K
(HNO
2
)<
K
(HF)
【
解析
】
选
B
。相同温度下
,
酸的电离常数越大
,
该酸的酸性越强
,
结合强酸制取弱酸分析可知
,
亚硝酸的酸性大于氢氰酸而小于氢氟酸
,
所以亚硝酸的电离平衡常数为
4.6×10
-4
,
故
B
错误。
4.(
新题预测
)
常温下
,
向
10 mL
b
mol·L
-1
的
CH
3
COOH
溶液中滴加等体积的
0.01 mol·L
-1
的
NaOH
溶液
,
充分反应后
,
混合后溶液呈中性
,
下列说法不正确的是 世纪金榜导学号
(
)
A.
b
>0.01
B.
溶液中
c
(CH
3
COO
-
)=
c
(Na
+
)
C.CH
3
COOH
的电离常数
K
a
=
D.
向
CH
3
COOH
溶液中滴加
NaOH
溶液的过程中
,
水的电离程
度逐渐减小
【
解析
】
选
D
。反应后溶液中
,
溶液呈中性
,
根据电荷守
恒
c
(Na
+
)+
c
(H
+
)=
c
(CH
3
COO
-
)+
c
(OH
-
)
得
:
c
(H
+
)=
c
(OH
-
),
c
(CH
3
COO
-
)=
c
(Na
+
)
说明醋酸过量
,
b
>0.01,A
、
B
正确
;
pH=7,
c
(H
+
)=10
-7
mol·L
-1
,
K
a
=
C
正确
;
在向
CH
3
COOH
溶液中滴加
NaOH
溶液的过程中
,
水的电离程度先变大后逐渐减小
,
因为酸、碱抑制水的电离
,D
错误。
【
归纳总结
】
(
以弱酸
HX
为例
)
1.
已知
c
(HX)
和
c
(H
+
),
求电离平衡常数
HX
H
+
+
X
-
起始
:
c
(HX) 0 0
平衡
:
c
(HX)-
c
(H
+
)
c
(H
+
)
c
(H
+
)
则
:
K
=
由于弱酸只有极少一部分电离
,
c
(H
+
)
的数值很小
,
可做
近似处理
:
c
(HX)-
c
(H
+
)≈
c
(HX)
。
则
K
=
代入数值求解即可。
2.
已知
c
(HX)
和电离平衡常数
,
求
c
(H
+
)
HX
H
+
+
X
-
起始
:
c
(HX) 0 0
平衡
:
c
(HX)-
c
(H
+
)
c
(H
+
)
c
(H
+
)
则
:
K
=
由于
K
值很小
,
c
(H
+
)
的数值很小
,
可做近似处理
:
c
(HX)-
c
(H
+
)≈
c
(HX)
。
则
:
c
(H
+
)=
,
代入数值求解即可。
3.
电离常数使用时需注意的三个方面
(1)
弱酸、弱碱的电离平衡常数能够反映酸碱性的相对强弱。电离平衡常数越大
,
电离程度越大。
(2)
电离平衡常数与其他化学平衡常数一样只与温度有关
,
与电解质的浓度无关
,
升高温度
,
K
值增大。
(3)
在运用电离平衡常数表达式进行计算时
,
浓度必须是平衡时的浓度。