- 2021-07-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学选修4人教版同步练习及测试题:第四章第二节 化学电源(人教版)
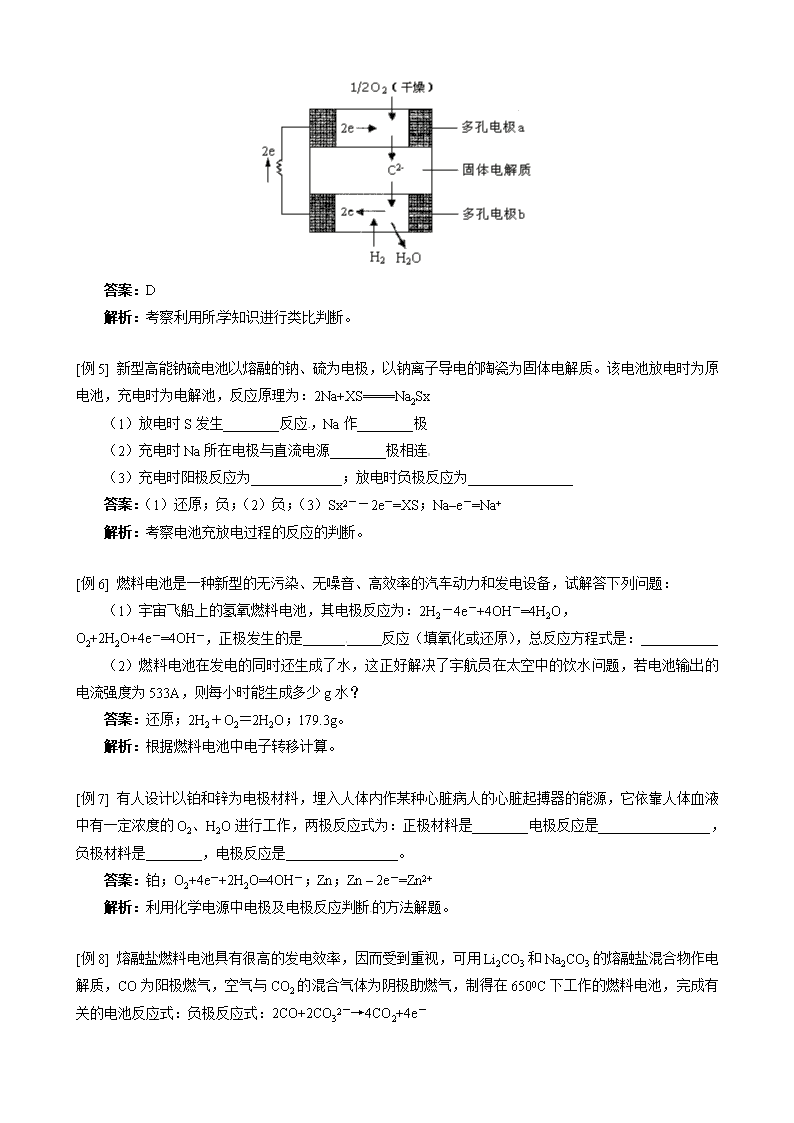
2011-2012学年高二化学选修4(人教版)同步练习第四章第二节 化学电源 一. 教学内容: 化学电源 二. 重点、难点: 1. 一次电池、二次电池和燃料电池的反应原理、性能及其应用是重点 2. 化学电池的反应原理是难点 三. 具体内容: 1. 化学电源的分类 2. 一次电池 (1)碱性锌锰电池 (2)锌银电池 (3)锂电池 3. 二次电池 (1)铅蓄电池放电过程 (2)铅蓄电池充电过程 4. 燃料电池 (1)氢氧燃料电池 (2)甲烷燃料电池 (3)甲醇燃料电池 (4)乙醇燃料电池 (5)液态肼燃料电池 【典型例题】 [例1] 氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应是根据此反应式判断,下列叙述中正确的是( ) A. 电池放电时,电池负极周围溶液的pH不断增大 B. 电池放电时,镍元素被氧化 C. 电池充电时,氢元素被还原 D. 电池放电时,H2是负极 答案:CD 解析:考察基本的二次电池各电极及反应判断。 [例2] 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( ) A. 电池工作时,锌失去电子 B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) C. 电池工作时,电子由正极通过外电路流向负极 D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g 答案:C 解析:考察原电池原理的应用。 [例3] 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是( ) A. 放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2 B. 充电时阳极反应为:Fe(OH)3 -3e- + 5 OH-= FeO+ 4H2O C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 D. 放电时正极附近溶液的碱性增强 答案:C 解析:判断二次电池充放电过程的判断。 [例4] 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( ) A. 有O2放电的a极为电池的负极 B. 有H2放电的b极为电池的正极 C. a极对应的电极反应为O2+2H2O+4e-=4OH- D. 该电池的总反应方程式为 答案:D 解析:考察利用所学知识进行类比判断。 [例5] 新型高能钠硫电池以熔融的钠、硫为电极,以钠离子导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+XS====Na2Sx (1)放电时S发生________反应,Na作________极 (2)充电时Na所在电极与直流电源________极相连 (3)充电时阳极反应为_____________;放电时负极反应为_______________ 答案:(1)还原;负;(2)负;(3)Sx2--2e-=XS;Na–e-=Na+ 解析:考察电池充放电过程的反应的判断。 [例6] 燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,试解答下列问题: (1)宇宙飞船上的氢氧燃料电池,其电极反应为:2H2-4e-+4OH-=4H2O, O2+2H2O+4e-=4OH-,正极发生的是___________反应(填氧化或还原),总反应方程式是:___________ (2)燃料电池在发电的同时还生成了水,这正好解决了宇航员在太空中的饮水问题,若电池输出的电流强度为533A,则每小时能生成多少g水? 答案:还原;2H2+O2=2H2O;179.3g。 解析:根据燃料电池中电子转移计算。 [例7] 有人设计以铂和锌为电极材料,埋入人体内作某种心脏病人的心脏起搏器的能源,它依靠人体血液中有一定浓度的O2、H2O进行工作,两极反应式为:正极材料是________电极反应是________________,负极材料是________,电极反应是________________。 答案:铂;O2+4e-+2H2O=4OH-;Zn;Zn – 2e-=Zn2+ 解析:利用化学电源中电极及电极反应判断的方法解题。 [例8] 熔融盐燃料电池具有很高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气体为阴极助燃气,制得在6500C下工作的燃料电池,完成有关的电池反应式:负极反应式:2CO+2CO32-→4CO2+4e- 正极反应式________________总电池反应式________________ 答案:O2+2CO2+4e-=2CO32-;2CO+O2=2CO2 解析:判断熔融盐条件的燃料电池判断。 【模拟试题】(答题时间:25分钟) 1. 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( ) A. a电极是负极 B. b电极的电极反应为: C. 氢氧燃料电池是一种具有应用前景的绿色电源 D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 2. 有a、b、c、d四种金属,将a与b用导线连结起来,浸入电解质溶液中,b不易腐蚀,将a、d分别投入等浓度盐酸中,d比a反应剧烈,将铜投入b的盐溶液里,无明显变化。如果把铜浸入c的盐溶液里,有金属c析出,据此判断它们的活动性由强到弱的顺序是( ) A. dcab B. dabc C. dbac D. badc 3. 将铂丝插入KOH溶液作电极,然后向两个电极上分别通入甲烷和O2,可以形成一个原电池。由于发生的反应类似甲烷的燃烧,所以称作燃料电池,根据两极上反应的实质判断通入甲烷的一极为电池的___极,若反应生成CO32-和H2O,则这一极的电极反应式为____________ 4. 镍氢电池是近年开发出来的可充电电池,它可以取代会产生污染的镍镉蓄电池。镍氢电池的总反应式是:H2+2NiO(OH)=2Ni(OH)2。根据此反应式判断,下列叙述正确的是( ) A. 电池放电时,镍元素被氧化 B. 电池放电时,氢是负极反应物,被氧化 C. 电池放电时,电子流入H2极 D. 电池放电时,氢是正极反应物,被还原 5. 铅蓄电池可放电亦可充电,它是用硬橡胶或透明塑料制成方形外壳,在正极板上有一层棕褐色的 ,负极板是海绵状的 ,两极均浸入 溶液中,且两极间用微孔橡胶或微孔塑料隔开。负极: ,正极: ,放电总反应式: 。 6. 汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 +Pb+2H2SO4=2PbSO4↓+2H2O,根据此反应判断下列叙述中正确的是( ) A. PbO2是电池的负极 B. 负极的电极反应式为:Pb+SO–2e – = PbSO4↓ C. PbO2得电子,被氧化 D. 电池放电时,溶液酸性增强 7. 随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首要原因是( ) A. 利用电池外壳的金属材料 B. 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 C. 不使电池中渗泄的电解液腐蚀其他物品 D. 回收其中石墨电极 8. 可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应: ① Br2 + 2e- = 2Br- ② 2Br- - 2e- = Br2 ③ Zn – 2e- = Zn2+ ④ Zn2+ + 2e- = Zn,其中表示充电时的阳极反应和放电时的负极反应的分别是( ) A. ②和③ B. ②和① C. ③和① D. ④和① 9. 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH-2CO32- + 6H2O,则下列说法正确的是( ) A. 构成该电池的正极和负极必须是两种活性不同的金属 B. 充电时有CH3OH生成的电极为阳极 C. 放电时电解质溶液的pH逐渐增大 D. 放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O E. 充电时每生成1 mol CH3OH转移12mol电子 10. 下列关于化学电源的叙述错误的是( ) A. 普通锌锰干电池中碳棒为正极 B. 铅蓄电池中覆盖着PbO2的电极板是负极板 C. 氢氧燃料电池的正极是通入氧气的那一极 D. 碱性锌锰干电池的能量和储存时间比普通锌锰干电池高 11. 根据下列事实,判断离子的氧化性顺序为:① A+B2+===A2++B;② D+2H2O=== D(OH)2+H2↑;③ 以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+ ( ) A. D2+>A2+>B2+>E2+ B. D2+>E2+>A2+>B2+ C. E2+>B2+>A2+>D2+ D. A2+>B2+>D2+>E2+ 12. 下列变化中属于原电池反应的是( ) A. 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 B. 在空气中金属铝表面迅速被氧化形成保护膜 C. 红热的铁丝与水接触表面形成蓝色保护层 D. 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 【试题答案】 1. B 2. B 3. 负;CH4+10OH--8e-=CO32-+7H2O 4. B 5. PbO2;金属铅;硫酸;Pb+SO42--2e-=PbSO4;PbO2+4H++SO42-+2e-= PbSO4+2H2O;Pb+ PbO2+2H2SO4= 2PbSO4+2H2O 6. B 7. B 8. A 9. D 10. B 11. C 12. AD 【试题解析】 1. 考察对于燃料电池电极反应的判断。B电极是电源的正极,应该是氧化剂氧气反应。 2. 根据原电池中正极被保护,而正极是金属性较弱的金属;金属与酸反应越剧烈,活动性越强;金属和盐的置换规律是前换后。 3. 判断常见燃料电池的碱性介质下的电极反应。 4. A中放电时,Ni是氧化剂,被还原;C中氢气是负极,应是电子流出;D中氢气应是负极反应物。 5. 了解铅蓄电池的基本电极和电极反应。 8. 放电时是原电池,应发生自发的氧化还原反应,负极应是还原剂反应,而充电时,阳极应是发生氧化反应的,即为逆向反应的还原剂。 9. A中可以都是惰性电极;B中该反应是氧化剂在反应,应是阴极;C中放电时消耗 OH-,pH减小;E中应是转移6mol。 11. 离子的氧化性与金属的活泼性成反比,置换反应应为活泼的换不活泼的,能与水反应的比能置换的金属要活泼,原电池的还原剂是金属性。查看更多