- 2021-07-05 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省清远市方圆培训学校2020届高三化学模拟试题精练(八)
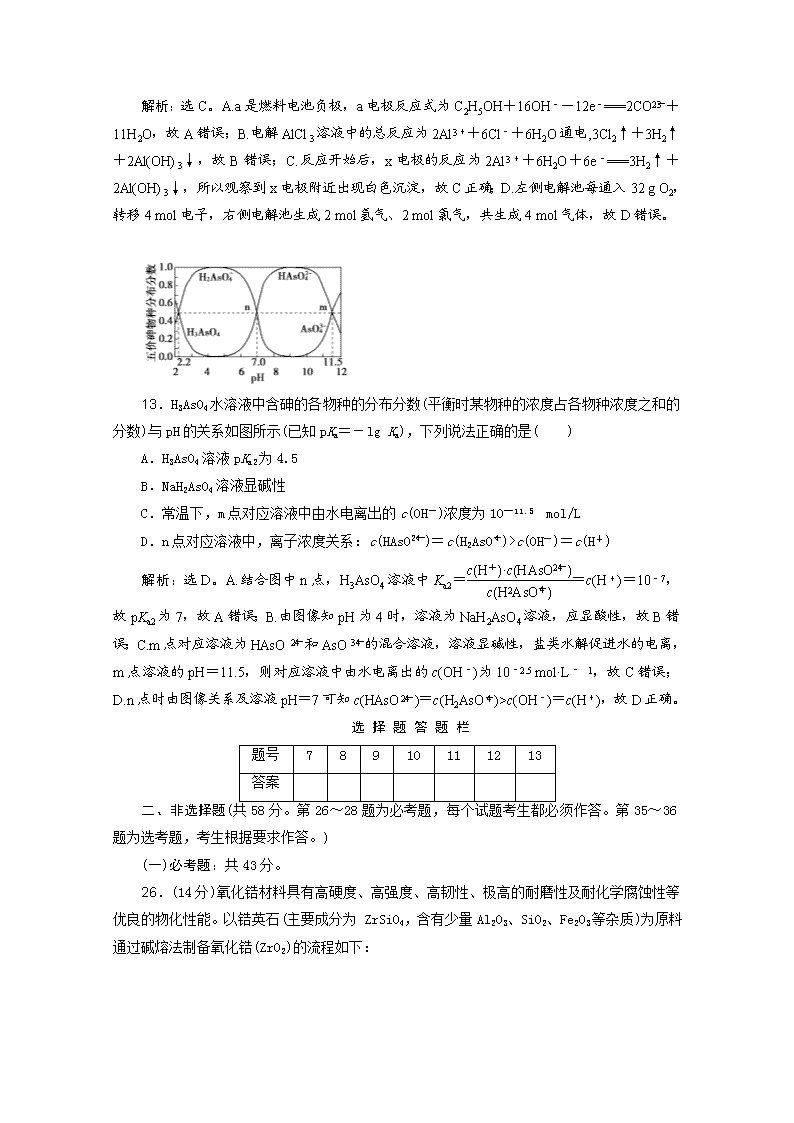
广东省清远市方圆培训学校2020届 化学模拟试题精练(八) (考试用时:50分钟 试卷满分:100分) 7.现代生活需要提升我们的科学素养,以下说法科学的是( ) A.某护肤品广告宣称产品不含任何化学成分 B.日用铝制品表面不需要刷漆防腐蚀 C.汽车尾气中的氮氧化物是由汽油不完全燃烧引起的 D.为了防腐保鲜,可在蔬菜表面洒少量福尔马林 解析:选B 所有物质都含有化学成分,不含化学成分的物质不存在,故A错误;铝与空气中的氧气反应生成致密的氧化膜,阻止铝与氧气继续反应,所以日用铝制品表面不用刷漆防腐蚀,故B正确;汽油的主要成分是C和H元素构成的烃类物质,汽油中不含N元素,所以汽车尾气中氮氧化物的产生与汽油是否完全燃烧无关,故C错误;福尔马林是甲醛的水溶液,甲醛有毒,不能用于食品的防腐保鲜,故D错误。 8.设NA为阿伏加德罗常数的值。下列说法错误的是( ) A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH的数目为0.1NA B.质量均为1.7 g的OH-和—OH,所含质子数目均为0.9NA C.1.0 mol Na2O2和1.0 mol Na2S混合后阴离子总数为2NA D.60 g SiO2晶体中,含有SiO4四面体结构单元的数目为NA 解析:选A。A.由于NH4Cl溶液中存在NH的水解,所以1 L 0.1 mol·L-1 NH4Cl溶液中NH的数目小于0.1NA,故A错误;B.电子质量忽略不计,质量均为1.7 g的OH-和—OH,所含质子数目均为0.9NA,故B正确;C.1.0 mol Na2O2 中含有1.0 mol过氧根离子,1.0 mol Na2O2和1.0 mol Na2S 混合后阴离子总数为2NA,故C正确;D.n(SiO2)=60 g/60 g·mol-1=1 mol,每个Si原子和四个O原子形成四面体结构,所以60 g SiO2晶体中Si原子个数为NA,所含SiO4四面体数为NA,故D正确;故选A。 9.化学与材料、生活和环境密切相关。下列有关说法中错误的是( ) A.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 B.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 C.日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 D.神舟十号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 解析:选C。A.煤的干馏可得到煤焦油、焦炉气、粗苯等,而煤焦油经蒸馏又可得到苯、二甲苯等重要的化工原料;煤经气化、液化可得到甲醇等清洁能源,A正确;B.利用CO2合成聚碳酸酯类可降解塑料,这样将CO2转化为可降解塑料,实现了“碳”的循环利用,B正确;C.日常生活中人们大量使用铝制品,是因为常温下铝能与氧气反应生成致密的氧化铝保护膜,阻止了铝的进一步被氧化,C项错误;D.太阳能电池的材料是硅,D正确。 10.满足下列条件的同分异构体(不考虑立体异构)的数目判断正确的是( ) 选项 A B C D 分子式 C4H10O C3H7Cl C8H10 C4H8O2 已知条件 与钠生成H2 卤代烷烃 芳香烃 能水解 同分异构体数目 4 3 3 3 解析:选A。A.根据分子式,能和金属钠反应生成H2,该物质为醇类,丁基有四种结构,所以该醇有4种同分异构体,故A正确;B.C3H7Cl是一个氯原子取代丙烷一个氢原子,丙基存在2种结构,所以一氯丙烷有2种同分异构体,故B错误;C.分子式为C8H10的芳香烃,分子中含有1个苯环,故侧链为烷基,若有1个侧链,为—CH2—CH3,一种结构;若有2个侧链,为—CH3,有邻、间、对三种结构,总共4种同分异构体,故C错误;D.分子式为C4H8O2的有机物可水解,属于饱和一元酯,若为甲酸和丙醇酯化,形成的酯有2种;若为乙酸和乙醇酯化,只能形成一种酯;若为丙酸和甲醇酯化,形成的酯有1种;可形成的酯共有4种,故D错误。 11.A、B、C、D、E是原子序数依次增大的五种短周期元素,且B、C相邻,A在周期表中原子半径最小,C最外层电子数是次外层的三倍,D的简单阳离子和它的含氧酸根离子反应可生成白色沉淀,E单质常温下是黄绿色气体。下列说法中正确的是( ) A.元素的简单离子半径:D>C>B B.A与B两种元素共同形成的10电子粒子有2种 C.B的最高价氧化物对应水化物的酸性比E的最高价氧化物对应水化物的酸性弱 D.由A、B、C三种元素构成的物质一定是共价化合物 解析:选C。由题意可推知A、B、C、D、E分别为H、N、O、Al、Cl。A.电子层结构相同的离子,原子序数大,半径小,故离子半径:N3->O2->Al3+,即B>C>D,故A错误;B.A与B两种元素共同形成的10电子粒子有NH3、NH 、NH,故B错误;C.B为N,E为Cl,非金属性越强,最高价氧化物对应水化物的酸性越强,氯的非金属性比氮强,故C正确;D.A、B、C组成的化合物可能是硝酸也可能是硝酸铵,所以可能是共价化合物也可能是离子化合物,故D错误。 12.某电池的简易装置图如图所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( ) A.a电极反应式为C2H5OH+12OH--12e-===2CO2↑+9H2O B.AlCl3溶液中的总反应为2Cl-+2H2O===Cl2↑+H2↑+2OH- C.反应开始后,观察到x电极附近出现白色沉淀 D.左侧电解池每通入32 g O2,右侧电解池共生成2 mol气体 解析:选C。A.a是燃料电池负极,a电极反应式为C2H5OH+16OH--12e-===2CO+11H2O,故A错误;B.电解AlCl3溶液中的总反应为2Al3++6Cl-+6H2O通电,3Cl2↑+3H2↑+2Al(OH)3↓,故B错误;C.反应开始后,x电极的反应为2Al3++6H2O+6e-===3H2↑+2Al(OH)3↓,所以观察到x电极附近出现白色沉淀,故C正确;D.左侧电解池每通入32 g O2,转移4 mol电子,右侧电解池生成2 mol氢气、2 mol氯气,共生成4 mol气体,故D错误。 13.H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示(已知pKa=-lg Ka),下列说法正确的是( ) A.H3AsO4溶液pKa2为4.5 B.NaH2AsO4溶液显碱性 C.常温下,m点对应溶液中由水电离出的c(OH-)浓度为10—11.5 mol/L D.n点对应溶液中,离子浓度关系:c(HAsO)=c(H2AsO)>c(OH-)=c(H+) 解析:选D。A.结合图中n点,H3AsO4溶液中Ka2==c(H+)=10-7,故pKa2为7,故A错误;B.由图像知pH为4时,溶液为NaH2AsO4溶液,应显酸性,故B错误;C.m点对应溶液为HAsO和AsO的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5 mol·L- 1,故C错误;D.n点时由图像关系及溶液pH=7可知c(HAsO)=c(H2AsO)>c(OH-)=c(H+),故D正确。 选 择 题 答 题 栏 题号 7 8 9 10 11 12 13 答案 二、非选择题(共58分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。) (一)必考题:共43分。 26.(14分)氧化锆材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下: 25 ℃时,有关离子在水溶液中沉淀时的pH数据: Fe(OH)3 Zr(OH)4 Al(OH)3 开始沉淀时pH 1.9 2.2 3.4 沉淀完全时pH 3.2 3.2 4.7 请回答下列问题: (1)流程中为提高化学反应速率的措施有___________。 (2)操作Ⅰ的名称是___________,滤渣2的成分为___________。 (3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式为___________。 (4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是________________________。 (5)写出“高温煅烧”过程的化学方程式______________________________。 根据ZrO2的性质,推测其两种用途______________________________________________。 解析:(1)锆英石状态为固态,为提高反应速率,可以通过将矿石粉碎,以增大接触面积;或者通过加热升高反应温度的方法加快反应速率;(2)操作Ⅰ是分离难溶于水的固体与可溶性液体物质的方法,名称是过滤;(3)将粉碎的锆英石与NaOH在高温下发生反应:ZrSiO4+4NaOHNa2ZrO3+Na2SiO3+2H2O;Al2O3+2NaOH===2NaAlO2+H2O;SiO2+2NaOH===2Na2SiO3+H2O;Fe2O3是碱性氧化物,不能与碱发生反应,所以水浸后过滤进入滤渣1中,Na2ZrO3、Na2SiO3、NaAlO2能溶于水,水浸、过滤进入滤液1中;(4)向滤液中加入足量盐酸,HCl会与Na2ZrO3、Na2SiO3、NaAlO2发生反应,生成NaCl、H2SiO3(或H4SiO4)、AlCl3、ZrCl4,其中H2SiO3(或H4SiO4)难溶于水,过滤时进入滤渣2中,其余进入滤液2中,因此滤渣2的成分为H2SiO3(或H4SiO4);向滤液2中加入氨水,发生复分解反应,调节溶液的pH至大于沉淀完全时Zr(OH)4的pH,而低于开始形成Al(OH)3沉淀的pH,即3.2查看更多