- 2021-07-05 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届云南省曲靖市沾益县第一中学高二上学期第三次质量检测(2016
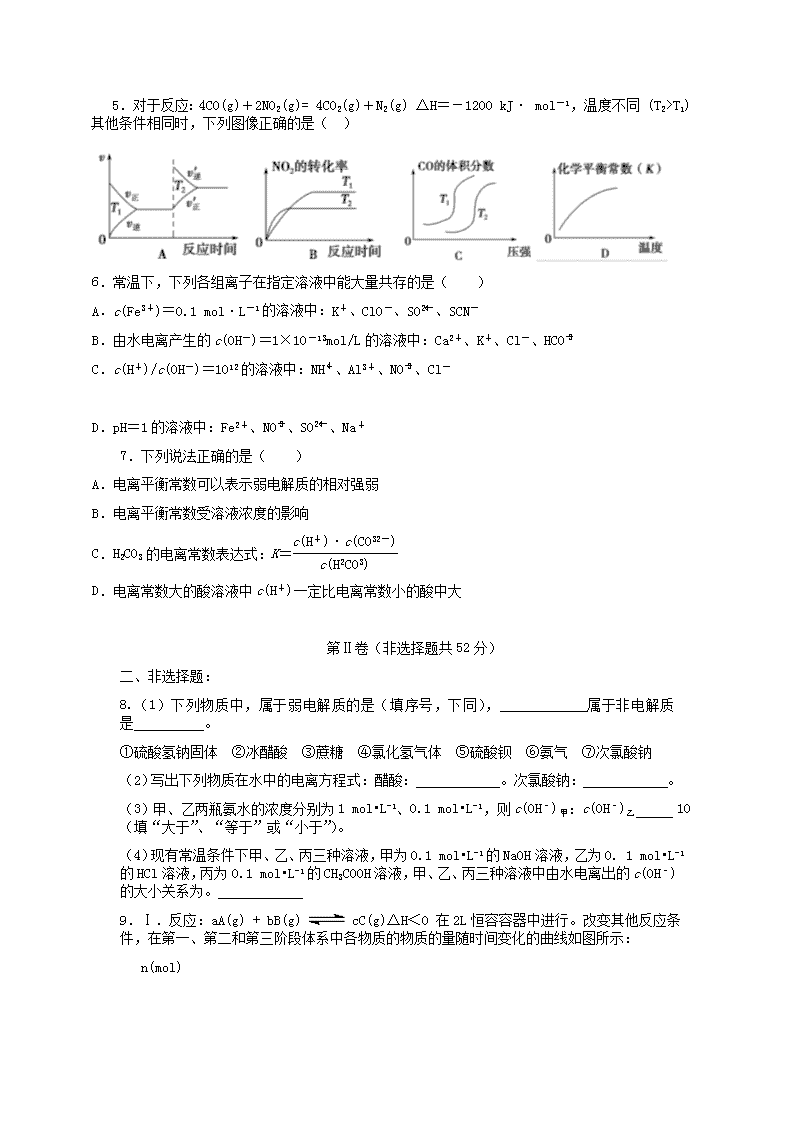
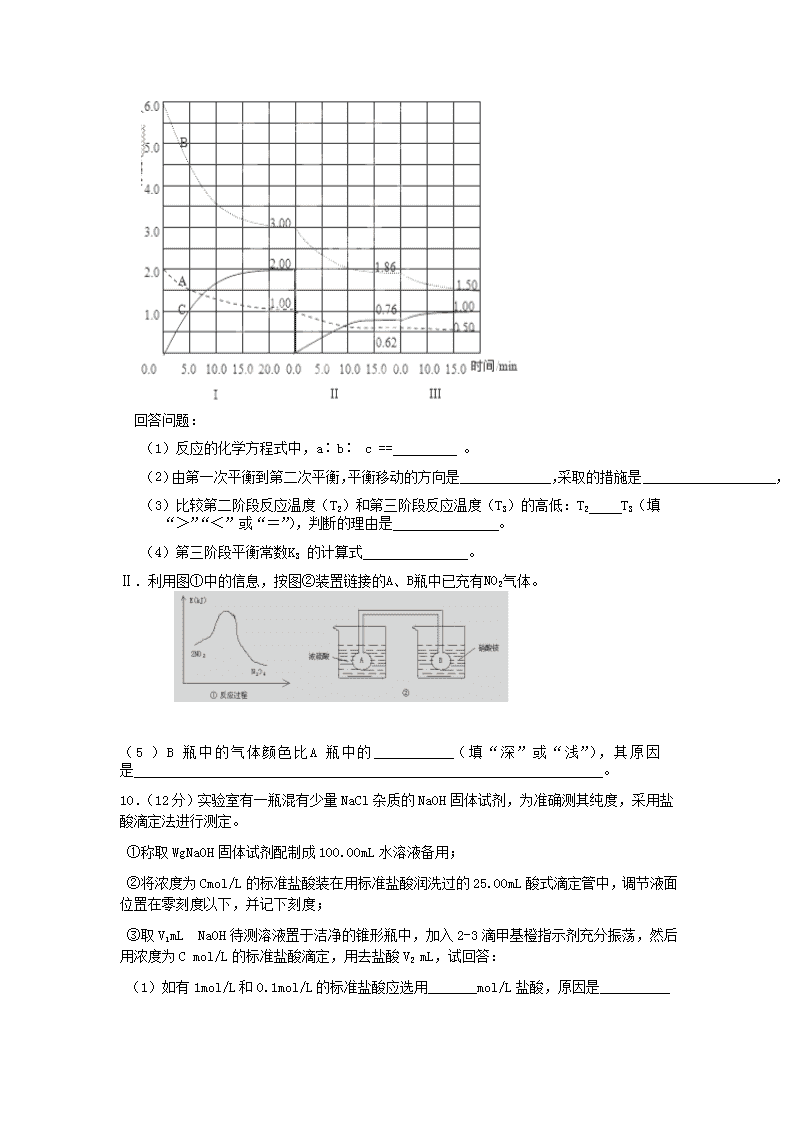
高二年级第三次质量检测 化学试卷 本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共24题,共100分)。 可能用到的相对原子质量:H 1 O 16 Na 23 C 12 第I卷(选择题 共42分) 一、选择题:每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。 1.在25°C、101kPa下,1g甲醇燃烧生成CO2和液态水放热22.68kJ,下列热化学方程式正确的( ) A.CH3OH(l)+3/2O(g)2=CO2(g)+2H2O(l);△H =+725.8kJ/mol B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H =-1452kJ/mol C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H =-725.8kJ/mol D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H =+1452kJ/mol 2.恒温恒容,可逆反应:2NO22NO+O2达到平衡状态的标志是( ) ①单位时间内生成n molO2的同时生成2n molNO2 ②2V (NO2、正)=V(O2、逆) ③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥ 混合气体的平均相对分子质量不再改变的状态 (A) ①④⑥ (B) ②④⑥ (C) ②③ (D) ①②⑤ 3.在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( ) A. 4molA+2molB B. 2molA+1molB+1molD C.1molA+0.5molB + 1.5molC+0.5molD D. 3molC+1molB+1molD+1molA 4.在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+,对于该平衡,下列叙述正确的是( ) A.加水,平衡向逆反应方向移动 B.滴加少量0.1mol/L HCl溶液,溶液中c(H+ )减少 C.加入少量CH3COONa固体,平衡向正反应方向移动 D.加入少量NaOH固体,平衡向正反应方向移动 5.对于反应:4CO(g)+2NO2(g)= 4CO2(g)+N2(g) △H=-1200 kJ· mol-1,温度不同 (T2>T1)其他条件相同时,下列图像正确的是( ) 6.常温下,下列各组离子在指定溶液中能大量共存的是( ) A.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO、SCN- B.由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO C.c(H+)/c(OH-)=1012的溶液中:NH、Al3+、NO、Cl- D.pH=1的溶液中:Fe2+、NO、SO、Na+ 7.下列说法正确的是( ) A.电离平衡常数可以表示弱电解质的相对强弱 B.电离平衡常数受溶液浓度的影响 C.H2CO3的电离常数表达式:K= D.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大 第Ⅱ卷(非选择题共52分) 二、非选择题: 8.(1)下列物质中,属于弱电解质的是(填序号,下同), 属于非电解质是 。 ①硫酸氢钠固体 ②冰醋酸 ③蔗糖 ④氯化氢气体 ⑤硫酸钡 ⑥氨气 ⑦次氯酸钠 (2)写出下列物质在水中的电离方程式:醋酸: 。次氯酸钠: 。 (3)甲、乙两瓶氨水的浓度分别为1 mol•L-1、0.1 mol•L-1,则c(OH﹣)甲:c(OH﹣)乙 10(填“大于”、“等于”或“小于”)。 (4)现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol•L-1的NaOH溶液,乙为0. 1 mol•L-1的HCl溶液,丙为0.1 mol•L-1的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为。 9.Ⅰ.反应:aA(g) + bB(g) cC(g)△H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示: n(mol) 回答问题: (1)反应的化学方程式中,a∶b∶ c == 。 (2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 , (3)比较第二阶段反应温度(T2)和第三阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 。 (4)第三阶段平衡常数K3 的计算式 。 Ⅱ.利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体。 (5)B瓶中的气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。 10.(12分)实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定。 ①称取WgNaOH固体试剂配制成100.00mL水溶液备用; ②将浓度为Cmol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度以下,并记下刻度; ③取V1 mL NaOH待测溶液置于洁净的锥形瓶中,加入2-3滴甲基橙指示剂充分振荡,然后用浓度为C mol/L的标准盐酸滴定,用去盐酸V2 mL,试回答: (1) 如有1mol/L和0.1mol/L的标准盐酸应选用_______mol/L盐酸,原因是__________ _______________ _____。 (1) 滴定终点的判断 。 (2) 若酸式滴定管尖嘴气泡未排出,会使碱测定值__________(偏大、偏小、无影响)。 (3) 不用标准盐酸润洗酸式滴定管,会使碱测定值__________(偏大、偏小、无影响)。 (4) 固体试剂NaOH纯度计算式为 。 11.(14分) Ⅰ.水的电离平衡线如图3—8所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点 (1)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为 。 (2) 室温时将PH为5的硫酸溶液稀释500倍,稀释后溶液中,C(SO42-)和C(H+)之比约为 。 Ⅱ.今有①CH3COOH ②HCl ③H2SO4三种溶液。根据要求回答下列问题: (1)当它们pH相同时,其物质的量浓度最大的是 (填序号)。 (2)当它们的物质的量浓度相同时,其pH最小是 (填序号)。 (3)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为 (填序号)。 (4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为 。 (5)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为 (填序号)。 高二化学期中试卷答案及评分标准 一、 选择题 题目 1 2 3 4 5 6 7 答案 B A C D B C A 二、 非选择题 8.(8分) (1) ② (1分) ③⑥ (1分) (2)CH3COOH CH3COO﹣+ H+ (1分) NaClO═ClO﹣+Na+ (1分) (3) 小于 (2分)(4)丙>甲=乙 (2分) 9. (14分) Ⅰ.(1) 1∶3∶2 (1分) (2) 正反应方向 (2分) 移走生成物C (2分) (3) ﹥ (2分) 此反应为放热反应,降低温度,平衡向正反应方向移动 (2分) (4) Ⅱ.(5) 浅 (1分) 2NO2N2O4 △H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅(2分) 10.(1)0.1 浓度越稀,误差越小 (2)溶液由黄色突变为橙色,且半分钟内不恢复原来颜色 (3)偏大 (4)偏大 (5)4cv2/wv1 ⅹ100% 11.Ⅰ(1)2:9 (2)1:10 Ⅱ (1)① (2)③ (3)①>②=③ (4)2:2:1 (5) ①<②=③查看更多