- 2021-07-05 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北省承德第一中学2019-2020学年高一下学期第4次月考化学试题
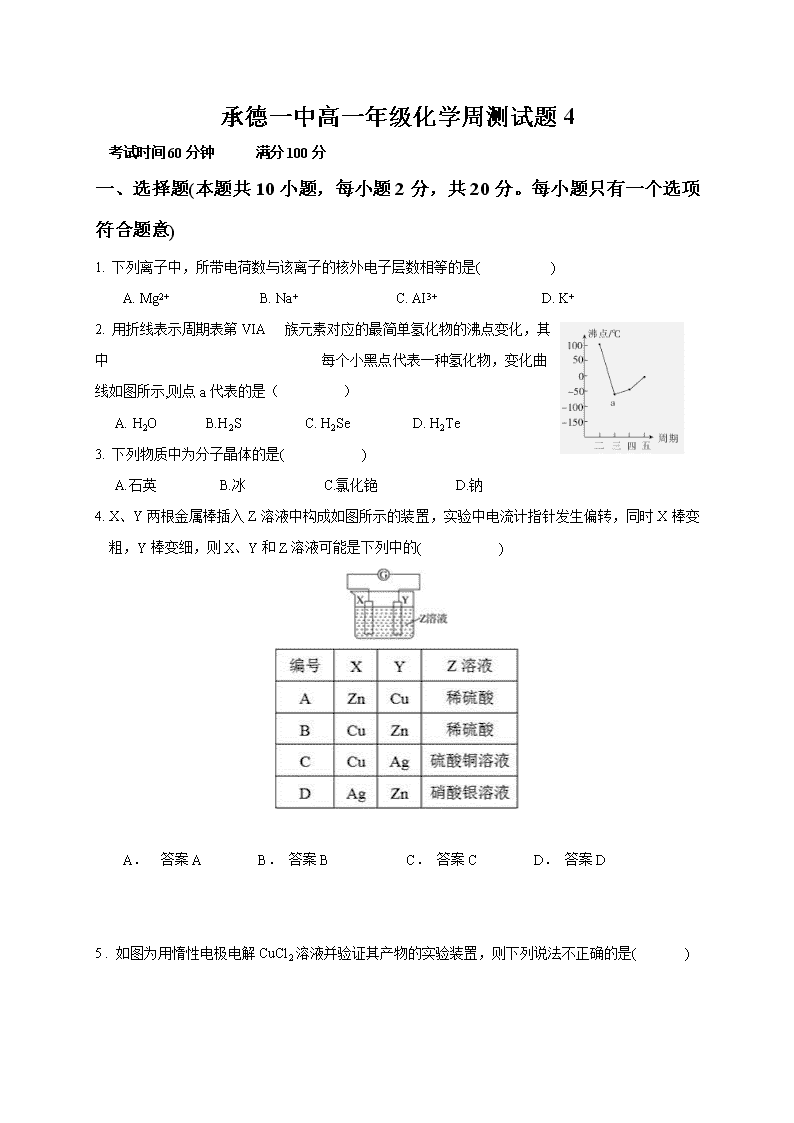
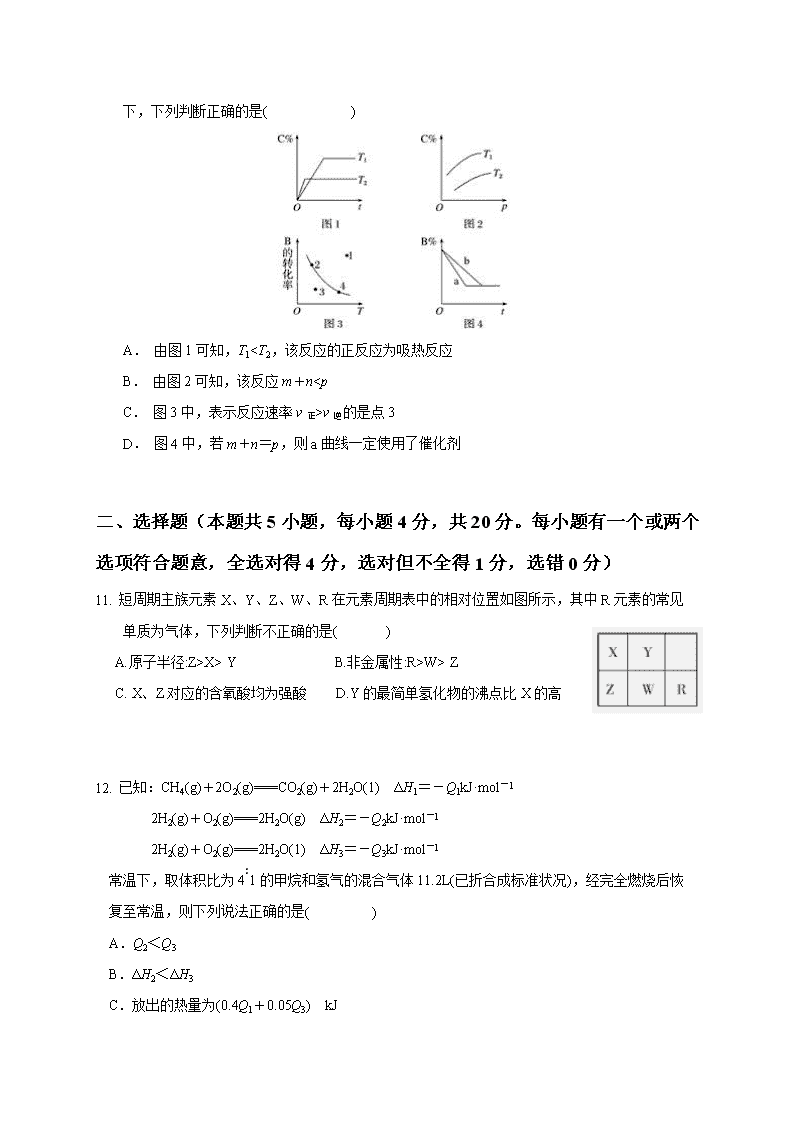
承德一中高一年级化学周测试题4 考试时间60分钟 满分100分 一、 选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意) 1. 下列离子中,所带电荷数与该离子的核外电子层数相等的是( ) A. Mg2+ B. Na+ C. AI3+ D. K+ 2. 用折线表示周期表第VIA族元素对应的最简单氢化物的沸点变化,其中 每个小黑点代表一种氢化物,变化曲线如图所示,则点a代表的是( ) A. H2O B.H2S C. H2Se D. H2Te 3. 下列物质中为分子晶体的是( ) A.石英 B.冰 C.氯化铯 D.钠 4. X、Y两根金属棒插入Z溶液中构成如图所示的装置,实验中电流计指针发生偏转,同时X棒变粗,Y棒变细,则X、Y和Z溶液可能是下列中的( ) A. 答案A B. 答案B C. 答案C D. 答案D 5 . 如图为用惰性电极电解CuCl2溶液并验证其产物的实验装置,则下列说法不正确的是( ) A. 电源a极为负极 B. KI 淀粉溶液会变蓝色 C. 电极Ⅰ上有固体析出 D. 电极Ⅰ上发生的电极反应为Cu-2e-===Cu2+ 6. 反应A(g)+ 3B(g) 2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( ) A.②③④① B.④③②① C.③④②① D.②④③① 7. 对于反应:X+YZ,下列条件的改变一定能使该化学反应的速率加快的是( ) A.升高温度 B.增加X的物质的量 C.增大压强 D.减少Y的物质的量 8. 下列关于反应3B(g) C(g)+D(g)的说法不正确的是( ) A.某时刻测得V正(B)=V逆(B),说明反应达到了化学平衡状态 B.反应达到化学平衡后,反应物和生成物的浓度不再改变 C.反应达到平衡后,反应就停止了 D.上述反应中,B不可能全部转化为C和D 9. 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间。图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( ) A. 4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0 B. N2O3(g)NO2(g)+NO(g) ΔH>0 C. 3NO2(g)+H2O(l)2HNO3(l)+NO(g) ΔH<0 D. CO2(g)+C(s)2CO(g) ΔH>0 10. 某化学研究小组探究外界条件对化学反应mA(g)+nB(g)p C(g)的速率和平衡的影响图像如下,下列判断正确的是( ) A. 由图1可知,T1查看更多