- 2021-07-05 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】北京市海淀区十九中2019-2020学年高二下学期期末考试(解析版)
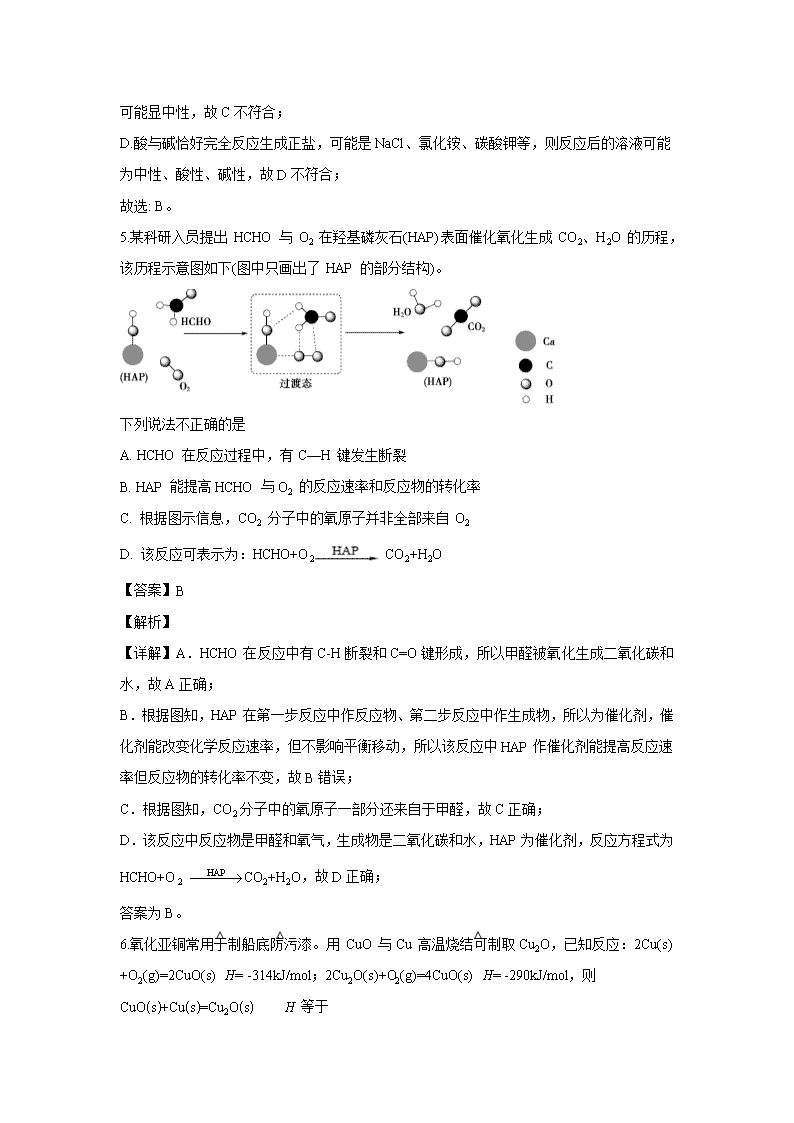
北京市海淀区十九中2019-2020学年高二下学期期末考试 可能用到的原子量:H1 C12 O16 第一部分(单项选择题) 1.下列反应不是氧化还原反应,但是吸热反应的是 A. 铝片与稀硫酸的反应 B. 灼热的碳与二氧化碳的反应 C. 甲烷在氧气中的燃烧 D. Ba(OH)2·8H2O 与 NH4Cl 的反应 【答案】D 【解析】 【详解】A. 铝片与稀硫酸的反应生成硫酸铝和氢气,有化合价变化,是氧化还原反应,是放热反应,故A不符合题意; B. 灼热的碳与二氧化碳的反应生成一氧化碳,有化合价变化,是氧化还原反应,是吸热反应,故B不符合题意; C. 甲烷在氧气中的燃烧生成二氧化碳和水,有化合价变化,是氧化还原反应,是放热反应,故C不符合题意; D. Ba(OH)2·8H2O与NH4Cl的反应生成氯化钡、氨气和水,没有化合价变化,是吸收反应,故D符合题意。 综上所述,答案为D。 2.在定温定容的密闭容器中合成SO3 ,下列能说明反应 2SO2(g)+O2(g)2SO3(g)达到化 学平衡状态的是 A. c(SO2 ):c(O2 ):c(SO3 )=2:1:2 B. 容器内的密度不再改变 C. SO2 的转化率不再改变 D. SO3 的生成速率与 SO2 的消耗速率相等 【答案】C 【解析】 【分析】 根据化学平衡状态的特征:当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。 【详解】A.当体系达平衡状态时,SO、O2和SO3的物质的量之比可能为2:1:2,也可能 不是2:1:2,与各物质的初始浓度及转化率有关,故A不选; B.反应过程中,气体的质量和容器的体积始终保持不变,容器内的密度不再改变,不能确定是否到达平衡状态,故B不选; C.SO2的转化率不再改变,正逆反应速率相等,达平衡状态,故C选; D.只要反应发生就有SO3的生成速率与SO2的消耗速率相等,故D不选; 故选C。 【点睛】本题考查了化学平衡状态的判断,注意当反应达到平衡状态时,正逆反应速率相等,但不为0,易错点D,SO3的生成速率与SO2的消耗速率均为正速率,始终相等。 3.工业合成氨的反应原理为N2(g)+3H2(g)2NH3(g) △H<0,下列措施既能加快反应速率又能提高产率的是 A. 增大压强 B. 分离出NH3 C. 升高温度 D. 使用催化剂 【答案】A 【解析】 【详解】A.增大压强平衡正向移动,产率提高,且化学反应速率加快,故A符合; B.分离出氨气,平衡正向移动,提高产率,但是化学反应速率减慢,故B不符合; C.升高温度化学反应速率加快,但是平衡逆向移动,产率降低,故C不符合; D.使用催化剂加快化学反应速率,但是平衡不移动,产率不变,故D不符合; 故选 A。 4.下列溶液一定呈中性的是 A. 使甲基橙试液呈黄色的溶液 B. c(H+)= c(OH-)=10-6mol/L 溶液 C. pH=7 的溶液 D. 酸与碱恰好完全反应生成正盐的溶液 【答案】B 【解析】 【详解】A.甲基橙变色范围是3.1~4.4,pH>4.4时溶液呈黄色,故加入甲基橙后呈黄色的溶液,可能为酸性、中性或碱性,故A不符合; B.c(H+)= c(OH-)的溶液呈中性,故B符合; C.常温下pH=7的溶液呈中性,水的电离是一个吸热过程,但在其他温度下pH= 7 的溶液不可能显中性,故C不符合; D.酸与碱恰好完全反应生成正盐,可能是NaCl、氯化铵、碳酸钾等,则反应后的溶液可能为中性、酸性、碱性,故D不符合; 故选: B。 5.某科研入员提出 HCHO 与 O2 在羟基磷灰石(HAP)表面催化氧化生成 CO2、H2O 的历程,该历程示意图如下(图中只画出了 HAP 的部分结构)。 下列说法不正确的是 A. HCHO 在反应过程中,有C—H 键发生断裂 B. HAP 能提高HCHO 与O2 的反应速率和反应物的转化率 C. 根据图示信息,CO2 分子中的氧原子并非全部来自 O2 D. 该反应可表示为:HCHO+O2 CO2+H2O 【答案】B 【解析】 【详解】A.HCHO在反应中有C-H断裂和C=O键形成,所以甲醛被氧化生成二氧化碳和水,故A正确; B.根据图知,HAP在第一步反应中作反应物、第二步反应中作生成物,所以为催化剂,催化剂能改变化学反应速率,但不影响平衡移动,所以该反应中HAP作催化剂能提高反应速率但反应物的转化率不变,故B错误; C.根据图知,CO2分子中的氧原子一部分还来自于甲醛,故C正确; D.该反应中反应物是甲醛和氧气,生成物是二氧化碳和水,HAP为催化剂,反应方程式为HCHO+O2 CO2+H2O,故D正确; 答案为B。 6.氧化亚铜常用于制船底防污漆。用 CuO 与Cu 高温烧结可制取Cu2O,已知反应:2Cu(s) +O2(g)=2CuO(s)△H= -314kJ/mol;2Cu2O(s)+O2(g)=4CuO(s)△H= -290kJ/mol,则CuO(s)+Cu(s)=Cu2O(s) △H 等于 A. -11kJ/mol B. -12kJ/mol C. +11kJ/mol D. -24kJ/mol 【答案】B 【解析】 【详解】已知反应:①2Cu(s) +O2(g)=2CuO(s)△H= -314kJ/mol;②2Cu2O(s)+O2(g)=4CuO(s)△H= -290kJ/mol,根据盖斯定律,将可得:CuO(s) + Cu(s)= Cu2O(s),则得△H=, 故选 B。 7.用电解的方法分析水的组成时,需向水中加入电解质,不宜选用的是 A. AgNO3 B. Na2SO4 C. NaOH D. H2SO4 【答案】A 【解析】 【详解】A.加入AgNO3,电解AgNO3溶液时阴极析出银,阳极产生氧气,不是电解水,故A符合题意; B.加入Na2SO4,增大溶液离子浓度,导电性增强,且不影响H2和O2的生成,故B不符合题意; C.加入NaOH,增大溶液离子浓度,导电性增强,且不影响H2和O2的生成,故C不符合题意; D.加入H2SO4,增大溶液离子浓度,导电性增强,且不影响H2和O2的生成,故D不符合题意; 答案为A。 8.某同学运用电解原理实现在铁棒上镀铜,设计如图装置,下列判断不正确是 A. a 是铁 B. 液体 c 可用硫酸铜溶液 C. 该实验过程中c (Cu2+)变小 D. b 上发生反应的方程式为 Cu-2e-= Cu2+ 【答案】C 【解析】 【分析】 要在铁棒上镀铜,则铁电极应发生还原反应生成铜单质,即铁电极为阴极,与负极相连,则b电极为阳极,发生氧化反应,要在铁电极生成铜单质,则溶液应为含铜的盐。 【详解】A. a为铁,发生还原反应生成铜,达到镀铜的目的,故A正确; B.电解质应含铜离子,可为硫酸铜等,故B正确; C.电镀时,阳极消耗铜,阴极析出铜,c(Cu2+)基本保持不变,故C不正确; D. b发生氧化反应,为Cu- 2e-= Cu2+,故D正确; 故选:C。 【点睛】电镀时,阴极为待镀金属,阳极为镀层金属。 9.下列事实能说明醋酸是弱电解质的是 ( ) A. 醋酸能使石蕊溶液变红 B. 时.醋酸的pH约为3 C. 向醋酸中加入氢氧化钠溶液,溶液pH增大 D. 醋酸能与碳酸钙反应产生气体 【答案】B 【解析】 【分析】 弱电解质在水溶液中不能完全电离,存在电离平衡,由此判断回答。 【详解】A项:使石蕊变红只能说明醋酸在溶液中已电离,但不能判断电离是否完全,A项错误; B项:醋酸的pH约为3,即c(H+)为0.001mol/L,醋酸未完全电离,为弱电解质,B项正确; C项:醋酸中加入氢氧化钠溶液,发生中和反应使c(H+)减小,溶液pH增大,不能判断醋酸电离是否完全,C项错误; D项:与碳酸钙反应产生气体,也只能证明醋酸有酸性,不能判断醋酸电离是否完全,D项错误。 本题选B。 【点睛】判断电解质强弱是看已溶解的电解质是否完全电离,与电解质的溶解度大小、溶液导电能力的强弱无关。 10.下列实验事实不能用平衡移动原理解释的是 A. 升高温度水的离子积增大 B. 镁条与氯化铵溶液反应生成氢气 C. 制备 H2 时用粗锌比纯锌的速率快 D. 压缩 NO2 的体积,气体的颜色先加深后逐渐变浅 【答案】C 【解析】 【详解】A.水的电离是吸热的过程,升高温度促进电离,水的离子积增大,能用平衡移动原理解释,故A不符合题意; B.氯化铵中的铵根离子水解显酸性,可以和金属镁反应产生氢气,所以与盐类水解平衡的移动有关,故B不符合题意; C.锌与硫酸反应生成氢气,粗锌和硫酸形成原电池,原电池能加快化学反应速率,与平衡移动无关,故C符合题意; D.存在平衡2NO2(g)⇌N2O4(g),增大压强,混合气体浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应方向移动,二氧化氮的浓度又降低,颜色又变浅,由于平衡移动的目的是减弱变化,而不是消除,故颜色仍比原来的颜色深,所以可以用平衡移动原理解释,故D不符合题意; 答案为C。 11.相同温度下,根据三种酸的电离常数,下列判断正确的是 酸 HX HY HZ 电离常数 K 9×10-7 9×10-6 1×10-2 A. 三种酸的强弱关系:HX>HY>HZ B. 反应 HX+Y-=HY+X-能够发生 C. 相同温度下,0.1 mol·L-1的NaX、NaY、NaZ 溶液,NaZ 溶液 pH 最小 D. 相同温度下,1 mol·L-1HX溶液的电离常数大于0.1 mol·L-1HX 【答案】C 【解析】 【详解】A.相同温度下,酸的电离平衡常数越大,则酸的电离程度越大,酸的酸性越强,根据电离平衡常数知,酸性HZ>HY>HX,故A错误; B.相同温度下,酸的电离平衡常数越大,则酸的电离程度越大,酸的酸性越强,根据电离平衡常数知,酸性HY>HX,则弱酸不能制取强酸,反应 HX+Y-===HY+X-不能够发生,故B错误; C.相同温度下,酸的电离平衡常数越大酸性越强,其对应酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小,根据电离平衡常数知,酸性HZ>HY>HX,则水解程度NaX>NaY>NaZ,所以相同浓度的钠盐溶液的pH:NaX>NaY>NaZ,NaZ 溶液 pH 最小,故C正确; D.电离平衡常数只与温度有关,与浓度无关,温度不变电离平衡常数不变,故D错误; 答案为C。 12.关于0.1mol/LNa2CO3 溶液,下列判断不正确的是 A. 粒子种类与NaHCO3 溶液不同 B. 升高温度,c( )减小 C. 加入Ca(OH)2溶液,c( )减小 D. c(H+ )+c(Na+ )=2c()+c()+c(OH- ) 【答案】A 【解析】 【详解】A. Na2CO3溶液中分步水解,+ H2O + OH-,+ H2OH2CO3+OH-,以第一步水解为主,NaHCO3溶液中,存在水解和电离,+ H2OH2CO3+OH-,=+H+,以水解为主,所以Na2CO3中粒子种类与NaHCO3溶液相同,均为7种,故A错误; B.水解吸热,所以升高温度,水解程度增大,c()减小,故B正确; C.加入Ca(OH)2溶液,会转化为CaCO3沉淀,c()减小,故C正确; D. Na2CO3溶液中存在电荷守恒:c(H+ )+c(Na+ )=2c()+c()+c(OH- ),故D正确; 故选A。 13.下列有关事实,与水解反应无关的是 A. 实验室保存FeCl2溶液时常加入Fe粉 B. 碳酸钠溶液中, c(H+) < c(OH-) C. 加热蒸干氯化铁溶液,不能得到氯化铁晶体 D. 用 TiCl4 和大量水反应,同时加热制备 TiO2 【答案】A 【解析】 【分析】 碳酸钠为强碱弱酸盐、氯化铁、TiCl4为强酸弱碱盐,对应的水溶液都能水解。 【详解】A.实验室保存FeCl2溶液时常加入Fe粉,是为了防止亚铁离子氧化成铁离子,故A选; B.碳酸钠溶液中,碳酸根离子水解消耗氢离子,促进水电离,氢氧根离子浓度增大,c(H+) < c(OH-),故B不选; C.加热蒸干氯化铁溶液,铁离子水解,生成氢氧化铁和盐酸,加热后盐酸挥发,促进水解正向进行,不能得到氯化铁晶体,故C不选; D.用 TiCl4和大量水发生水解反应,TiCl4和大量的水在加热条件下反应发生水解生成Ti(OH)4,Ti(OH)4分解生成TiO2,与盐类水解有关;加热分解生成TiO2,故D不选; 故选A。 14.为了除去 MgCl2 酸性溶性中的 Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸,这种试剂是 A. NH3·H2O B. MgO C. Na2CO3 D. NaOH 【答案】B 【解析】 【详解】A.加入一水合氨会引入新的杂质氯化铵,故A错误; B.溶液显酸性,加入MgO,MgO与氢离子反应,可起到调节溶液pH的作用,促进铁离子的水解生成氢氧化铁沉淀而除去,且不引入新的杂质,故B正确; C.加入Na2CO3,引入新的杂质NaCl,故C错误; D.加入NaOH易生成氢氧化镁沉淀,且新的杂质NaCl,故D错误; 故答案为B。 15.有①NaOH 溶液 ②Na2CO3 溶液 ③CH3COONa 溶液各 10mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是 A. 三种溶液 pH 的大小顺序是①>③>② B. 三种溶液中由水电离出的 OH-浓度大小顺序是②>③>① C. 若将三种溶液稀释相同倍数,pH 变化最大的是③ D. 若分别加入 10mL0.1mol·L-1 盐酸后,pH 最大的是① 【答案】B 【解析】 【详解】A.氢氧化钠为碱,碳酸钠、醋酸钠都是强碱弱酸盐,碳酸钠水解程度大于醋酸钠,所以三种溶液pH的大小顺序是①>②>③,故A错误; B.氢氧化钠为碱抑制水电离,碳酸钠、醋酸钠都是强碱弱酸盐,促进水电离,碳酸钠水解程度大于醋酸钠,对水电离促进程度大,三种溶液中由水电离出的 OH-浓度大小顺序是②>③>①,故B正确; C.稀释时强碱的变化程度大,所以三种溶液稀释相同倍数,pH变化最大的是①,故C错误; D.等体积等浓度混合后,①中溶质为NaCl,溶液呈中性,②中溶质为NaHCO3、NaCl,碳酸氢钠水解显碱性,③中溶质为NaCl、CH3COOH,溶液呈酸性,pH最大的是②,故D错误; 故选B。 16.下列关于金属腐蚀与防护的说法不正确的是 A. 图①,放置于干燥空气中的铁钉不易生锈 B. 图②,若断开电源,钢闸门将发生析氢腐蚀 C. 图②,若将钢闸门与电源的负极相连,可防止钢闸门腐蚀 D. 图③,若金属M 比 Fe 活泼,可防止输水管腐蚀 【答案】B 【解析】 【详解】A. 图①,放置于干燥空气中的铁钉不易生锈,放在潮湿的空气中易生锈,故A正确; B. 图②,若断开电源,电解质是中性或弱碱性环境,钢闸门将发生吸氧腐蚀,故B错误; C. 图②,若将钢闸门与电源的负极相连,可防止钢闸门腐蚀,防腐方法为外加电流的阴极保护法,故C正确; D. 图③,若金属M比Fe活泼,可防止输水管腐蚀,让M作负极,Fe作正极,叫牺牲阳极的阴极保护法,故D正确。 综上所述,答案为B。 17.某温度下,在容积为1L的密闭容器中充入1molCO2和3.25molH2,发生CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H<0,测得CH3OH的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数K=2.25)下列说法正确的是 A. 0-10min,v(H2)=0.075 mol/(L·min) B. 点 b 所对应的状态没有达到化学平衡状态 C. CH3OH 的生成速率,点 a 大于点 b D. 欲增大平衡状态时,可保持其他条件不变,升高温度 【答案】C 【解析】 【详解】A.0~10min,v(CH3OH)= =0.075 mol•L-1•min-1,v(H2)=3v(CH3OH)=3×0.075 mol•L-1•min-1=0.225mol•L-1•min-1,故A错误; B.b点时,n(CH3OH)=0.75mol,c(CH3OH)= =0.75mol/L,则b点浓度商Qc===2.25,则Qc=K=2.25,b点达到平衡状态,故B错误; C.可逆反应在没有达到平衡状态前,随着反应的进行,正反应速率逐渐减小,所以a点甲醇的生成速率大于b点,故C正确; D.该反应的正反应是放热反应,升高温度平衡逆向移动,则甲醇浓度减小,二氧化碳浓度增大,所以减小,故D错误; 答案为C。 18.用石墨电极电解饱和食盐水的原理示意图如图所示。下列说法正确的是 A. M 为负极 B. 通电使氯化钠发生电离 C. 电解一段时间后,阴极区 pH 升高 D. c 出口收集到的物质是氢气 【答案】C 【解析】 【分析】 左边最后得到稀氯化钠溶液,右边最后得到浓氢氧化钠溶液,说明左边电极上氯离子变成氯气,钠离子移动到了右边,出口c收集到的物质是氯气,M为正极,左边溶液中发生的是氧化反应,右边电极上水电离的氢离子放电生成氢气,出口d收集到氢气,N为负极。 【详解】A.由以上分析可知M为正极,故A错误; B.氯化钠在水分子的作用下发生电离,无需通电,故B错误; C.阴极生成NaOH,电解一段时间后,阴极区 pH增大,故C正确; D.左室为阳极室,发生氧化反应,出口c收集到的物质是氯气,故D错误; 故选: C。 19.取1 mL 0.1 mol·L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1): 下列说法不正确的是 A. 实验①白色沉淀是难溶的AgCl B. 若按②①顺序实验,能看到白色沉淀 C. 若按①③顺序实验,能看到黑色沉淀 D. 由实验②说明 AgI 比 AgCl 更难溶 【答案】B 【解析】 【分析】 取1mL0.1 mol·L-1AgNO3溶液中加入过量氯化钠溶液生成氯化银白色沉淀,滴加过量KI溶液生成黄色沉淀碘化银,再加入过量硫化钠溶液生成硫化银沉淀,沉淀转化的实质是向更难溶的方向进行。 【详解】A.分析可知,实验①白色沉淀是难溶的AgCl,故A正确; B.由实验②说明AgI比AgCl更难溶,若按②①顺序实验,此条件下碘化银不能转化为氯化银,看不到白色沉淀,故B不正确; C.若按①③顺序实验,硫化银溶解度小于氯化银,也可以实现转化看到黑色沉淀生成,故C正确; D由实验②说明AgI比AgCl更难溶,可以实现沉淀转化,故D正确; 故选: C。 20.常温时,用滴定某一元酸HX,滴定过程中pH变化曲线如图所示。 下列说法正确的是 A. HX溶液显酸性的原因是 B. 点a, C. 点b,与恰好完全反应 D. 点c, 【答案】D 【解析】 【分析】 根据滴定曲线(特殊点)的含义,分析电解质强弱、电离与水解的主次关系,并运用物料守恒关系解答。 【详解】A项:滴入溶液前,0.10mol/LHX溶液pH接近4,则HX为弱酸,电离方程式为HXH++X-,A项错误; B项:点a溶液中生成1.5mmolNaX、剩余1.0mmolHX。因溶液呈酸性,HX电离程度大于X-的水解程度,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),B项错误; C项:当与恰好完全反应时生成NaX,因X的水解,溶液pH应大于7。点b的pH=7,必有HX剩余,C项错误; D项:据物料守恒,曲线上任何一点都有n(X-)+n(HX)=25mL×0.10mol·L-1,点c溶液总体积约50mL,则,D项正确。 本题选D。 第二部分(非选择题) 21.(1)已知键能如下:H-H为akJ/mol N≡N为bkJ/mol N-H为ckJ/mol,则N2(g)+3H2(g)2NH3(g) △H=__________; (2)石墨吸热生成金刚石,则二者中相对稳定的物质为_________________; (3)明矾净水的离子方程式为:__________________________; (4)催化剂可以加快化学反应速率的原因___________________,此外催化剂和升温都能提高活化分子的百分数,催化剂不能影响平衡的移动。 (5)常温时,pH=9的氨水溶液中,由水电离出的c(OH-)为_______________________。 【答案】 (1). (3a+b-6c)kJ•mol-1 (2). 石墨 (3). Al3++3H2O=Al(OH)3(胶体)+3H+ (4). 降低反应的活化能,增大活化分子百分数,增大单位体积内的活化分子数目,有效碰撞增多,反应速率加快 (5). 10-9mol/L 【解析】 【详解】(1)已知:H-H键能为akJ•mol-1,N≡N键的键能bkJ•mol-1,H-N键能为ckJ•mol-1,对于反应N2(g)+3H2(g)=2NH3(g)的反应热△H=反应物的总键能-生成物的总键能=bkJ•mol-1+akJ•mol-1×3-ckJ•mol-1×6=(3a+b-6c)kJ•mol-1;答案为(3a+b-6c)kJ•mol-1。 (2)因为石墨吸热生成金刚石,石墨比金刚石能量低,能量越低越稳定,所以稳定性石墨>金刚石,则二者中相对稳定的物质为石墨;答案为石墨。 (3)明矾为KAl(SO4)2·12H2O,溶解后溶液中铝离子水解生成氢氧化铝胶体,具有吸附悬浮杂质的作用,起到净水目的,反应的离子方程式为:Al3++3H2O=Al(OH)3(胶体)+3H+;答案为Al3++3H2O=Al(OH)3(胶体)+3H+。 (4)加入催化剂,降低反应的活化能,增大活化分子百分数,增大单位体积内的活化分子数目,有效碰撞增多,反应速率加快;答案为降低反应的活化能,增大活化分子百分数,增大单位体积内的活化分子数目,有效碰撞增多,反应速率加快。 (5)氨水电离出的氢氧根离子抑制了水的电离,则氨水中的氢离子是水电离的,pH=9的氨水溶液中,氢离子浓度为10-9mol/L,水电离的氢离子和氢氧根离子浓度相等,则水电离的c(OH-)为10-9mol/L;答案为10-9mol/L。 22.氯气是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:4HCl(g)+O2(g)2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示: 过程 I 的反应为, 2HCl(g)+CuO(s) CuCl2(s)+H2O(g)△H= -132kJ/mol (1)该原理中起到催化剂作用物质的化学式为_______________________; (2)过程 II 反应的热化学方程式为____________________; (3)压强为p1时,地康法中HCl 平衡转化率(aHCl ) 随温度变化曲线如图。 ①比较 a、b 两点的平衡常数大小 K(a)=_______________K(b)(填“>”“<”或“=”),解释原因为________________; ②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2_________________p1(填“>”“<”或“=”)。 【答案】 (1). CuO (2). 2CuCl2(s)+ O2(g) = 2CuO(s) + 2C12(g)△H= +144kJ/mol (3). > (4). 升高温度HCl转化率降低,则平衡逆向移动,平衡常数减小 (5). < 【解析】 【分析】 (1).根据反应前后CuO不变化可知CuO为催化剂; (2).根据盖斯定律解答; (3).根据影响平衡移动解答,升高温度HCl的转化率降低,则平衡逆向移动,平衡常数减小。 【详解】(1)根据图知,反应I中CuO是反应物、反应II中CuO是生成物,所以CuO为催化剂,故答案为: CuO; (2) ①4HCl(g)+O2(g)2Cl2(g)+2H2O(g)△H= -120kJ/mol ②2HCl(g)+CuO(s) CuCl2(s)+H2O(g)△H= -132kJ/mol 反应II的方程式为2CuCl2(s)+ O2(g) = 2CuO(s) + 2C12(g),方程式II可由①- 2×②得到,△H= - 120kJ/mol- 2×(-132kJ/mol)= + 144kJ/ mol,故答案为:2CuCl(s)+ O2(g) = 2CuO(s) + 2C12(g)△H= +144kJ/mol; (3)①升高温度HCl的转化率降低,则平衡逆向移动,平衡常数减小,压强相同时温度a< b,则K(a)> K(b),故答案为: > ;升高温度HCl的转化率降低,则平衡逆向移动,平衡常数减小; ②c点表示投料不变,350℃、压强为p2时,该反应前后气体计量数之和减小,增大压强HCl的转化率增大,相同温度时转化率c点低,则c点压强较小,所以p2查看更多
相关文章
- 当前文档收益归属上传用户