- 2021-07-05 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习盖斯定律在比较、计算及热化学方程式书写中的应用学案
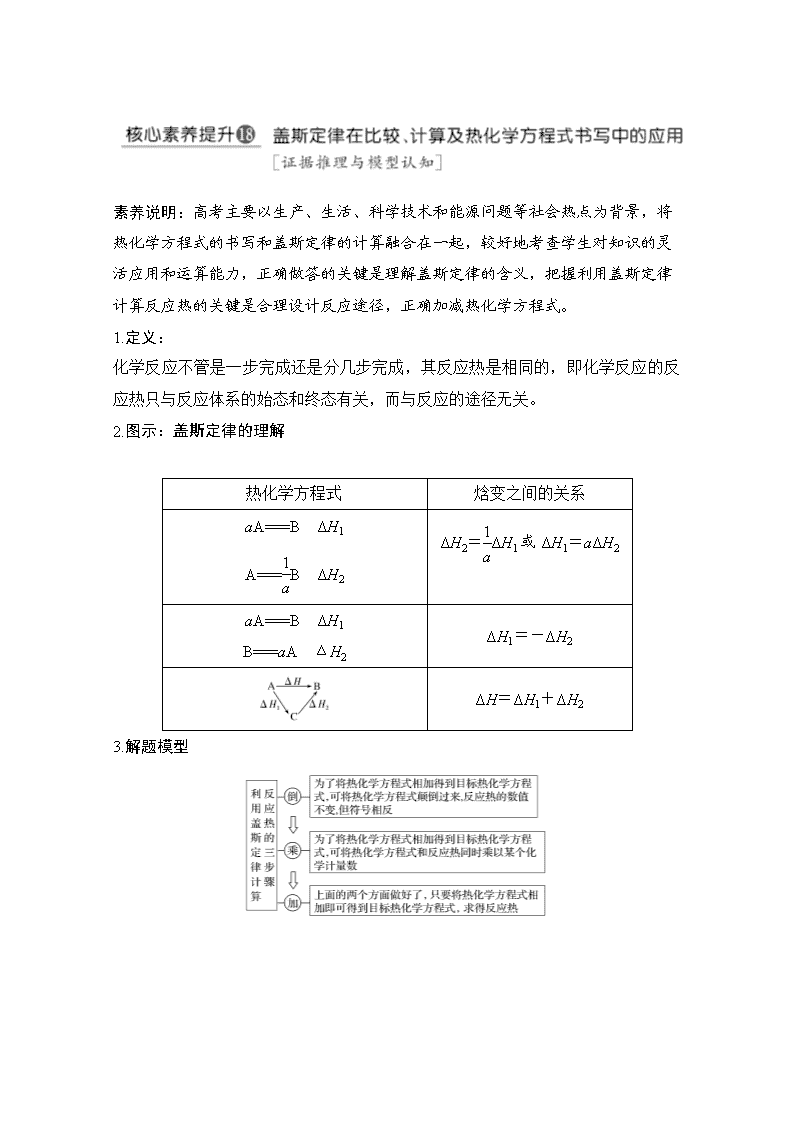
素养说明:高考主要以生产、生活、科学技术和能源问题等社会热点为背景,将热化学方程式的书写和盖斯定律的计算融合在一起,较好地考查学生对知识的灵活应用和运算能力,正确做答的关键是理解盖斯定律的含义,把握利用盖斯定律计算反应热的关键是合理设计反应途径,正确加减热化学方程式。 1.定义: 化学反应不管是一步完成还是分几步完成,其反应热是相同的,即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。 2.图示:盖斯定律的理解 热化学方程式 焓变之间的关系 aA===B ΔH1 A===B ΔH2 ΔH2=ΔH1或ΔH1=aΔH2 aA===B ΔH1 B===aA ΔH2 ΔH1=-ΔH2 ΔH=ΔH1+ΔH2 3.解题模型 [题型专练] 1.(2014·课标全国Ⅱ,13)室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( ) A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3 解析 1 mol CuSO4·5H2O(s)溶于水会使溶液温度降低,为吸热反应,故ΔH1>0,1 mol CuSO4(s)溶于水会使溶液温度升高,为放热过程,故ΔH2<0;1 mol CuSO4·5H2O(s)溶于水可以分为两个过程,先分解成1 mol CuSO4(s)和5 mol水,然后1 mol CuSO4(s)再溶于水。CuSO4·5H2O的分解为吸热反应,即ΔH3>0,根据盖斯定律得到关系式ΔH1=ΔH2+ΔH3,分析得到答案ΔH1<ΔH3。 答案 B 2.[2017·课标全国Ⅲ,28(3)]已知:As(s)+H2(g)+2O2(g)===H3AsO4(s) ΔH1 H2(g)+O2(g)===H2O(l) ΔH2 2As(s)+O2(g)===As2O5(s) ΔH3 则反应As2O5(s)+3H2O(l)===2H3AsO4(s)的ΔH= 。 解析 由盖斯定律可知①×2-②×3-③可得所求反应,故ΔH=2ΔH1-3ΔH2-ΔH3。 答案 2ΔH1-3ΔH2-ΔH3 【反思归纳】 确定反应热关系的三大注意点 (1)反应物和生成物的状态: 物质的气、液、固三态的变化与反应热的关系。 (2)ΔH的符号:比较反应热的大小时,不要只比较ΔH数值的大小,还要考虑其符号。 (3)参加反应物质的量:当反应物和生成物的状态相同时,参加反应物质的量越多,放热反应的ΔH越小,吸热反应的ΔH越大。 3.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是______________________________________________________________________ _____________________________________________________________________。 答案 4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1 4.[2017·江苏化学,26(1)]TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。 已知:TiO2(s)+2Cl2(g)=== TiCl4(g)+O2(g) ΔH1=+175.4 kJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH2=-220.9 kJ·mol-1 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_____________________________________________________________________。 答案 TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH=-45.5 kJ/mol 5.[2018·课标全国Ⅰ,28(2)①]F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应: 其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示(t=∞时,N2O5(g)完全分解): t/min 0 40 80 160 260 1 300 1 700 ∞ p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1 ①已知:2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1 2NO2(g)===N2O4(g) ΔH2=-55.3 kJ·mol-1 则反应N2O5(g)===2NO2(g)+O2(g)的ΔH= kJ·mol-1。 解析 将已知热化学方程式依次编号为a、b,根据盖斯定律,由×a-b得N2O5(g)===2NO2(g)+O2(g) ΔH==kJ·mol-1=53.1 kJ·mol-1。 答案 53.1 6.[2018·课标全国Ⅱ,27(1)]CH4CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题: CH4CO2催化重整反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g)。 已知:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·mol-1 C(s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1 C(s)+O2(g)===CO(g) ΔH=-111 kJ·mol-1 该催化重整反应的ΔH= kJ·mol-1。 解析 将已知中3个反应依次记为①、②、③,根据盖斯定律③×2-①-②得该催化重整反应的ΔH=(-111×2+75+394) kJ·mol-1=+247 kJ·mol-1。 答案 247查看更多