- 2021-07-05 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第四章 非金属及其化合物 第1节 无机非金属材料的主角——硅学案 新人教版
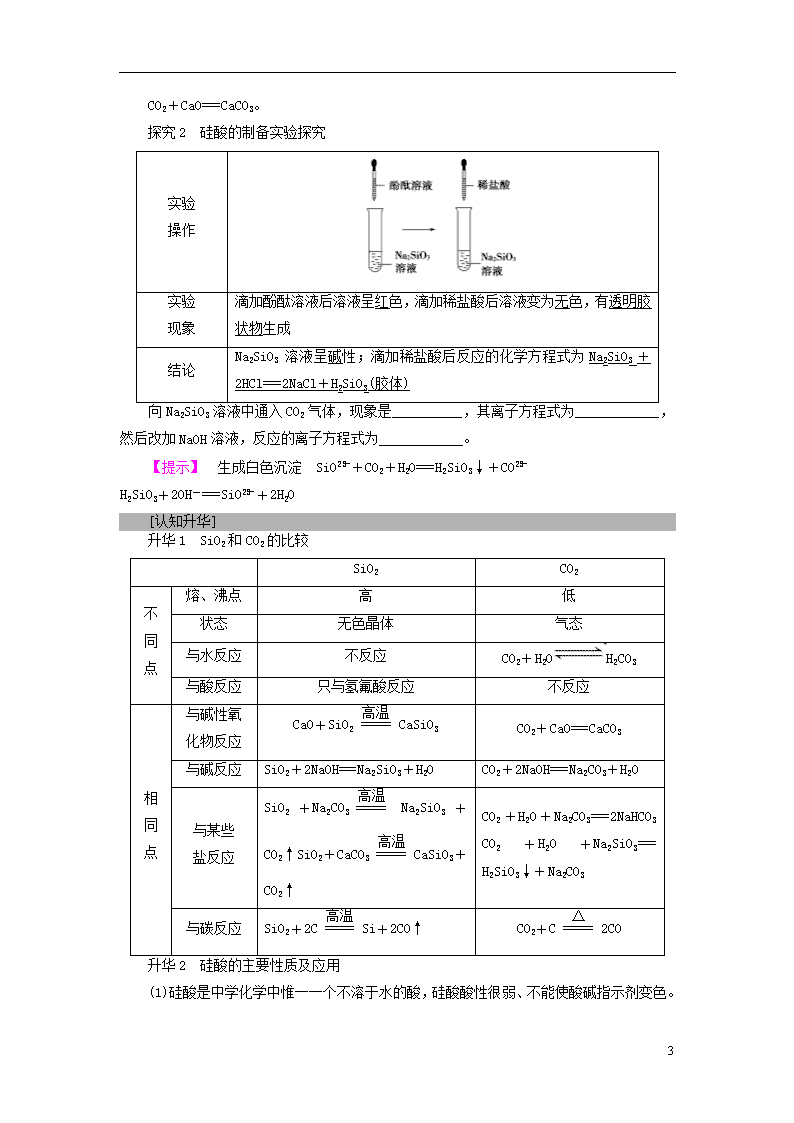
第一节 无机非金属材料的主角——硅 1.了解SiO2的结构、性质和用途。(重点) 2.了解硅酸的制备和化学性质。 3.了解硅酸盐的性质及组成的表示方法。 4.了解硅的性质和用途。(重点) 5.了解几种重要无机非金属材料的生产及用途。 二氧化硅和硅酸 [基础·初探] 教材整理1 二氧化硅 1.硅元素的存在 2.二氧化硅(SiO2) (1)存在 SiO2的存在形式有结晶形和无定形两大类,水晶、玛瑙的主要成分是结晶的二氧化硅。 (2)结构 SiO2晶体是由Si和O按原子数之比为1∶2的比例组成的立体网状结构的晶体。每个硅原子周围结合4个O原子,每个O周围结合2个Si原子。 (3)物理性质 熔点高;硬度大;溶解性:不溶于水。 (4)化学性质(写出有关化学方程式) (5)用途 ①沙子是基本的建筑材料。 ②纯净的SiO2是现代光学及光纤制品的基本原料,可以制作光导纤维。 9 ③石英和玛瑙制作饰物和工艺品。 ④实验室中使用石英坩埚。 教材整理2 硅酸(H2SiO3) 1.物理性质 硅酸是一种难溶于水的白色胶状物。 2.化学性质 (1)弱酸性 向Na2SiO3溶液中通入CO2,生成白色沉淀,反应的化学方程式为Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。 结论:H2SiO3酸性比H2CO3酸性弱。 (2)不稳定性 H2SiO3不稳定,受热易分解,反应的化学方程式为H2SiO3H2O+SiO2。 3.制备 Na2SiO3溶液中加入盐酸,反应的化学方程式为Na2SiO3+2HCl===2NaCl+H2SiO3(胶体)。 4.存在及用途 (1)浓度小且边加边振荡时,形成硅酸溶胶(胶体);浓度大时,形成硅酸凝胶。 (2)硅胶 硅酸凝胶经干燥脱水得到的硅酸干凝胶,称为“硅胶”,具有很强的吸水性,常用作干燥剂或催化剂的载体。 [探究·升华] [思考探究] 探究1 SiO2的主要性质及应用 (1)为什么实验室盛放NaOH溶液的试剂瓶要用橡胶塞而不能用玻璃塞?(玻璃的成分中含有SiO2) 【提示】 当玻璃瓶配玻璃塞时,瓶口内壁和瓶塞外壁都进行了磨砂处理。玻璃中含SiO2,磨砂玻璃遇到强碱如NaOH溶液时,SiO2与NaOH反应生成Na2SiO3,使试剂瓶受腐蚀。Na2SiO3溶液有良好的黏结性,它易使瓶口与瓶塞黏在一起而难以开启。故使用橡胶塞而不能使用玻璃塞。 (2)实验室能否用玻璃瓶保存氢氟酸?为什么?写出反应方程式。 【提示】 不能。因为氢氟酸腐蚀玻璃,和玻璃中的成分SiO2反应。 SiO2+4HF===SiF4↑+2H2O。 (3)写出SiO2、CO2与CaO反应的化学方程式。 【提示】 SiO2+CaOCaSiO3、 9 CO2+CaO===CaCO3。 探究2 硅酸的制备实验探究 实验 操作 实验 现象 滴加酚酞溶液后溶液呈红色,滴加稀盐酸后溶液变为无色,有透明胶状物生成 结论 Na2SiO3溶液呈碱性;滴加稀盐酸后反应的化学方程式为Na2SiO3+2HCl===2NaCl+H2SiO3(胶体) 向Na2SiO3溶液中通入CO2气体,现象是__________,其离子方程式为____________,然后改加NaOH溶液,反应的离子方程式为____________。 【提示】 生成白色沉淀 SiO+CO2+H2O===H2SiO3↓+CO H2SiO3+2OH-===SiO+2H2O [认知升华] 升华1 SiO2和CO2的比较 SiO2 CO2 不 同 点 熔、沸点 高 低 状态 无色晶体 气态 与水反应 不反应 CO2+H2OH2CO3 与酸反应 只与氢氟酸反应 不反应 相 同 点 与碱性氧 化物反应 CaO+SiO2CaSiO3 CO2+CaO===CaCO3 与碱反应 SiO2+2NaOH===Na2SiO3+H2O CO2+2NaOH===Na2CO3+H2O 与某些 盐反应 SiO2+Na2CO3 Na2SiO3+CO2↑SiO2+CaCO3CaSiO3+CO2↑ CO2+H2O+Na2CO3===2NaHCO3 CO2+H2O+Na2SiO3=== H2SiO3↓+Na2CO3 与碳反应 SiO2+2CSi+2CO↑ CO2+C2CO 升华2 硅酸的主要性质及应用 (1)硅酸是中学化学中惟一一个不溶于水的酸,硅酸酸性很弱、不能使酸碱指示剂变色。 9 (2)实验室制取硅酸的方法是可溶性硅酸盐与酸反应。 (3)硅酸的性质:①具有酸性,酸性比碳酸弱;②受热易分解。 (4)硅酸浓度小时可形成硅酸溶胶,浓度大时可形成硅酸凝胶。硅酸凝胶经干燥脱水得到硅胶(或硅酸干凝胶),具有较强的吸水性,常用作干燥剂及催化剂载体。 [题组·冲关] 题组1 SiO2的性质与应用 1.关于二氧化硅,下列叙述不正确的是( ) A.水晶的主要成分是二氧化硅 B.二氧化硅和二氧化碳在物理性质上有很大差别 C.二氧化硅不溶于水,也不能跟水起反应生成酸 D.二氧化硅是一种酸性氧化物,它不跟任何酸起反应 【解析】 水晶的主要成分为SiO2,A项正确;CO2是由分子构成的,而SiO2是Si和O按1∶2组成的空间立体网状结构的晶体,二者物理性质差别较大,B项正确;SiO2不溶于水也不与水反应,C项正确;SiO2可以与氢氟酸反应,D项错误。 【答案】 D 2.下列说法不正确的是( ) A.因SiO2不溶于水,故SiO2不是酸性氧化物 B.在反应SiO2+2CSi+2CO↑中SiO2作氧化剂 C.SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 D.氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸 【解析】 A项,SiO2不溶于水,但它能与碱反应生成硅酸盐和水,是酸性氧化物,错误;B项,在该反应中SiO2被C还原为Si,SiO2作氧化剂,正确;C项,由于SiO2是一种空间立体网状结构的物质,故熔点高,硬度大,正确;D项,SiO2能与氢氟酸反应,故常用氢氟酸刻蚀玻璃,不能用玻璃瓶盛装氢氟酸,正确。 【答案】 A 题组2 H2SiO3的性质、制备与应用 3.下列关于硅酸的说法正确的是( ) A.硅酸可以通过SiO2和水的化合反应直接制得 B.用反应Na2SiO3+2HCl===2NaCl+H2SiO3↓制取硅酸是利用了可溶性酸制难溶性酸的性质 C.因为硅酸难溶于水,所以它不能与NaOH溶液反应 D.硅胶可用作袋装食品的干燥剂 【解析】 SiO2不能与水反应生成硅酸,A错误;B中反应是利用了强酸制弱酸的性质,B错误;硅酸虽难溶于水,但可与强碱溶液反应生成硅酸盐,C错误。 9 【答案】 D 4.碳酸的酸性比硅酸强,某化学课外小组搜集了大量的证据证明硅酸的酸性弱于碳酸酸性。其中能证明硅酸的酸性弱于碳酸酸性的实验事实是( ) A.CO2溶于水形成碳酸,SiO2难溶于水 B.CO2通入可溶性硅酸盐中析出硅酸沉淀 C.高温下SiO2与碳酸钙、碳酸钠等固体反应生成CO2 D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀 【解析】 根据强酸制弱酸的原理,CO2通入可溶性硅酸盐中析出硅酸沉淀,此项实验事实可证明碳酸的酸性比硅酸强。 【答案】 B 5.为了进一步确认HCl、H2CO3、H2SiO3的酸性强弱,有人设计用下图所示装置进行一次实验即可达到目的(不必再选用其他酸性溶液)。 请回答: (1)A中的化学反应方程式可能为__________________________________。 (2)B装置的作用是_____________________________________________。 (3)C中的现象有_____________,反应离子方程式为__________________。 (4)根据实验,三种酸的强弱顺序为_____________,其依据为__________ ______________________________________________________________。 【答案】 (1)CaCO3+2HCl===CaCl2+CO2↑+H2O (2)除去CO2中的HCl,防止HCl与Na2SiO3反应 (3)产生白色胶状沉淀 CO2+H2O+SiO===H2SiO3(胶体)+CO (4)HCl>H2CO3>H2SiO3 强酸制弱酸 硅酸盐和硅单质 [基础·初探] 教材整理1 硅酸盐 1.硅酸盐的组成与表示 (1)定义:由硅、氧和金属组成的化合物的总称。 (2)性质:结构复杂,大多不溶于水,化学性质稳定。 (3)表示:通常以二氧化硅和金属氧化物的组合形式表示其组成。例如, ①Na2SiO3:Na2O·SiO2。 9 ②长石(KAlSi3O8):K2O·Al2O3·6SiO2。 ③镁橄榄石(Mg2SiO4):2MgO·SiO2。 【特别提醒】 以氧化物形式表示硅酸盐组成的方法 (1)方法:找出组成元素;写出氧化物的形式;注意原子守恒;检查有无遗漏。 (2)氧化物的顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。 (3)氧化物前化学计量数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置化学计量数,如果出现分数,扩大倍数化为整数。 (4)氧化物之间用“·”隔开。 2.最简单的硅酸盐——Na2SiO3 3.三种常见的硅酸盐产品——无机非金属材料 产品 原料 主要设备 主要成分 水泥 石灰石、黏土 水泥 回转窑 硅酸二钙2CaO·SiO2 硅酸三钙3CaO·SiO2 铝酸三钙3CaO·Al2O3 玻璃 纯碱、石灰 石和石英砂 玻璃窑 Na2O·CaO·6SiO2 陶瓷 黏土 — — 4.其他含硅物质 (1)SiC:俗称金刚砂,类似金刚石的结构和性能。 (2)含4%硅的硅钢具有导磁性,用作变压器铁芯。 (3)硅橡胶:耐高温又耐低温。 (4)人造分子筛:作吸附剂和催化剂。 教材整理2 硅单质 1.种类及结构 单质硅分为晶体和无定形两种,晶体硅的结构与金刚石类似。 2.性质 (1)物理性质 色、态 光泽 熔点 硬度 质地 导电性 灰黑色固体光泽 金属 高 大 脆 半导体 9 (2)化学性质 在常温下化学性质不活泼,但能与氟气、HF、 NaOH溶液发生反应。 3.用途 (1)半导体材料,如硅芯片等。 (2)新型能源,如光电池等。 【特别提醒】 硅单质性质的特殊性 (1)一般情况下,非金属元素单质熔、沸点低,硬度小,但晶体硅和金刚石熔、沸点高,硬度大,其中金刚石为自然界中硬度最大的物质。 (2)一般情况下,非金属单质为绝缘体,但硅为半导体,石墨为电的良导体。 (3)Si的还原性大于C,但单质C在高温下能从SiO2中还原出Si:SiO2+2CSi+2CO↑。 (4)非金属单质与碱反应一般既作氧化剂又作还原剂,且无氢气放出,但硅与碱溶液反应只作还原剂,且反应能放出氢气:Si+2NaOH+H2O===Na2SiO3+2H2↑。 (5)非金属单质一般不与非氧化性酸反应,但硅能与氢氟酸反应:Si+4HF===SiF4↑+2H2↑。 [题组·冲关] 题组1 硅酸盐的组成、性质和应用 1.下列关于硅酸盐的说法中正确的是( ) A.硅酸盐都难溶于水 B.Na2SiO3是一种最简单的硅酸盐,其水溶液可用作黏合剂 C.硅酸盐通常可用氧化物的形式表示,说明硅酸盐就是由各种氧化物组成的 D.硅酸盐工业使用的每一种原料都含有硅 【解析】 A项,Na2SiO3可溶于水,错误;C项,硅酸盐可用氧化物的形式表示,但不是由各种氧化物组成,错误;D项,所用原料可能不含硅,错误。 【答案】 B 2.用氧化物的形式表示硅酸盐的组成,其中正确的是( ) A.钙沸石[Ca(Al2Si3O10)·3H2O],表示为Al2O3·CaO·3SiO2·3H2O B.镁橄榄石(Mg2SiO4),表示为MgO·SiO2 C.钾云母(K2Al6Si6H4O24),表示为K2O·2H2O·3Al2O3·6SiO2 D.高岭石[Al2(Si2O5)(OH)4],表示为Al2O3·2SiO2·2H2O 【解析】 A项,Ca(Al2Si3O10)·3H2O应表示为CaO·Al2O3·3SiO2·3H2O(排序错);B项,Mg2SiO4应表示为2MgO·SiO2(不能在系数中出现分数);C项,K2Al6Si6H4O24应表示为K2O·3Al2O3·6SiO2·2H2O(排序错)。 9 【答案】 D 3.下列关于水玻璃的性质和用途的叙述中正确的是( ) A.它是一种纯净物,既不燃烧也不易腐蚀 B.水玻璃是生产玻璃的主要原料之一 C.木材、织物浸过水玻璃后具有防腐性能且不易燃烧 D.水玻璃的化学性质稳定,在空气中不易变质 【解析】 水玻璃是硅酸钠的水溶液,A错误;水玻璃易与空气中的二氧化碳反应,D错误。 【答案】 C 题组2 硅单质及其化合物的性质及综合应用 4.硅及其化合物的应用范围很广。下列说法正确的是( ) A.硅是人类将太阳能转换为电能的常用材料 B.粗硅制备单晶硅不涉及氧化还原反应 C.反应:Si+2NaOH+H2O===Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂 D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 【解析】 C项只有H2O是氧化剂;D项盐酸与Si不反应,氢氟酸才可。 【答案】 A 5.下图中的每一方格表示相关的一种反应物或生成物。其中,B是一种单质,其余物质也都是含B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去)。请填写空白: (1)A、D、E的化学式分别为________、________、________。 (2)A和B的相互转化在工业上有什么实际意义? __________________________________________________________。 (3)写出D→C反应的化学方程式:___________________________________ ______________________________________________________________。 (4)写出E→D反应的化学方程式:_______________________________ ___________________________________________________________。 【解析】 本题的突破口是:“B是一种单质”,“B的结构类似金刚石”。据此,容易推断出B是晶体硅。硅与氯气在加热条件下生成SiCl4,因此,A为SiCl4,SiCl4可以被氢气还原得纯净的硅。根据D为B的氧化物且能转化成B(Si),可知D为SiO2 9 ,由此可知其他答案。 【答案】 (1)SiCl4 SiO2 H2SiO3 (2)粗硅提纯 (3)SiO2+2NaOH===Na2SiO3+H2O (4)H2SiO3SiO2+H2O 【题后归纳】 Si的制备与提纯 SiO2粗SiSiCl4Si 9查看更多