- 2021-07-05 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届河北省武邑中学高二上学期周考(11
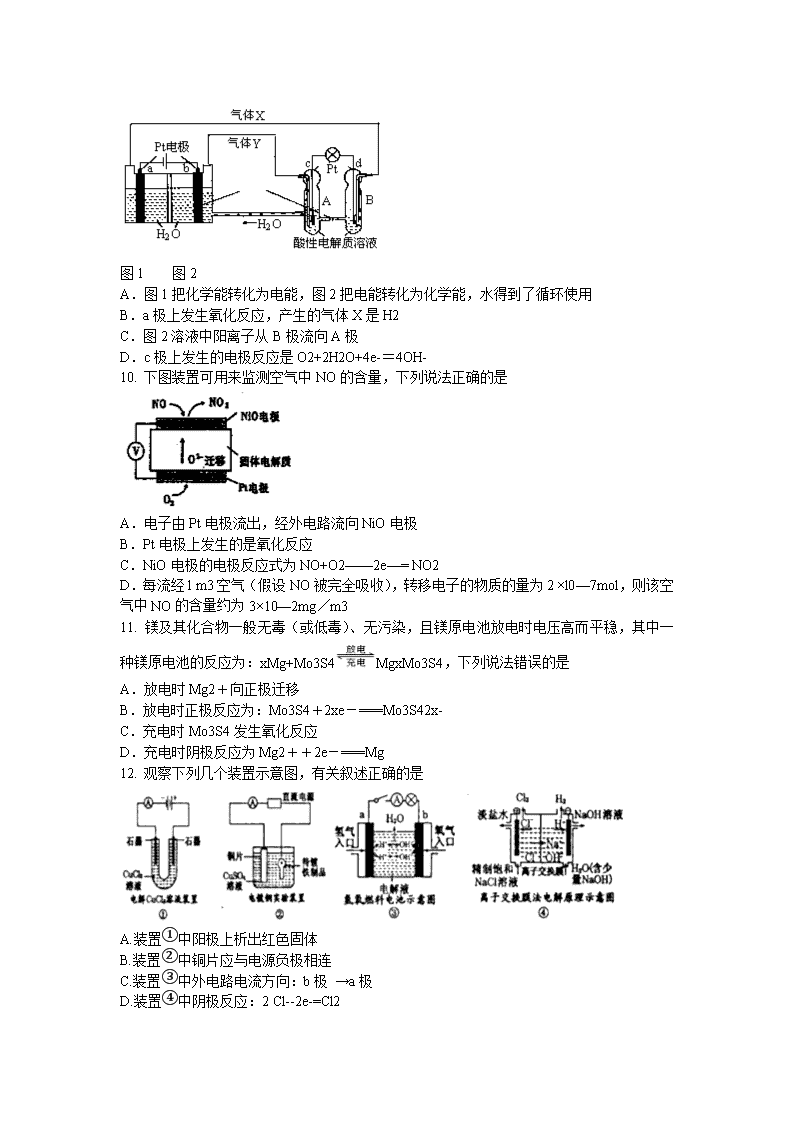
一.选择题 1. 下列有关说法不正确的是 A.实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则水电离的热化学方程式为:H2O(l)H+(aq)+OH-(aq) ΔH= +57.3 kJ·mol-1 D.生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e- =Fe2+ 2. 铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是 A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原 B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ C.电解后,c(Na2SO4)不变,且溶液中有晶体析出 D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O 3. 下列叙述正确的是 A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 B.下图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H+ +4e-=2H2O D.电镀时,通常把待镀的金属制品作阳极 4. 铁棒和石墨棒用导线连接后,浸入0.01mol/ L的氯化钠溶液中,下列说法正确的是 A.铁棒附近产生OH B.铁棒质量减少 C.石墨棒上放出氢气 D.石墨棒上放出氧气 5. 下图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误 的是 A.铁丝在两处的腐蚀速率:a < b B.a、b两处相同的电极反应式为Fe - 2e- = Fe2+ C.一段时间后,a处液面高于b处液面 D.生铁丝中的碳在a、b两处分别作原电池的负极和正极 6. 铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为: Pb(s) + PbO2(s) + 2H2SO4(aq) 2PbSO4(s) + 2H2O(l) 下列说法不正确的是 A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l) B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接 C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4 7. 一定条件下,碳钢腐蚀与溶液PH的关系如下: pH 2 4 6 6.5 8 13.5 14 腐蚀快慢 较快 慢 较快 主要产物 Fe2+ Fe3O4 Fe2O3 FeO2- 下列说法不正确的是 A.在pH<4溶液中,碳钢主要发生析氢腐蚀 B.在pH>6溶液中,碳钢主要发生吸氧腐蚀 C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e—=2H2O D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓 8. 有关下图电化学装置的叙述中,正确的是 A.若X为碳棒,Y为饱和食盐水,K置于N,则铁极上析出氯气 B.若X为铂棒,Y为CuCl2溶液,K置于N,则铁棒质量将增加 C.若X为锌棒,Y为海水,K置于M,形成对铁的外加电流阴极保护 D.若X为铜棒,Y为稀硫酸,K置于M,则正极反应为:Fe−2e→Fe2+ 9. 再生氢氧燃料电池(RFC)是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。图为RFC工作原理示意图,下列有关说法正确的是 图1 图2 A.图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用 B.a极上发生氧化反应,产生的气体X是H2 C.图2溶液中阳离子从B极流向A极 D.c极上发生的电极反应是O2+2H2O+4e-=4OH- 10. 下图装置可用来监测空气中NO的含量,下列说法正确的是 A.电子由Pt电极流出,经外电路流向NiO电极 B.Pt电极上发生的是氧化反应 C.NiO电极的电极反应式为NO+O2——2e—= NO2 D.每流经l m3空气(假设NO被完全吸收),转移电子的物质的量为2 ×l0—7mol,则该空气中NO的含量约为3×10—2mg/m3 11. 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,其中一种镁原电池的反应为:xMg+Mo3S4MgxMo3S4,下列说法错误的是 A.放电时Mg2+向正极迁移 B.放电时正极反应为:Mo3S4+2xe-===Mo3S42x- C.充电时Mo3S4发生氧化反应 D.充电时阴极反应为Mg2++2e-===Mg 12. 观察下列几个装置示意图,有关叙述正确的是 A.装置①中阳极上析出红色固体 B.装置②中铜片应与电源负极相连 C.装置③中外电路电流方向:b极 →a极 D.装置④中阴极反应:2 Cl--2e-=Cl2 二.实验题 13. 如图所示接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行) (1)U形管可观察到 ,写出有关反应的化学方程式 。 (2)在小烧杯a、b中分别有什么现象产生? 。 (3)如果小烧杯中有0.508g碘析出,问烧杯c中负极的质量减轻 g。 14. 电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连,请回答以下问题: (1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则: ①电解池中X电极上的电极反应为 。在X极附近观察到的现象是 。 ②Y电极上的电极反应为 ,,检验该电极反应产物的方法是 。 (2)如果要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则: ①X电极的材料是 ,电极反应式是 。 ②Y电极的材料是 ,电极反应式是 。(说明:杂质发生的电极反应不必写出) 15. 已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。 步骤一:电解精制: 电解时,粗铜应与电源的______极相连,阴极上的电极反应式为______。 电解过程中,硫酸铜的浓度会变 (选填:变大、不变、变小)。 步骤二:电解完成后,该小组同学按以下流程对电解液进行处理: (1)阳极泥的综合利用: 稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的化学方程式:______。残渣含有极少量的黄金,为了回收金,他们查阅了有关资料(见下表): 序号 反应 平衡常数 ① Au+6HNO3(浓)⇌Au(NO3)3+3NO2+3H2O ≤1 ② Au3++4Cl-⇌AuCl4- ≥1 从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因:______。 (2)滤液含量的测定:以下是该小组探究滤液的一个实验流程: 则100mL滤液中Cu2+ 的浓度为______mol•L-1,Fe2+的浓度为______mol•L-1。 三.计算题 16. 不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。 1至19号元素气态原子失去最外层的1个电子所需能量: (1)同主族内不同元素的E值变化的特点是__________。各主族中E值的这种变化特点体现了元素性质的__________变化规律。 (2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是__________(填写编号,多选倒扣)。 ①E(砷)>E(硒) ②E(砷)查看更多
相关文章
- 当前文档收益归属上传用户