- 2021-07-05 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学同步巩固练习解析:第4章 第4节第1课时(新人教版必修1)
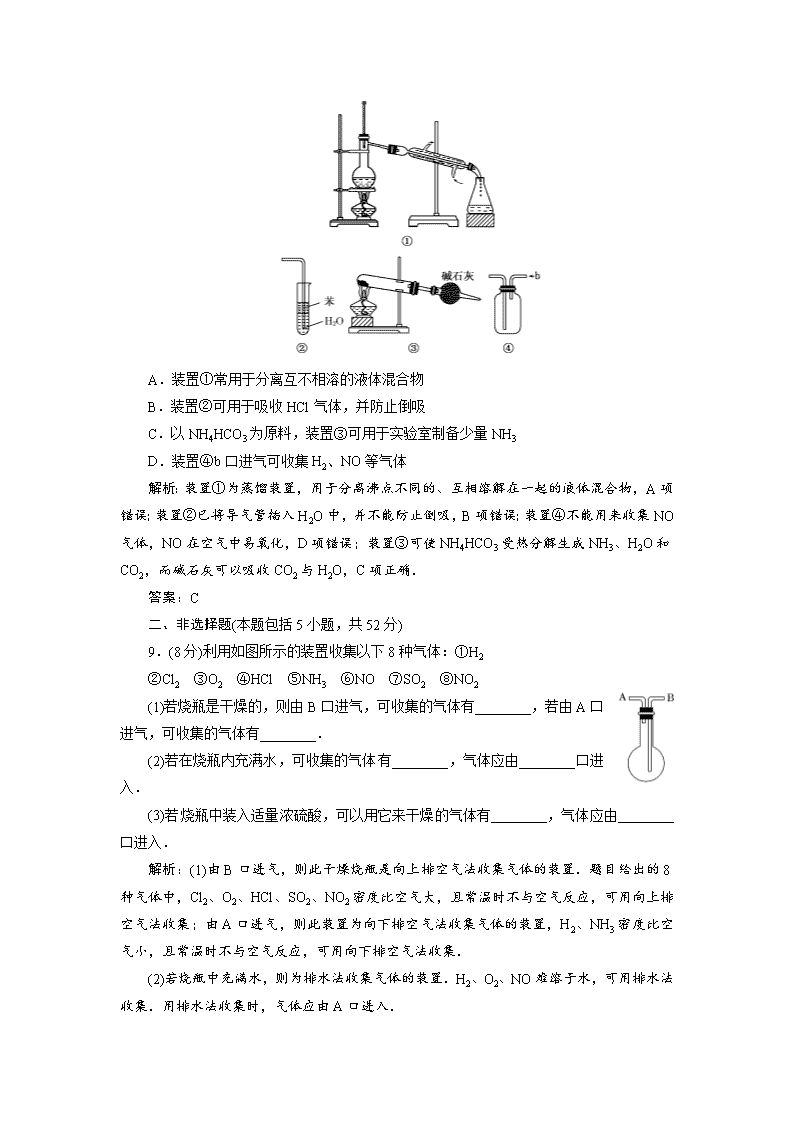
高一同步巩固练习试题解析(新人教版必修1) (时间45分钟,满分100分) 一、选择题(本题包括8小题,每小题6分,共48分) 1.下列说法中不正确的是( ) A.氨气极易溶于水,所以它是农业上常用的氮肥 B.工业上用H2和N2合成氨与自然界中放电时O2和N2反应都属于氮的固定 C.大型中央空调的致冷剂可用液氨 D.铵盐易溶于水,且可与强碱发生复分解反应 解析:由于NH3易挥发,通常把NH3转化为铵态氮肥. 答案:A 2.下列过程不属于氮的固定的是( ) A.N2―→NO B.NH3―→NH4NO3 C.N2―→NH3 D.N2NO 解析:氮的固定是指将游离态的氮转变为氮的化合物.这样,A、C、D项均是氮的固定,B项是由化合态氮变为化合态氮,不是氮的固定. 答案:B 3.下列不属于铵盐的共同性质的是( ) A.易溶于水 B.与苛性钠共热产生NH3 C.都是晶体 D.受热分解都产生NH3 解析:铵盐都是晶体,均易溶于水,与NaOH共热都能发生NH+OH-NH3↑+H2O而产生NH3;部分氧化性酸对应的铵盐受热分解,发生氧化还原反应,不产生NH3.如NH4NO3. 答案:D 4.有关氨气的实验较多,下面对这些实验原理的分析中,正确的是( ) A.氨气极易溶于水,可以用来做喷泉实验 B.氨气的还原性可以解释氨气与氯化氢的反应实验 C.NH3·H2O不稳定,实验室可用NH4Cl和石灰水制取氨气 D.NH3液化时放出大量的热,因而,不能用氨作制冷剂 解析:NH3与HCl反应为非氧化还原反应,B项错误;因NH3易溶于水,实验室制NH3用NH4Cl固体和熟石灰加热,C项错误;液氨汽化时,吸收大量热,可用液氨作制冷剂,D项错误. 答案:A 5.关于铵盐的叙述中正确的是( ) ①所有铵盐中,氮元素化合价都是-3价 ②所有铵盐都溶于水 ③铵态氮肥不易跟草木灰混合使用 ④铵盐都是离子化合物 ⑤铵盐都能与碱反应,不能与酸反应 A.①③④ B.②③④ C.①②③④ D.①②③④⑤ 解析:NH4NO3中的NO中的氮元素是+5价,①不对;NH4HCO3也能与酸反应,⑤不对. 答案:B 6.已知NH3和HCl都能用来作喷泉实验.若在同温同压下用等体积烧瓶,一个收集满NH3,另一个收集HCl气体未满,做喷泉实验,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑溶质的扩散及静止时液面高度的影响)( ) A.溶质的物质的量浓度相同、溶质的质量分数不同 B.溶质的质量分数相同,溶质的物质的量浓度不同 C.溶质的物质的量浓度和溶质的质量分数都不同 D.溶质的物质的量浓度和溶质的质量分数都相同 解析:同温同压下等体积时,NH3和HCl的物质的量相等,质量不等,由于气体充满烧瓶,所以最终液体充满烧瓶,烧瓶内溶液关系是物质的量浓度相同,溶质的质量分数不同. 答案:A 7.下列有关Cl、N、S等非金属元素化合物的说法正确的是( ) A.漂白粉的成分为次氯酸钙 B.实验室可用浓硫酸干燥氨气 C.实验室可用NaOH溶液处理NO2和HCl废气 D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒 解析:漂白粉的主要成分为次氯酸钙和氯化钙,有效成分为次氯酸钙,故A错;实验室不能用浓硫酸干燥氨气,因为它们会发生反应生成硫酸铵,故B错;NO2和HCl都是酸性气体,所以可用NaOH吸收,故C对;D中在酸性废水中不能形成氢氧化铝胶体而达不到目的. 答案:C 8.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( ) A.装置①常用于分离互不相溶的液体混合物 B.装置②可用于吸收HCl气体,并防止倒吸 C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3 D.装置④b口进气可收集H2、NO等气体 解析:装置①为蒸馏装置,用于分离沸点不同的、互相溶解在一起的液体混合物,A项错误;装置②已将导气管插入H2O中,并不能防止倒吸,B项错误;装置④不能用来收集NO气体,NO在空气中易氧化,D项错误;装置③可使NH4HCO3受热分解生成NH3、H2O和CO2,而碱石灰可以吸收CO2与H2O,C项正确. 答案:C 二、非选择题(本题包括5小题,共52分) 9.(8分)利用如图所示的装置收集以下8种气体:①H2 ②Cl2 ③O2 ④HCl ⑤NH3 ⑥NO ⑦SO2 ⑧NO2 (1)若烧瓶是干燥的,则由B口进气,可收集的气体有________,若由A口进气,可收集的气体有________. (2)若在烧瓶内充满水,可收集的气体有________,气体应由________口进入. (3)若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有________,气体应由________口进入. 解析:(1)由B口进气,则此干燥烧瓶是向上排空气法收集气体的装置.题目给出的8种气体中,Cl2、O2、HCl、SO2、NO2密度比空气大,且常温时不与空气反应,可用向上排空气法收集;由A口进气,则此装置为向下排空气法收集气体的装置,H2、NH3密度比空气小,且常温时不与空气反应,可用向下排空气法收集. (2)若烧瓶中充满水,则为排水法收集气体的装置.H2、O2、NO难溶于水,可用排水法收集.用排水法收集时,气体应由A口进入. (3)NH3在水中显碱性,与浓H2SO4反应,不可用浓硫酸干燥,其余7种气体均可用浓硫酸干燥.干燥气体时,气体由B口进入. 答案:(1)②③④⑦⑧ ①⑤ (2)①③⑥ A (3)①②③④⑥⑦⑧ B 10.(10分)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题: (1)三位同学制取氨气的化学方程式为: ________________________________________________________________________. (2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是________. A.氨气难溶于水 B.氨气极易溶于水 C.氨气密度比空气大 D.氨气密度比空气小 E.氨气密度比水大 F.氨气密度比水小 (3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是________________(用化学方程式表示). (4)检验氨气是否收集满的方法是________. A.闻到有氨气逸出 B.棉花被气体冲出 C.用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝 D.用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红 (5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是________(填“甲”、“乙”或“丙”). 答案:(1)2NH4Cl+Ca(OH)2CaCl2+2NH3+2H2O (2)BD (3)乙 2NH3+H2SO4===(NH4)2SO4 (4)C (5)丙 11.(11分)如图表示A、B、C、D、E五种含氮物质相互转化的关系图.其中A、B、C、D常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和有关反应的化学方程式. (1)各物质的化学式 A________、B________、C________、D________、 E________ (2)各步反应的化学方程式 ①A―→C_________________________________________________________________. ②D―→C_________________________________________________________________. ③B―→E_________________________________________________________________. ④C―→B_________________________________________________________________. 解析:本题的突破口B为红棕色气体,B是NO2,C与O2能生成气体B,故C为NO.E在常温下不是气体,故E为HNO3,由图转化关系进一步分析知A为N2,D为NH3. 答案:(1)N2 NO2 NO NH3 HNO3 (2)①N2+O22NO ②4NH3+5O24NO+6H2O ③3NO2+H2O===2HNO3+NO ④2NO+O2===2NO2 12.(10分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应. 回答下列问题: (1)A中加入的物质是________________,发生反应的化学方程式是________________; (2)B中加入的物质是________,其作用是_____________________________________; (3)实验时在C中观察到的现象是____________________________________________, 发生反应的化学方程式是____________________________________________; (4)实验时在D中观察到的现象是________________,D中收集到的物质是____________,检验该物质的方法和现象是________________. 解析:由实验目的“氨可以与灼热的氧化铜反应得到氮气和金属铜”并结合装置图可知,A装置提供NH3,且是固固加热制备气体,则A中应加入固体NH4Cl和Ca(OH)2,发生反应:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O.B装置是干燥装置,除去NH3中的水汽,应加入碱石灰或CaO等碱性固体干燥剂.C装置中发生反应:2NH3+3CuON2+3H2O+3Cu,则C中黑色粉末逐渐变为红色.反应生成的N2及水蒸气和未反应的NH3均会从C装置中进入D试管中,则D中收集到的是氨水,因为氨气极易溶于水.E装置是气体收集装置,收集到的是N2. 答案:(1)固体NH4Cl和Ca(OH)2 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O(其他合理答案也给分) (2)碱石灰(或CaO) 除去NH3气流中的水蒸气 (3)黑色粉末部分逐渐变为红色 2NH3+3CuON2+3H2O+3Cu (4)出现无色液体 氨水 用红色石蕊试纸检验、试纸变蓝;用无水硫酸铜检验、无水硫酸铜变蓝 13.(13分)喷泉是一种常见的自然现象,其产生的原因是存在压强差. (1)制取氨气并完成喷泉实验(图中部分夹持装置已略去). ①用图1装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是________________________________________________________________________. 该实验的原理是____________________________________________________________ ________________________________________________________________________. ②如果只提供如图2的装置,请说明引发喷泉的方法 ________________________________________________________________________ ________________________________________________________________________. (2)利用图3装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________. A.Cu与稀盐酸 B.NaHCO3溶液与NaOH溶液 C.CaCO3与稀H2SO4 D.NH4HCO3与稀盐酸 (3)在图3锥形瓶中加入酒精,把锥形瓶放入水槽中,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉.水槽中加入的物质可以是________. A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜 (4)从产生喷泉的原理分析,图1、2是________上部烧瓶内的压强.图3是________下部锥形瓶内气体的压强(均填“增大”或“减小”).人造喷泉及火山爆发的原理与上述装置图________原理相似. 解析:(1)图1引发喷泉,只需打开止水夹,挤压胶头滴管即可,图2则需先打开止水夹,用热毛巾捂圆底烧瓶,发现有气泡冒出后,移去热毛巾即可. (2)能在锥形瓶内反应产生气体,压强大于圆底烧瓶内压强方可,故应选NH4HCO3和盐酸.其他要么不反应,要么反应不生成气体或产生气体很少. (3)浓H2SO4溶于水放出大量热,使瓶内酒精汽化也会发生喷泉. (4)图1、2导致上部压强减小,图3导致下部压强增大,人造喷泉及火山爆发均与图3原理相似. 答案:(1)①打开止水夹,挤压胶头滴管 NH3溶于少量水中,使圆底烧瓶内压强减小,烧杯内水喷入圆底烧瓶 ②打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾 (2)D (3)A (4)减小 增大 3查看更多