- 2021-07-05 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习物质结构与性质作业(全国通用)(4)
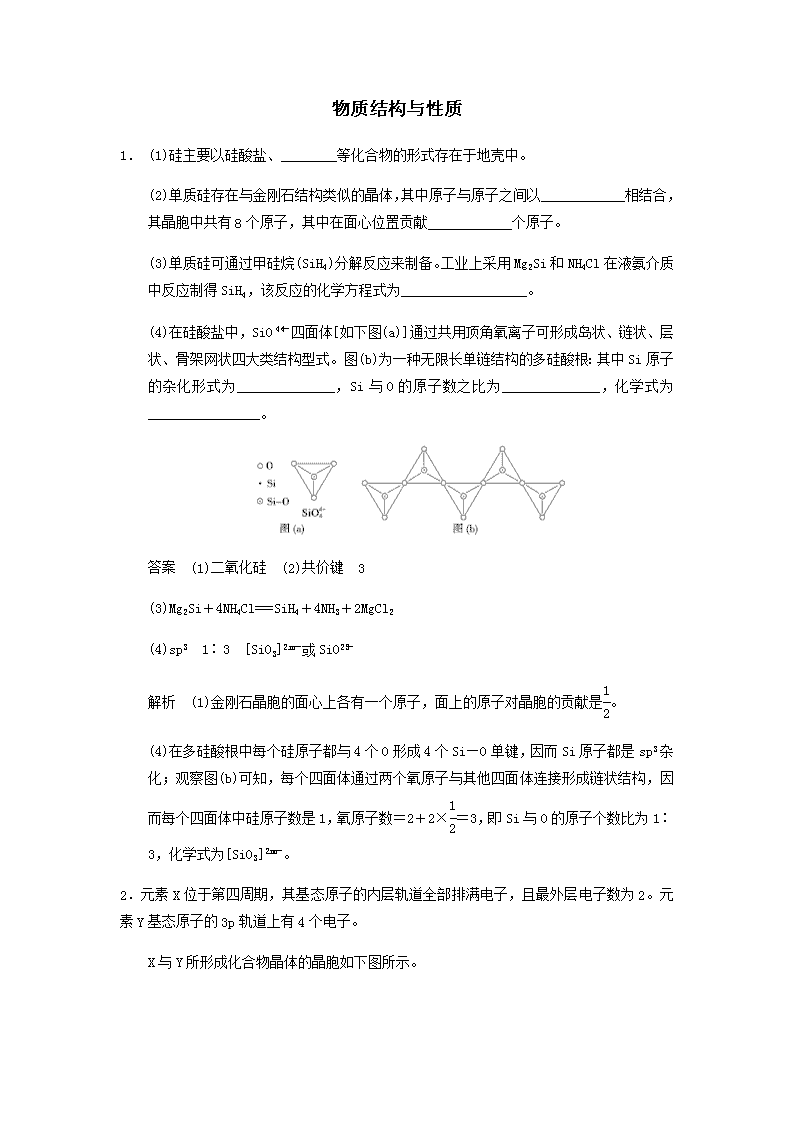
物质结构与性质 1. (1)硅主要以硅酸盐、________等化合物的形式存在于地壳中。 (2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以____________相结合,其晶胞中共有8个原子,其中在面心位置贡献____________个原子。 (3)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为__________________。 (4)在硅酸盐中,SiO四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:其中Si原子的杂化形式为______________,Si与O的原子数之比为______________,化学式为________________。 答案 (1)二氧化硅 (2)共价键 3 (3)Mg2Si+4NH4Cl===SiH4+4NH3+2MgCl2 (4)sp3 1∶3 [SiO3]或SiO 解析 (1)金刚石晶胞的面心上各有一个原子,面上的原子对晶胞的贡献是。 (4)在多硅酸根中每个硅原子都与4个O形成4个Si—O单键,因而Si原子都是sp3杂化;观察图(b)可知,每个四面体通过两个氧原子与其他四面体连接形成链状结构,因而每个四面体中硅原子数是1,氧原子数=2+2×=3,即Si与O的原子个数比为1∶3,化学式为[SiO3]。 2.元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。 X与Y所形成化合物晶体的晶胞如下图所示。 ①在1个晶胞中,X离子的数目为________。 ②该化合物的化学式为________。 答案 ①4 ②ZnS 解析 ①由晶胞结构可知,一个晶胞中X离子的数目为8×+6×=4个。②Y在晶胞内部,共4个,化学式为ZnS。 3. Al2O3在一定条件下可制得AlN,其晶体结构如下图所示,该晶体中Al的配位数是________。 答案 4 解析 分析AlN晶体结构示意图,与Al原子距离最近且等距离的N原子数为4。 4. NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2NF3+3NH4F 上述化学方程式中的5种物质所属的晶体类型有_______________________(填序号)。 a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体 答案 abd 解析 NH3、F2、NF3都是分子晶体,Cu是金属晶体,NH4F是离子晶体。 5.利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为________________________________________。 答案 2 BN 解析 ○:1+8×=2,:1+4×=2 所以每个晶胞中含有B原子的个数为2,其化学式为BN。 6.前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们的价电子层中未成对电子数分别为4和2,且原子序数相差为2。 (3)A、B和D三种元素组成的一个化合物的晶胞如图所示。 ①该化合物的化学式为____________;D的配位数为______________。 ②列式计算该晶体的密度________ g·cm-3。 (4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有__________________;该化合物中存在一个复杂离子,该离子的化学式为__________,配位体是__________。 答案 (3)①K2NiF4 6 ②=3.4 (4)离子键、配位键 [FeF6]3- F- 解析 有4个未成对电子的一定是过渡金属,前四周期元素中只有3d64s2符合,因而C为Fe元素,顺推出D为Ni,B为K,A为F。 (3)①A(F)原子数=1××16+1××4+2=8 B(K)原子数=1××8+2=4 D(Ni)原子数=1××8+1=2 即该化合物的化学式为K2NiF4 D的配位体是距其最近的异种原子A,分别在它的前面、后面、左边、右边、上边、下边,共6个A原子。 (4)在K3[FeF6]中K+与[FeF6]3-之间是离子键,[FeF6]3-中Fe3+与F-之间是配位键,Fe3+是中心体,F-是配位体。 7. 用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g· cm-3,则铜晶胞的体积是__________cm3、晶胞的质量是________g,阿伏加德罗常数为________(列式计算,已知Ar(Cu)=63.6)。 答案 4.70×10-23 4.23×10-22 NA==6.01×1023 mol-1 8. 一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。 (1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。 ①写出基态Mn原子的价电子排布式为____________________________________。 ②CO的空间构型是__________________(用文字描述)。 (2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。 ①根据等电子体原理,CO分子的结构式为_________________________________。 ②CO2分子中C原子轨道的杂化类型为____________________________________。 ③1 mol甲醛(HCHO)分子中含有的σ键数目为______________________________。 (3)向CuSO4溶液中加入过量NH3·H2O溶液可生成[Cu(NH3)4]2+。不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为______________________。 答案 (1)①3d54s2 ②平面三角形 (2)①C≡O ②sp杂化 ③3×6.02×1023个(或3NA) (3) 解析 (1)CO的价层电子对数为3+(4+2-2×3)=3,所以其空间构型为平面三角形。 (2)①CO与N2互为等电子体,故其结构式为C≡O,②CO2分子为直线形,C原子的杂化类型为sp,③甲醛的结构式为CHOH,所以1 mol HCHO中含有σ键数目为3NA。 (3)Cu提供空轨道,N提供孤电子对。 9. 铜及其合金是人类最早使用的金属材料。 (1)金属铜采取下列哪种方式堆积 ( ) (2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。 (3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下: ①胆矾的化学式用配合物的形式表示为____________。 ②胆矾中SO的空间构型为________,H2O中O原子的杂化类型为________。 ③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是 ( ) A.晶体从常温升到105 ℃的过程中只有氢键断裂 B.胆矾晶体中形成配位键的4个水分子同时失去 C.120 ℃时,剩余固体的化学式是CuSO4·H2O D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种 答案 (1)C (2)2 (3)①[Cu(H2O)4]SO4·H2O ②正四面体形 sp3杂化 ③CD 解析 (1)金属Cu采取面心立方堆积,C正确。(2)○为1+8×=2,为4个。所以代表Cu原子,○代表氧原子。一个Cu原子周围有2个O原子,所以其配位数为2。(3)在CuSO4晶体中含有4个配位键,配位数为4,所以CuSO4·5H2O用配合物可表示为[Cu(H2O)4]SO4·H2O,SO的空间构型为正四面体形,H2O分子中O原子采取sp3杂化。 n(晶体)=0.01 mol。2.500 g-2.140 g=0.36 g,失去0.02 mol水,所以从常温到105 ℃的过程中除了断裂氢键,还断裂配位键,A错;根据上述分析,B错;C项2.500 g-1.780 g=0.72 g,失去0.04 mol,所以还剩1个结晶水分子,正确;D项,102~113 ℃失去2个水分子、113~258 ℃,再失去2个水分子,258 ℃以上再失去一个水分子,所以按克服的作用力大小不同,晶体中的水分子可以分为3种,正确。 10.化学中的某些元素是与生命活动密不可分的元素。请回答下列问题: (1)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式分别是________,NO的空间构型为____________。 (2)A、B、C三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。 ①B元素基态原子电子排布式为___________________________________________。 ②A元素单质的晶体堆积模型为________(填字母),其空间利用率为__________。 ③氢元素与C元素可形成一种红色化合物,其晶体结构单元如下图。则该化合物的化学式为__________(小白球表示H,小黑球表示C)。 (3)已知氮化硼(BN)的一种晶体结构与金刚石相似,则B—N—B之间的夹角是________,氮化硼的密度为3.52 g·cm-3,则B—N键的键长是________pm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。 答案 (1)sp3、sp2杂化 平面三角形 (2)①1s22s22p63s23p63d54s1或[Ar]3d54s1 ②b 68% ③CuH (3)109°28′ ××1010 解析 (1)NH为正四面体结构,所以N原子的杂化方式为sp3,NO中含有3对价层电子对,其离子构型为平面三角形,N原子采取sp2杂化。 (2)A、B、C的价电子构型分别为4s1、3d54s1、3d104s1,所以A为K,B为Cr,C为Cu。K为体心立方堆积,Cu为面心立方最密堆积,体心立方堆积的空间利用率为68%,而面心立方最密堆积的空间利用率为74%。 ③H()∶6×+1+3=6 Cu()∶12×+2×+3=6 其化学式为CuH。 (3)BN的基本结构单元为正四面体,所以B—N—B之间的夹角为109°28′。一个金刚石晶胞中含有C原子数为8×+6×+4=8个,所以一个BN晶胞中含有4个B原子,4个N原子,设晶胞的棱长为a cm,则B—N的键长为(为体对角线的)。 a3·3.52×NA=4×25 a= 所以其键长为××1010 pm。 11.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。 A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 B元素原子的核外p电子总数比s电子总数少1 C原子p轨道上成对电子数等于未成对电子数,且与A同周期 D元素的族序数与周期数的差为4,且不与A元素在同一周期 E位于周期表中第七列 F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 (1)A的基态原子最外层有______种不同运动状态的电子。 (2)E2+的基态核外电子排布式为____________________。 (3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是________。A、B、C三种元素组成的分子中与AC2互为等电子体的分子为________________(用元素符号表示)。 (4)BD3中心原子的杂化方式为________,其分子空间构型为____________。 (5)用晶体的X射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积( 如下图),又知该晶体的密度为ρ g·cm-3,晶胞中该原子的配位数为______________;F的原子半径是________ cm(阿伏加德罗常数为NA)。 答案 (1)4 (2)1s22s22p63s23p63d5或[Ar]3d5 (3)CH4<NH3<H2O N2O (4)sp3 三角锥形 (5)12 × 解析 A的电子排布式为1s22s22p2,为C元素;B的电子排布式为1s22s22p3,为N元素;C的电子排布式为1s22s22p4,为O元素;D为Cl元素,E为Mn元素,F为Cu元素。 (1)有几个电子就有几种运动状态,所以C元素的最外层应有4种不同运动状态的电子。 (3)对于CH4、NH3、H2O,由于H2O、NH3均存在分子间氢键,所以熔点H2O>NH3>CH4,在C、N、O组成的分子中与CO2互为等电子体的分子为N2O。 (4)NCl3中N原子采取sp3杂化,其分子空间构型为三角锥形。 (5)铜原子半径为面对角线的,设棱长为a, 则a3·ρ·NA=4×64 a==4 r==× cm。 12.(1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取________杂化,NH中H—N—H键角比NH3中H—N—H键角大,原因是__________________。 (2)Cu3N形成的晶体结构如图所示,N3-的配位数是________________。 (3)常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有________,其大小顺序是__________。 (4)NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是__________。 答案 (1)sp3 氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,排斥力小 (2)6 (3)化学键、范德华力、氢键 化学键>氢键>范德华力 (4)相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大 解析 (1)铵根离子中含有4个键,没有孤电子对,氮原子采取sp3杂化,氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,排斥力小。 (2)○∶8×=1 ∶12×=3 所以○代表N3-,代表Cu+ N3-的配位数为6(上下、前后、左右)。 (3)热冰中微粒间存在的作用力有化学键、范德华力、氢键,微粒间作用力大小顺序是化学键>氢键>范德华力。 (4)相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大。 13.已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素。A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D 的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。 (1)写出A元素的基态原子价电子排布式__________;F离子电子排布式为__________。 (2)写出X的化学式__________________________,化学名称为_________________。 (3)写出X涉及金属冶炼中的一个化学方程式_______________________________。 (4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:_____________________ ________________________________________________________________________。 (5)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是 ________________________________________________________________________。 (6)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________(只要求列出算式)。 答案 (1)2s22p4 1s22s22p63s23p6 (2)Na3AlF6 六氟合铝酸钠 (3)2Al2O3(熔融)4Al+3O2↑ (4)Al2O3为离子晶体而AlCl3为分子晶体,熔融状态下AlCl3不导电 (5)CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量 (6)CaF2 解析 由A原子L层上有2对成对电子,可知A原子的电子排布为1s22s22p4,为氧元素;A与B同周期,且B原子序数大于A的,故B必为氟元素;则可根据C3DB6为离子晶体,且B、C、D的简单离子核外电子排布相同,结合化合价可推出C、D分别为钠元素和铝元素,X为Na3AlF6;由CE、FA为电子数相同的离子晶体可推出二者分别为NaCl 和CaO。(6)由图中看出,每个晶胞中含有Ca原子个数8×+6×=4,F原子全部在该晶胞内部,故该晶胞含有F原子个数为8,其化学式为CaF2;取一个晶胞,其质量为,则其体积为质量除以密度,即。查看更多