- 2021-07-05 发布 |
- 37.5 KB |
- 30页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
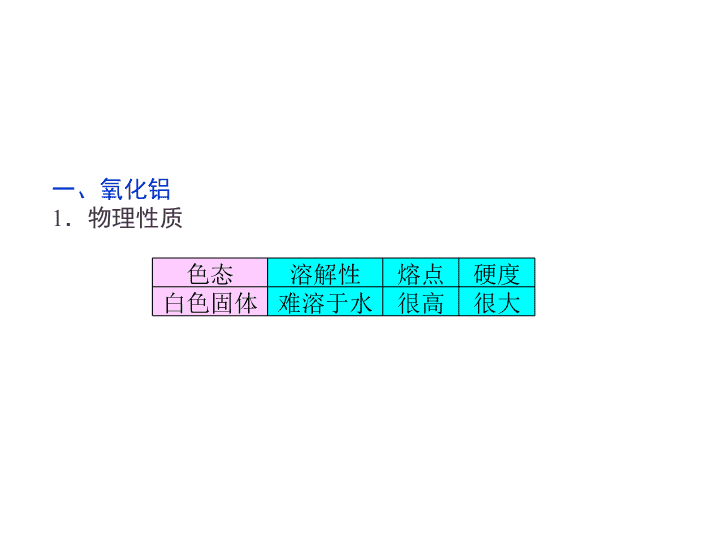
高中-化学:3铝的重要化合物
1.了解铝的重要化合物的主要性 质及应用。 2.了解铝的化合物相互转变的图 象。 3.了解与Al(OH)3相关的简单计 算。 一、氧化铝 1.物理性质 色态 溶解性 熔点 硬度 白色固体 难溶于水 很高 很大 2.化学性质 Al2O3是 氧化物,与 或 溶液都能反应生 成盐和水。 (1)与强酸反应的离子方程式:Al2O3+6H+===2Al3+ +3H2O。 (2)与强碱反应的离子方程式:Al2O3+2OH- ===2AlO2 -+H2O。 3.用途 (1)冶炼金属铝的原料。 (2)良好的 材料。 两性 酸 强碱 耐火 二、氢氧化铝 1.物理性质 溶于水的 物质。 2.化学性质 不 白色胶状 3.用途 (1)能凝聚水中的悬浮物并能 ,可用 来净水。 (2)利用其 性,可用作胃酸中和剂。弱碱 吸附色素 已学过的物质中既能与盐酸,又能与NaOH 溶液反应的有哪些? 【思考·提示】 有Al、Al2O3、Al(OH)3、 NaHCO3、(NH4)2CO3等。 思考 三、硫酸铝钾[KAl(SO4)2] 1.电离方程式:KAl(SO4)2===K++Al3+ +2SO42-。 2.十二水合硫酸铝钾 化学式: ,俗名: , 无色晶体,可溶于水,在天然水中生 成 ,可用作净水剂。 KAl(SO4)2·12H2 O明矾 Al(OH)3胶体 “铝三角”及其之间的相互转化 1.Al3+―→Al(OH)3(1)可溶性铝盐与少量NaOH溶液反应: Al3++3OH-(少量)===Al(OH)3↓ (2)可溶性铝盐与氨水反应: Al3++3NH3·H2O===Al(OH)3↓+3NH4 + 2.Al(OH)3―→Al3+ Al(OH)3溶于强酸溶液: Al(OH)3+3H+===Al3++3H2O 3.Al3+―→AlO2 - 可溶性铝盐与过量的强碱反应: Al3++4OH-(过量)===AlO2 -+2H2O 4.AlO2 -―→Al3+ 偏铝酸盐溶液与足量的盐酸反应: AlO2 -+4H+===Al3++2H2O 5.AlO2 -―→Al(OH)3(1)偏铝酸钠溶液中加入少量盐酸: AlO2 -+H+(少量)+H2O===Al(OH)3↓ (2)偏铝酸钠溶液中通入CO2: 2AlO2 -+CO2(少量)+3H2O===2Al(OH)3↓+CO32- AlO2 -+CO2(过量)+2H2O===Al(OH)3↓+HCO3 - 6.Al(OH)3―→AlO2 - Al(OH)3溶于强碱溶液: Al(OH)3+OH-===AlO2 -+2H2O 因Al(OH)3易溶于NaOH溶液,所以在制备 Al(OH)3时,不用Al3+与强碱反应,可向可溶性 铝盐中加入氨水,或向NaAlO2溶液中通入CO2来 制备。 特别提醒 A、B、C、D、E五种化合物,均含有常见 元素,它们的转化关系如图所示,其中A为澄清 溶液,C为难溶的白色固体,E则易溶于水,若 取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴 玻璃)。 (1)写出化学式:A________,C________, D________,E________。 (2)写出下列反应的离子方程式。 A→B:__________________________ _______________________________________ _______, F→E:___________________________ _______________________________________ ______。 【解析】 题目应以B物质作为突破口: 【答案】 (1)KAlO2 Al2O3 AlCl3 NaAlO2 (2)AlO2 -+CO2+2H2O===Al(OH)3↓+HCO3 - 2Al+2OH-+2H2O===2AlO2 -+3H2↑ A.Al(OH)3 B.AlCl3 C.HCl D.NaOH解析:选A。由Al3+转变为Al(OH)3,再转变为AlO2 -,是通过加入OH-实现 的,故由AlO2 -再转变为Al3+,应加入H+,AlO2 -首先转化为Al(OH)3,然后转化为 Al3+,A项符合题意。 1.相关图象 有关Al(OH)3沉淀的图象分析及有关计算 试剂 内容 向AlCl3溶液中滴加 NaOH溶液至过量 向NaAlO2溶液中加入盐酸 至过量 现象 立即产生白色沉淀→ 渐多→最多→渐少→ 消失 立即产生白色沉淀→渐多 →最多→渐少→消失 反应 Al3++3OH- ===Al(OH)3↓Al(OH)3 +OH-=== AlO2 -+ 2H2O AlO2 -+H++ H2O===Al(OH)3↓Al(OH)3 +3H+===Al3++3H2O 试剂 内容 向AlCl3溶液中滴加 NaOH溶液至过量 向NaAlO2溶液中加入盐 酸至过量 图象 2.滴加过程中铝元素的存在形式分析 (1)向1 L 1 mol/L的AlCl3溶液中滴加 NaOH溶液 (2)向1 L 1 mol/L的NaAlO2溶液中滴加稀 盐酸 向AlCl3溶液中加NaOH溶液和向NaAlO2溶 液中加盐酸,只要沉淀量未达最大值(如图中a), 则产生沉淀对应的碱或酸的量有两种情况,计算 时要注意讨论。 特别提醒 向50 mL 1 mol·L-1的Al2(SO4)3溶液中加入100 mL KOH溶液,充分反应得到3.9 g沉淀,则KOH溶 液的物质的量浓度可能是( ) A.1 mol·L-1 B.3 mol·L-1 C.1.5 mol·L-1 D.3.5 mol·L-1 【思路点拨】 本题可用两种方法求解: 法一:根据Al3+和Al(OH)3沉淀的量的关系,计 算KOH的浓度,要分别考虑KOH不足和KOH过量两 种情况。 法二:利用图象法,根据题意画出Al3+与KOH反应生成沉淀的图象,分析求解。 【解析】 首先写出有关反应的化学方程式,根据所给的数据找出已 知量和未知量的关系。 法二:用图象法求解,如图所示,当生成沉淀0.05 mol时,①需KOH 0.15 mol;②需KOH 0.35 mol。 【答案】 CD 若将上题中“50 mL”改为100 mL,KOH的浓度 可能是多少? 【提示】 可能为1.5 mol/L或7.5 mol/L,反应 的图象为 根据线段间比例可以得出a=0.15 b=0.75 2.向用HCl酸化过的AlCl3溶液中逐滴滴 入NaOH溶液,图中能正确表示这个反应的是( ) 解析:选D。向AlCl3溶液中逐滴滴入NaOH溶液,先生成白色沉淀, 再加入NaOH溶液,沉淀逐渐溶解,最后完全消失,生成1 mol Al(OH)3需3 mol NaOH,溶解1 mol Al(OH)3需1 mol NaOH。NaOH的用量应是3∶ 1,A、B 错误,用HCl酸化过的AlCl3溶液中含有酸,加入NaOH溶液先中和溶液中的酸, 然后才生成Al(OH)3沉淀,故C也是错误的。查看更多