- 2021-07-05 发布 |
- 37.5 KB |
- 22页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】陕西省榆林市第十二中学2019-2020学年高二下学期第二次月考(期中考试)(解析版)
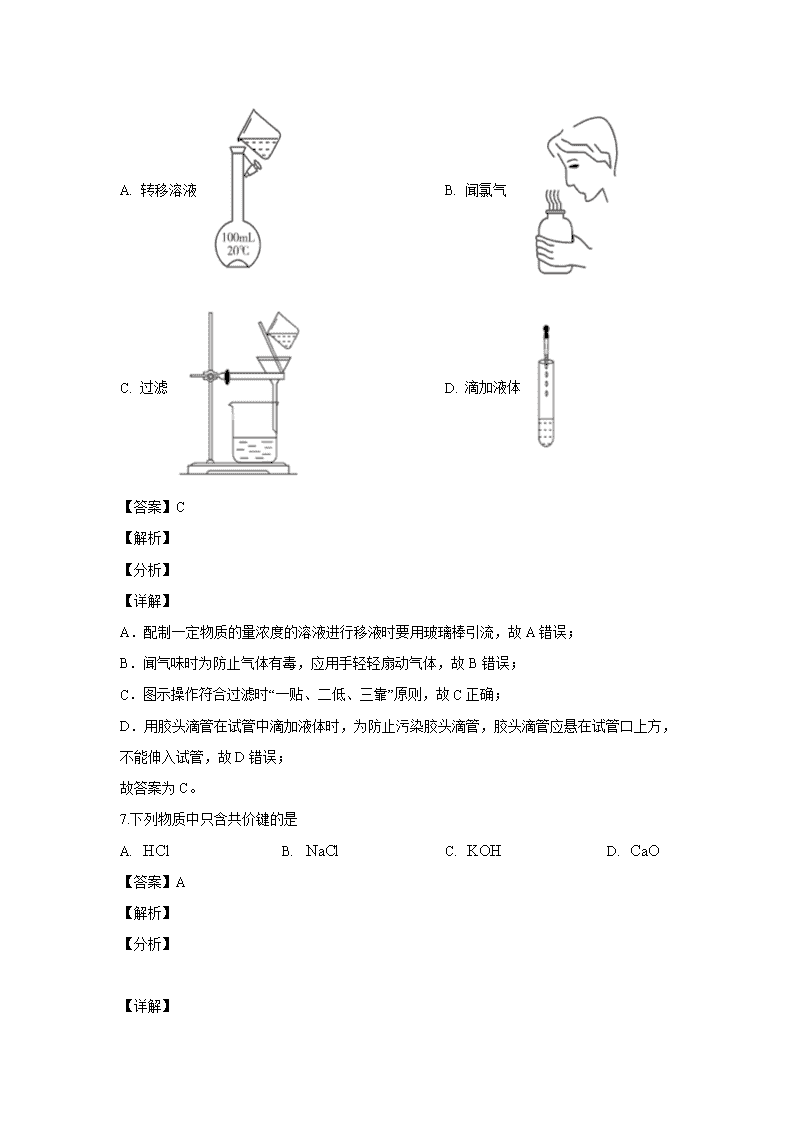
陕西省榆林市第十二中学2019-2020学年高二下学期第二次月考(期中考试) 第一部分(选择题共50分) 一、选择题(共10小题,每小题2分,计20分,在每小题给出的四个选项中,只有一项是符合题目要求的) 1.“心得安”是治疗心脏病的药物,其结构简式为它属于 A. 无机物 B. 有机物 C. 单质 D. 混合物 【答案】B 【解析】 【详解】 该物质为C、H、O、N四种元素组成的有机化合物,为纯净物,故答案为B。 2.碳酸氢钠()属于 A. 酸 B. 碱 C. 盐 D. 氧化物 【答案】C 【解析】 【详解】 酸是指电离出的阳离子全部为氢离子的化合物;碱是指电离出的阴离子全部是氢氧根的化合物;氧化物是只含有两种元素,其中一种为氧元素的化合物;碳酸氢钠可以电离出钠离子和碳酸氢根离子,属于盐,故答案选C。 3.制作计算机芯片的半导体材料是 A. 硅 B. 二氧化硅 C. 铝合金 D. 塑料 【答案】A 【解析】 【详解】 制作计算机锌片的半导体材料为硅单质,二氧化硅是制作光导纤维的主要原料,故答案为A。 4.铀元素是一种核素是反应堆的燃料。关于它的说法正确的是 A. 中子数是92 B. 质子数是92 C. 电子数是235 D. 质量数是148 【答案】B 【解析】 【分析】 铀元素是一种核素,核素符号左上角数字代表质量数,左下角数字代表质子数,质量数=质子数+中子数。 【详解】A.中子数=质量数-质子数=235-92=148,故A错误; B.质子数92,B正确; C.原子核外电子数=质子数=92,故C错误; D.质量数为235,故D错误; 故答案为B。 【点睛】核素符号左上角数字代表质量数,左下角数字代表质子数,质量数=质子数+中子数;原子核外电子数=原子序数=质子数。 5.下列仪器中,能用于直接加热的是( ) A. 容量瓶 B. 烧杯 C. 量筒 D. 试管 【答案】D 【解析】 【详解】A. 容量瓶不能用于加热,故A不符合题意; B. 烧杯要垫石棉网加热,故B不符合题意; C. 量筒不能用于加热,故C不符合题意; D. 试管能直接加热,故D符合题意。 综上所述,答案为D。 【点睛】能直接加热的仪器主要有试管、坩埚、燃烧匙、蒸发皿,需要垫石棉网加热的主要有烧瓶、锥形瓶。 6.下列实验操作中正确的是 A. 转移溶液 B. 闻氯气 C. 过滤 D. 滴加液体 【答案】C 【解析】 【分析】 【详解】 A.配制一定物质的量浓度的溶液进行移液时要用玻璃棒引流,故A错误; B.闻气味时为防止气体有毒,应用手轻轻扇动气体,故B错误; C.图示操作符合过滤时“一贴、二低、三靠”原则,故C正确; D.用胶头滴管在试管中滴加液体时,为防止污染胶头滴管,胶头滴管应悬在试管口上方,不能伸入试管,故D错误; 故答案为C。 7.下列物质中只含共价键的是 A. B. C. D. 【答案】A 【解析】 【分析】 【详解】 A.HCl为共价化合物,只含共价键,故A符合题意; B.NaCl为离子化合物,含氯离子和钠离子之间的离子键,故B不符合题意; C.KOH为离子化合物,钾离子和氢氧根之间存在离子键,氧原子和氢原子之间存在共价键,故C不符合题意; D.CaO离子化合物,钙离子和氧离子之间为离子键,故D不符合题意; 故答案为A。 8.在无色透明溶液中能大量共存的离子组是 A. B. C. D. 【答案】C 【解析】 【分析】 【详解】 A.铜离子的溶液显蓝色,无色溶液中不能含有大量铜离子,且铜离子会和氢氧根生成沉淀,故A错误; B.钡离子和碳酸根会生成沉淀而不能大量共存,故B错误; C.三种离子相互不反应可以大量共存,且无色,故C正确; D.氢离子和碳酸氢根会反应生成二氧化碳和水不能大量共存,故D错误; 故答案为C。 9.下列反应一定属于吸热反应的是 A. 天然气的燃烧 B. 盐酸与氢氧化钠溶液的反应 C. 钠与水的反应 D. Ba(OH)2·8H2O 与 NH2Cl 固体的反应 【答案】D 【解析】 【详解】A.所有的燃烧均属于放热反应,天然气燃烧属于放热反应,A不符合题意; B.酸碱中和反应属于放热反应,B不符合题意; C.钠与水的反应是放热反应,C不符合题意; D.Ba(OH)2•8H2O晶体与NH4Cl固体反应属于吸热反应,D符合题意; 故合理选项是D。 10.在刚刚闭幕的十二届全国人大三次会议上,政府工作报告中强调指出要加大环境治理。下列做法与该报告精神相违背的是 A. 为了提高农作物的产量,大量使用化肥和农药 B. 开发新能源,减少化石燃料的使用 C. 倡导多乘坐公交车和地铁,少开私家车出行 D. 提倡垃圾分类和回收利用,节约资源 【答案】A 【解析】 【详解】A.大量使用化肥和农药会造成水体污染,故A符合题意; B.开发新能源,减少化石燃料的使用,可以有效控制空气污染物的排放,保护环境,故B不符合题意; C.倡导多乘坐公交车和地铁,少开私家车出行可以减少尾气污染,故C不符合题意; D.提倡垃圾分类和回收利用,既节约资源,又防止污染,符合可持续发展的要求,故D不符合题意; 故答案为A。 二、选择题(共10小题,每小题3分,计30分。在每小题给出的四个选项中,只有一项是符合题目要求的) 11.下列叙述中正确的是 A. 标准状况下,1mol O2的体积是44.8L B. H2O的摩尔质量是18 g C. 2g H2中所含分子数目为NA(NA为阿伏加德罗常数) D. 1 mol/L MgCl2溶液中的物质的量浓度为1mol/L 【答案】C 【解析】 【详解】A.标况下1mol任何气体的体积均为22.4L,故A错误; B.水的摩尔质量为18g/mol,故B错误; C.2g H2的物质的量为=1mol,所含分子数为NA,故C正确; D.MgCl2可以电离出2个Cl-,所以1 mol/L MgCl2溶液中Cl-的物质的量浓度为2mol/L,故D错误; 故答案为C。 12.根据元素周期表判断,下列说法正确的是 A. 原子半径: B. 气态氢化物的稳定性: C. 碱性: D. 金属性: 【答案】B 【解析】 【分析】 【详解】 A.同周期主族元素自左至右原子半径依次减小,所以原子半径N>O>F,故A错误; B.非金属性越强,气态氢化物越稳定,非金属性:F>Cl>Br,所以稳定性:HF>HCl>HBr,故B正确; C.金属性越强,最高价氧化物的水化物碱性越强,金属性Na>Mg>Al,所以碱性NaOH>Mg(OH)2>Al(OH)3,故C错误; D.同主族元素自上而下金属性增强,所以金属性Li查看更多