- 2021-07-05 发布 |
- 37.5 KB |
- 5页


文档介绍
人教版高二化学第十三章 化学平衡训练
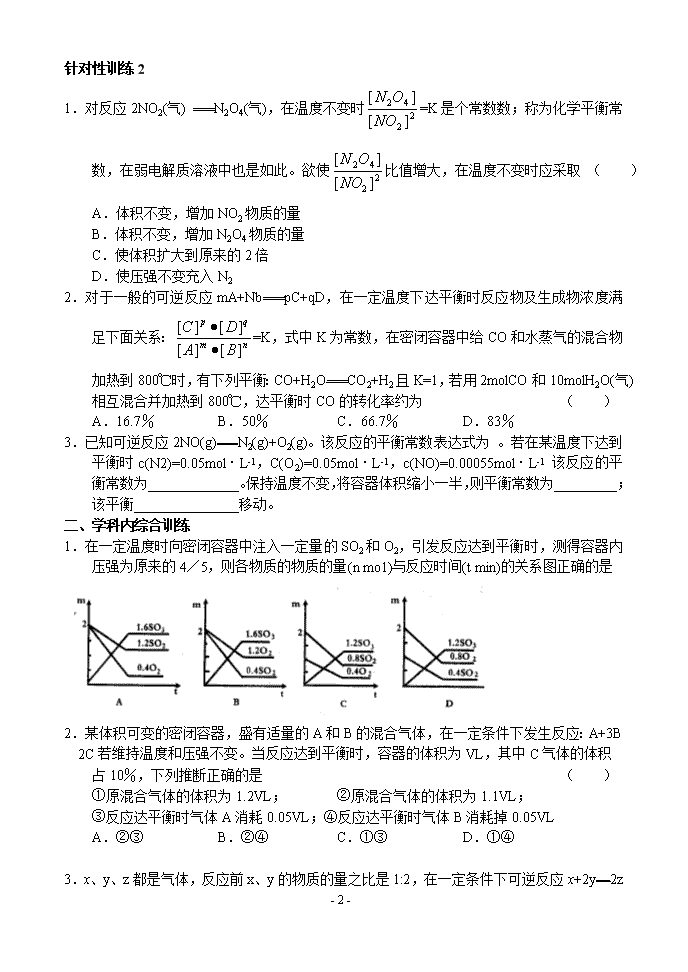
第二节 化学平衡 1.使学生建立化学平衡的观点 2.使学生理解化学平衡的特征 一、基础知识针对性训练 针对性训练1 l.化学平衡的特征在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是( ) A.C生成的速率与C分解的速率相等 B.单位时间生成nmolA,同时生成2nmolB C.A、B、C的浓度不再变化 D.A、B、C的分子数之比为1:3:2 2.在一个固定容积的密闭中,加入mmolA、nmolB,发生如下反应:mA(气)+nB(气) PC(气)。平衡时,C的浓度为Wmol/L。若容器的容积和温度不变,起始时加入amolA、bmolB、cmolC,使平衡后C的浓度仍为Wmol/L,则a、b、c必须满足的关系是 ( ) A.a:b:c=m:n:p B.a:b=m:n ap/m+c=p C.mc/p+a=m,nc/p+b=n D.a=m/3,b=n/3,c=2p/3 3.在容器中充入SO2和只由18O原子组成的氧气(18O2),在一定条件下达到平衡时,18O存在于 ( ) A.只存在于O2 B.只存在于O2和SO3 C.只存在于SO2和SO3 D.存在于SO2、SO3、O2中 4.可以充分说明可逆反应P(气)+Q(气) R(气)+S(气),在恒温下达到平衡状态的是 A.反应器内压强不随时间变化而变化 B.反应器内P、Q、R、S四种气体共存 C.生成P的速率与生成S的速率相等 D.生成1 molP同时有1molQ生成 5.在一个体积恒定的密闭容器中,加入2 molA和1 molB,发生反应:2A(气)+B(气)= 3C(气)+D(气),达平衡时,C的浓度为W mol/l若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为W mol/L的是 A.4molA+2molB B.2molA+1molB+3molC+1molD C.3molC+1molB+1molB D.3molC+1molD 6.在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:3A(气)+2B(气) xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度、压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为 A.x=3 y=l B.x=4 y=1 C.x=5 y=1 D.x=2 y=3 - 5 - 针对性训练2 1.对反应2NO2(气) N2O4(气),在温度不变时=K是个常数数;称为化学平衡常数,在弱电解质溶液中也是如此。欲使比值增大,在温度不变时应采取 ( ) A.体积不变,增加NO2物质的量 B.体积不变,增加N2O4物质的量 C.使体积扩大到原来的2倍 D.使压强不变充入N2 2.对于一般的可逆反应mA+Nb pC+qD,在一定温度下达平衡时反应物及生成物浓度满足下面关系:=K,式中K为常数,在密闭容器中给CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H2O CO2+H2且K=1,若用2molCO和10molH2O(气)相互混合并加热到800℃,达平衡时CO的转化率约为 ( ) A.16.7% B.50% C.66.7% D.83% 3.已知可逆反应2NO(g) N2(g)+O2(g)。该反应的平衡常数表达式为 。若在某温度下达到平衡时c(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.00055mol·L-1 该反应的平衡常数为_____________。保持温度不变,将容器体积缩小一半,则平衡常数为_________;该平衡_______________移动。 二、学科内综合训练 1.在一定温度时向密闭容器中注入一定量的SO2和O2,引发反应达到平衡时,测得容器内压强为原来的4/5,则各物质的物质的量(n mo1)与反应时间(t min)的关系图正确的是 2.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B2C若维持温度和压强不变。当反应达到平衡时,容器的体积为VL,其中C气体的体积 占10%,下列推断正确的是 ( ) ①原混合气体的体积为1.2VL; ②原混合气体的体积为1.1VL; ③反应达平衡时气体A消耗0.05VL;④反应达平衡时气体B消耗掉0.05VL A.②③ B.②④ C.①③ D.①④ 3.x、y、z都是气体,反应前x、y的物质的量之比是1:2,在一定条件下可逆反应x+2y - 5 - 2z达到平衡时,测得反应物总的物质的量等于生成物总的物质的量,则平衡时x的转化率 ( ) A.80% B.20% C.40% D.60% 4.可以作为判断化学平衡发生移动的标志是 ( ) A.反应混合物各组分的百分含量发生改变 B.正、逆反应速率发生改变 C.反应物的转化率发生改变 D.反应混合物的浓度发生改变 5.能够说明2HI(g) H2(g)十I2(g)已达到平衡状态的是 ( ) ①体系内HI、H2、I2三者物质的量相等 ②单位时间内生成nmolH2的同时,生成nmolHI; ③一个H—H键断裂的同时有两个H—I键断裂 ④反应速率VH2=VI2=VHI ⑤[HI]:[H2]:[I2]=2:1:1时 ⑥温度和体积一定时容器内压强不再变化 ⑦温度和体积一定时,混合气体颜色不再变化 ⑧温度和压强一定时,混合气体的密度不再发生变化 ⑨条件一定时,混合气体的平均相对分子质量不再变化 A.全部 B.除②⑤外 C.③⑥⑦⑧⑨ D.③⑦ 6.在一定条件下,气体A可发生如下反应:2A(g) B(g)+3C(g),若已知平衡时所得混合气体对H2的相对密度为4.25,则可推知,A的相对分子质量为 ( ) A.34 B.8.5 C.17 D.16 7.反应mA(气)+nB(气) pC(气)+qD(气),测得平均反应速率Vc=2VB,达平衡后,若保持温度不变,给体系加压,平衡不移动,则m、n、p、q数值正确的是 ( ) A.2,6,3,5 B.3,1,2,2 C.3,1,2,1 D.1,3,2,2 8.将2molPCl3和1molCl2,充入一容积不变的密闭容器中,在一定条件下反应:PCl3(气)+Cl2(气) pCl5(气)达平衡时,PCl5为0.4mol。此时若移走1molPCl3和0.5molCl2,在相同温度下达平 衡时PCl5的物质的量是 ( ) A.0.4mol B.小于0.2mol C.0.2mol D.大于0.2mol而小于0.4mol 9.恒温下,在三个恒容容器中分别发生下列三个反应:A(g) 2B(g)、2A(g)B(g)、2A(g) B(g)+C(g),到达平衡时,三个容器中A的转化率相同,此时在第一个容器中加入1molA, 第二个容器中加入2molA,第三个容器中加入3molA,重新达到平衡后,A的转化率分 别为a1、a2、a3 则: ( ) A.a1>a2>a3 B.a2>a3>a1 C.a3>a2>a1 D.a1=a2=a3 10.mA(g)+nB(S) PC(g)反应在密闭容器中达到平衡,将密闭容器的体积缩小时,发现A的转化率也随之下降,则下列关系式正确的是 ( ) A.m+n>p B.m+np 11.对于某一达到化学平衡的可逆反应,如果改变某种条件,结果生成物浓度增大,则( ) - 5 - A.平衡一定向正反应方向移动 B.平衡一定向逆反应方向移动 C.反应物浓度相应减少 D.平衡可能移动,也可能不移动 12.相同容积的四个密闭容器中,进行同样的可逆反应2A(g)+B(g) 3C(g)+2D(g)起始时各容器所装A、B的量分别是(如表)在相同温度下,建立平衡时,A或B的转化率大小关系正确的是 ( ) 甲 乙 丙 丁 A 2mol 1mol 2mol 1mol B 1mol 1mol 2mol 2mol A.A的转化率为:甲<丙<乙<丁 B.A的转化率为:甲<乙<丙<丁 C.B的转化率为:甲>丙>乙>丁 D.B的转化率为:丁>乙>丙>甲 13.在一定温度下。把2molSO2和1molO2充入一个容积一定的密闭容器中,发生如下反应:2SO2+O2 2SO3并达平衡。现在该容器中保持温度不变,令s、b、c分别代表初始加入的SO2、O:和SO3的物质的量(mol)。若a、b、c取不同数值,它们必然满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时完全相同,请填写下列空白: (1)若a=0,b=0,则c=_____________________ (2)若a=0.5,则b=_____________,c=________________ (3)a、b、c必须满足的条件是(请用两个方程式表示,其中一个只含a 和c,另一个只含c和b)_____________、______________。 14.在温度为830K时,可逆反应CO+H2O H2+CO2其平衡具有某些特殊性,若起始浓度CO为2moL/L,H20为3mol/L,反应达到平衡时,CO转化为CO2的转化率为60%;如果将H2O的起始浓度加大到 6mol/L,则CO的转化率为75%。请注意上述有关数据,总结出其中的规律,填写以下空白:设830K时,起始浓度CO为amol/L,H2O为b mol/L,反应达到平衡时c(H2)为cmol/L (1)当b不变,a变小,重新达到平衡时,CO的转化率__________H20的转化率 __________(填升高、降低或不变) (2)当a=5,c=20/9时,b=_______________ (3)当a=b时,c/a=_______________ (4)用以表示a、b、c之间关系的代数式是_______________ 三、学科间综合训练 1.如下图所示,在容器中充入N02 - 5 - amol,小木块质量6g,浮塞质量不计,外界压强为Po,表面积为S,此时整体处于平衡状态(恒温)。 (1)此时密闭容器内的压强为多少? (2)若此时气体体积减少1/3,问容器的产物是什么? (3)若往密闭容器中注入适量的 水时,发生反应的化学方程式为 2.抽烟对人体有害,烟草不完全燃烧产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应:CO+Hb0202+HbCO,实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损,试回答: (1)上述反应的平衡常数表达式为______________________________ (2)抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6mol·L和10-2mol·L-1,已知37℃时,平衡常数K=220,这时的浓度_______________(填大于、等于或小于)Hb02浓度的0.02倍。 - 5 -