- 2021-07-05 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习盖斯定律及应用作业(全国通用)
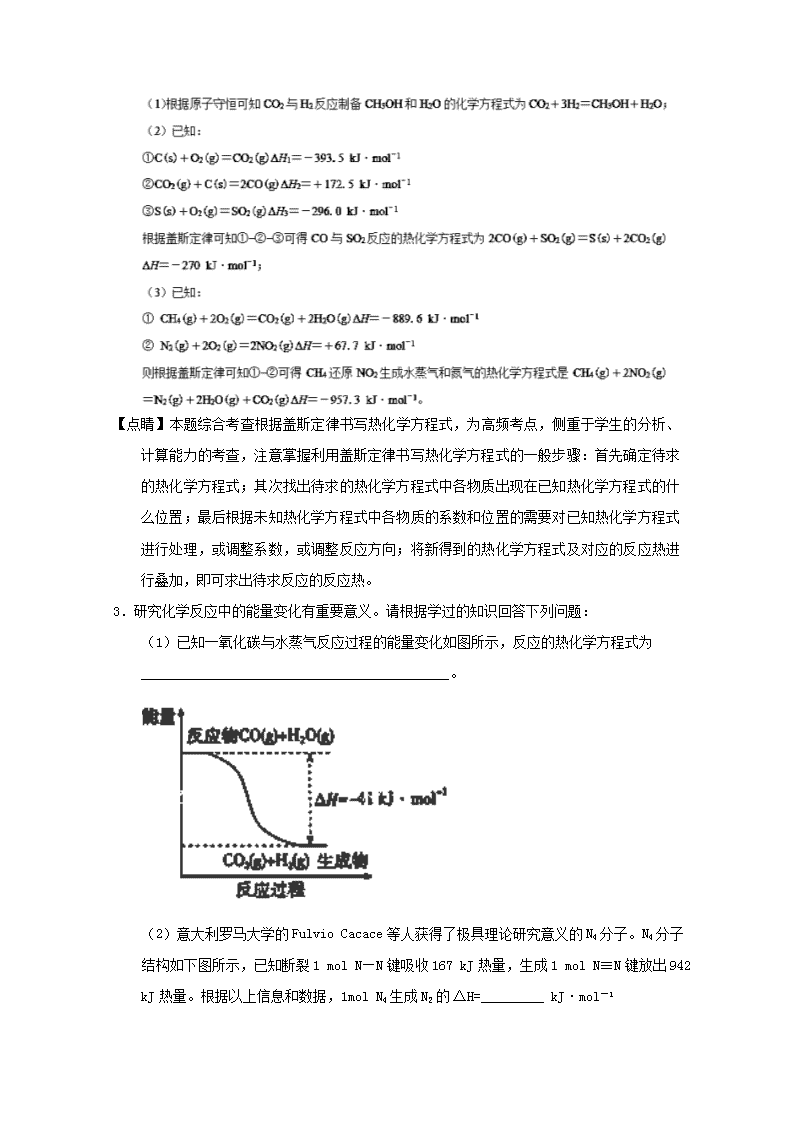
盖斯定律及应用 1.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题: (1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:反应的热化学方程式为________________。 (2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则1/2N2(g)+3/2H2(g)NH3(g) ΔH =______________。 (3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。 已知:①C(s,石墨)+O2(g)=CO2(g) ΔH1=akJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH2=bkJ·mol-1,③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=ckJ·mol-1,298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH =_______________。 (4)已知:铝热反应是放热反应,又知,常温下:4Al(s)+3O2(g)=2Al2O3(s) ΔH1,4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2,下面关于ΔH1、ΔH2的比较正确的是________ ΔH 1>ΔH 2 B.ΔH 1<ΔH 2 C.ΔH 1=ΔH 2 D.无法计算 【答案】CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1-46.2kJ·mol-1(2a + 0.5b —0.5c)kJ·mol-1B 【解析】 【详解】 46.2kJ·mol-1; (3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=akJ•mol-1;②2H2(g)+O2(g)=2H2O (l)△H2=bkJ•mol-1; 【点睛】明确反应热的计算依据是解答的关键,反应热计算的主要方法有:根据热化学方程式计算:反应热与反应物各物质的物质的量成正比;根据反应物和生成物的总能量计算:ΔH=E生成物-E反应物;依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算:ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量;根据盖斯定律的计算。 2.当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。 (1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。CO2与H2反应制备CH3OH和H2O的化学方程式为__________________________。 (2)在高温下一氧化碳可将二氧化硫还原为单质硫。 已知:①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1 ②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1 ③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1 请写出CO与SO2反应的热化学方程式__________________________ (3)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。已知: CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1① N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1② 则CH4还原NO2生成水蒸气和氮气的热化学方程式是__________________________ 【答案】CO2+3H2===CH3OH+H2O2CO(g)+SO2(g)===S(s)+2CO2(g) ΔH=-270 kJ·mol-1CH4(g)+2NO2(g)===N2(g)+2H2O(g)+CO2(g) ΔH=-957.3 kJ·mol-1 【解析】 【详解】 【点睛】本题综合考查根据盖斯定律书写热化学方程式,为高频考点,侧重于学生的分析、计算能力的考查,注意掌握利用盖斯定律书写热化学方程式的一般步骤:首先确定待求的热化学方程式;其次找出待求的热化学方程式中各物质出现在已知热化学方程式的什么位置;最后根据未知热化学方程式中各物质的系数和位置的需要对已知热化学方程式进行处理,或调整系数,或调整反应方向;将新得到的热化学方程式及对应的反应热进行叠加,即可求出待求反应的反应热。 3.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题: (1)已知一氧化碳与水蒸气反应过程的能量变化如图所示,反应的热化学方程式为____________________________________________。 (2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,1mol N4生成N2的ΔH=_________ kJ·mol-1 (3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。298K时,已知: ①C(s,石墨)+O2(g)CO2(g) ΔH1=a kJ·mol-1 ②2H2(g)+O2(g)2H2O(l) ΔH2=b kJ·mol-1 ③2C2H2(g)+5O2(g)4CO2(g)+ 2H2O(l) ΔH3=c kJ·mol-1 则反应:2C(s,石墨)+H2(g)C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。 (4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g)2Al2O3(s) ΔH1 4Fe(s)+3O2(g)2Fe2O3(s) ΔH2 下面关于ΔH1、ΔH2的比较正确的是____________ A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法比较 【答案】CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ/mol-882(2a+b/2-c/2)kJ/molB 【解析】 【详解】 (4)4Al(s)+3O2(g)═2Al2O3(s)△H1 ① 4Fe(s)+3O2(g)═2Fe2O3(s)△H2 ② 由盖斯定律①-②,得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1 -△H2,铝热反应为放热反应,即△H1 -△H2<0,所以△H1<△H2;故答案为:B。 【点睛】明确反应热的计算依据是解答的关键,反应热计算的主要方法有:根据热化学方程式计算——反应热与反应物各物质的物质的量成正比;根据反应物和生成物的总能量计算——ΔH=E生成物-E反应物;依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算——ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量;根据盖斯定律的计算等。 4.(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知 N2(g)+2O2(g)=2NO2(g) ⊿ H1= + 67.7kJ/mol; N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2= - 534kJ/mol; 2H2(g)+ O2(g)= 2H2O (g) ⊿ H3= - 484kJ/mol; H2(g)+F2(g)=2HF(g) ⊿ H4= - 538kJ/mol ①写出N2H4与 NO2反应的热化学方程式______________________, ②写出N2H4与F2反应的热化学方程式__________________________ (2)已知反应:Cl2+2HBr===Br2+2HCl。 Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。 Ⅱ.其能量变化示意图如图: 由上述数据判断断开1 mol H—Cl 键与断开1 mol H—Br键所需能量相差约为________kJ。 【答案】N2H4(g)+ 2NO2(g)= 3N2(g)+ 4H2O(g) ⊿ H =-1135.7 kJ/mol N2H4(g) +2F2(g)= N2(g)+4HF(g) ⊿ H = - 1126kJ/mol。 62 【解析】 【详解】 (1)①N2(g)+2O2(g)=2NO2(g) ⊿ H1 = + 67.7kJ/mol; ②N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2 = - 534kJ/mol; ③2H2(g)+ O2(g)= 2H2O (g) ⊿ H3 = - 484kJ/mol; ④H2(g)+F2(g)=2HF(g) ⊿ H4 = - 538kJ/mol; i根据盖斯定律: ②×2-①得到: N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(g) ⊿H=-1135.7 kJ/mol;综上所述,本题答案是:N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(g) ⊿H =-1135.7 kJ/mol。查看更多