- 2021-07-05 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年江西省宜春市上高二中高二上学期第一次月考试题 化学 word版
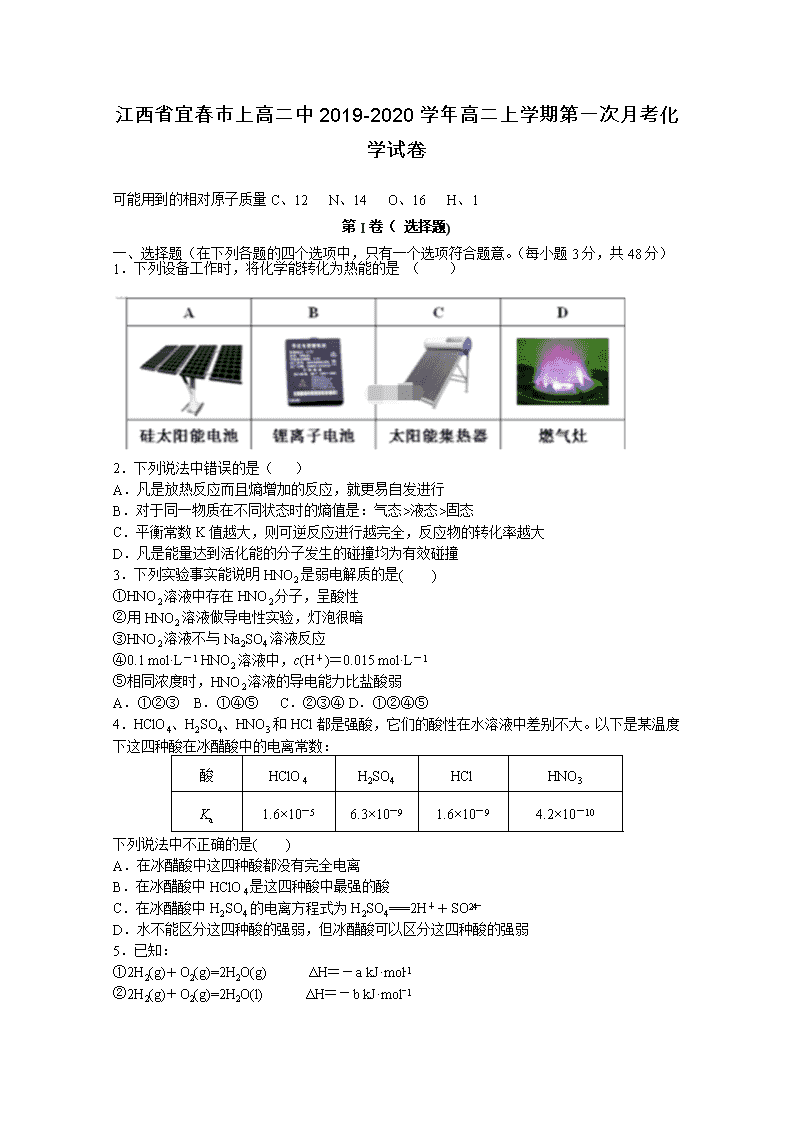
江西省宜春市上高二中2019-2020学年高二上学期第一次月考化学试卷 可能用到的相对原子质量C、12 N、14 O、16 H、1 第I卷( 选择题) 一、选择题(在下列各题的四个选项中,只有一个选项符合题意。(每小题3分,共48分) 1.下列设备工作时,将化学能转化为热能的是 ( ) 2.下列说法中错误的是( ) A.凡是放热反应而且熵增加的反应,就更易自发进行 B.对于同一物质在不同状态时的熵值是:气态>液态>固态 C.平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大 D.凡是能量达到活化能的分子发生的碰撞均为有效碰撞 3.下列实验事实能说明HNO2是弱电解质的是( ) ①HNO2溶液中存在HNO2分子,呈酸性 ②用HNO2溶液做导电性实验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液中,c(H+)=0.015 mol·L-1 ⑤相同浓度时,HNO2溶液的导电能力比盐酸弱 A.①②③ B.①④⑤ C.②③④ D.①②④⑤ 4.HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数: 酸 HClO4 H2SO4 HCl HNO3 Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10 下列说法中不正确的是( ) A.在冰醋酸中这四种酸都没有完全电离 B.在冰醋酸中HClO4是这四种酸中最强的酸 C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱 5.已知: ①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1 ②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·molˉ1 分子中的化学键 H-H O2分子中的氧氧键 O-H 断开1mol化学键所需的能量/kJ 436 498 463 下列说法正确的是( ) A.a>b B.反应①中反应物总键能大于生成物总键能 C.a=482 D.反应②中反应物的总能量小于生成物的总能量 6.已知H2(g)+2ICl(g)I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示, 已知:ICl中氯为-1价,碘为+1价。下列有关说法正确的是( ) A.反应①为吸热反应 B.反应①和②均是同种元素间发生的氧化还原反应 C.反应①比反应②的速率慢,与相应正反应的活化能有关 D.HI(g)+ICl(g) I2(g)+HCl(g) △H=-218 kJ/mol 7. 2SO2(g)+O2(g)2SO3(g) △H=-196.6KJ/mol是制备硫酸的重要反应。下列叙述不正确的是 A.反应达到平衡状态后,SO3(g)浓度保持不变 B.催化剂V2O5能够加快反应速率 C.增加O2的浓度将提高SO2的转化率 D. 降低温度可以缩短反应达到平衡的时间 8.下列热化学方程式中,正确的是( ) A. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1 B. 已知燃烧7.80 g乙炔(C2H2)气体生成二氧化碳气体和液态水时,放出389.9 kJ的热量,则乙炔燃烧的热化学方程式为: 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-389.9 kJ· mol-1 C. HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ·mol-1 D. 在101 kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示氢气与氧气反应的热化学方程式为2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ·mol-1 9.S(单斜)和S(正交)是硫的两种同素异形体。 已知:① S(单斜,s)+O2(g) =SO2(g) △H1=-297.16 kJ·mol-1 ② S(正交,s)+O2(g) = SO2(g) △H2=-296.83 kJ·mol-1 ③ S(单斜,s) = S(正交,s) △H3 下列说法正确的是( ) A.△H3=+0.33 kJ·mol-1 B.单斜硫转化为正交硫的反应是吸热反应 C.S(单斜,s) =S(正交,s) △H3<0,正交硫比单斜硫稳定 D.S(单斜,s) = S(正交,s) △H3>0,单斜硫比正交硫稳定 10.一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:2X(g)+Y(g)2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是( ) A.将容器体积变为10L,Z的平衡浓度变为原来的 B.在该温度下,该反应的平衡常数K=0.011 C.达到平衡时,容器内气体的压强是原来的90% D.若降低温度,X的体积分数增大,则该反应的△H<0 11. 300℃下,在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g) CH3OH(g) 。下列各物理量随反应时间变化趋势的曲线不正确的是( ) 12.一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是( ) A. 容器内CO的物质的量分数保持不变 B.容器内体系的压强保持不变 C.容器内气体的密度保持不变 D.单位时间内消耗1molH2O(g),同时生成1molCO(g) 13.把1 L 0.1 mol·L-1醋酸溶液用蒸馏水稀释至10 L,下列叙述正确的是( ) A.c(CH3COOH)变为原来的 B.c(H+)变为原来的 C.的比值增大 D.溶液的导电性增强 14.一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( ) A. 容器Ⅰ、Ⅱ中正反应速率相同 B.器Ⅰ、Ⅲ中反应的平衡常数相同 C. 容器Ⅰ中CO的物质的量比容器Ⅱ中的少 D.器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1 15.己知NH3·H2O (aq) 与H2SO4 (aq) 反应生成1mol 正盐的反应热△H=-24.2kJ/moL;盐酸与氢氧化钠稀溶液反应中和热△H=-57.3kJ/mol。则NH3·H2O在水中电离的△H等于( ) A. +45.2 kJ/mol B.-45.2 kJ/mol C.+69.4kJ/mol D.-69.4kJ/mol 16.温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是( ) A.前50 s 的平均速率v(PCl3)= 0. 0032 mol·L-1·s-1 B.持其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的△ H<0 C.同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前v(正)>v(逆) D.同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的转化率小于80% 第II卷(非选择题) 二、 综合题(共5小题,52分) 17、(10)对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题: (1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(至少写出两项): 。 (2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O 2CrO42- (黄色)+ 2H+。 D试管中实验现象为 , 用平衡移动原理解释原因: (3)实验(Ⅲ)中实验目的是探究 。 (4)在室温下进行实验(Ⅳ)溶液褪色的时间:t(A) t(B)(填>、<或= ) 18、(8分)25 ℃时,部分物质的电离常数如下表所示: 化学式 CH3COOH H2C2O4 H2S 电离常数 1.8×10-5 Ka1=5.4×10-2 Ka1=1.0×10-7 Ka2=5.4×10-5 Ka2=7.1×10-15 请回答下列问题: (1)若把CH3COOH、H2C2O4、HC2O4-、H2S、HS-都看作是酸,其中酸性最弱的是________。 (2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序为_____________________。 (3)NaHS溶液与NaHC2O4溶液反应的离子方程式为 _______________________________________________________________。 (4)0.1 mol·L-1H2S溶液中C(H+)=________ mol·L-1。 19.(12分)I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量. (1)写出该反应的热化学方程式_______________________________________. (2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ. (3)丙烷燃烧可以通过以下两种途径: 途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1 途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1 2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1 2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值) 判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量. II、利用如图所示装置测定中和热的实验步骤如下: ①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。 回答下列问题: (1)为什么所用NaOH溶液要稍过量?__________________________。 (2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下: 实验 序号 起始温度t1/℃ 终止温度t2/℃ 盐酸 氢氧化钠 1 20.0 20.0 23.0 2 20.1 20.1 23.2 3 20.1 20.1 24.2 4 20.2 20.2 23.4 依据该学生的实验数据计算,该实验测得的中和热ΔH=____kJ·mol−1_(结果保留一位小数)。 (3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。 20.(10分)碳的化合物在生产、生活中有着重要的作用。 (1)已知: 2CO(g)+O2(g) 2CO2(g) △H1=-566kJ·molˉ1 H2O(g)+CO(g) H2(g)+CO2(g) △H2=-41kJ·molˉ1 CO(g)+2H2(g) CH3 OH(g) △H3=-107 kJ. molˉ1 则CH3OH(g)+O2(g) CO2(g)+2H2O(g) △H=___________kJ·molˉ1 (2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0 mol CO2和6.8molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= -50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。 ①在0~5min内A容器中v(CH3OH)=_______;该温度下上述反应的平衡常数K=_______(保留两位有效数字)。 ②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A) ________(填“>”“<”或“=”)v(B)。 ③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是 (填标号) a.体系内的压强增大 b.气体的平均相对分子质量增大 c.断裂H-H键的数目是形成C-O键数目的2倍 d.v逆(CO2)=v正(H2) 21.(12分)新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下: 反应 I: 4NO(g)+4CH3OH(g)+O2(g) 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1 反应 II: 2CO(g)+2CH3ONO(g) CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1 反应 III: CH3OOCCOOCH3(1)+4H2(g) HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1 (1) 请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇(HOCH2CH2OH)的总热化学方程式: ,该反应在较低温条件下能自发进行,则ΔH______0 (填“>”、“<”或“=”)。 (2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。 ①下列选项能判断反应已达到化学平衡状态的是________。 a. 混合气体总物质的量不再变化 b. 混合气体的密度不再变化 c. 单位时间内生成 CO 和 NO 的物质的量相等 d. CO 和 CH3ONO 的浓度比不再变化 ②若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。 ③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。 ④反应达平衡后向2 L恒容密闭容器中再加入 0.4mol的CO 和 0.4mol NO,化学平衡向________(填“正反应”、“逆反应”或“平衡不移动”)方向移动。 2021届高二年级第一次月考化学试卷答题卡 一、选择题(在下列各题的四个选项中,只有一个选项符合题意。(每小题3分,共48分) 题 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答 二、综合题(共5小题,52分) 17、(10分) (1) (2) (3) (4) 18、(8分) (1) (2) (3) (4) 19、(12分) I、 (1) (2) (3) II、 (1) (2) (3) 20、(10分) (1) (2)① ② ③ 21、(12分) (1) (2)① ② ③ ④ 2021届高二年级第一次月考化学试卷答案 1—5:DDBCC 6—10:CDDCC 11—16:CDCDAC 17. (10分)(每空2分) (1) 温度,锌粒大小 (2) 溶液由橙黄色变为黄色 加 NaOH溶液使c(H+)减小,平衡右移,c(CrO42-)增大 (3)探究温度对反应速率的影响 (4) > 18(8分)答案:(每空2分) (1) HS- (2)H2C2O4>CH3COOH>H2S (3)HS-+HC2O===H2S↑+C2O (4)1.0×10-4 19、 (12分)(每空2分) I、(1). N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣640kJ/mol (书写不完整以零分计) (2). 408 (3). 等于 II(1)确保盐酸被完全中和 (2)−51.8 kJ·mol−1 (3) H2SO4与Ba(OH)2反应生成BaSO4沉淀的生成热会影响中和热的测定 20.(10分,每空2分) (1)-660 (2)①0.16mol/(L·min) 0.53 ② < ③ b 21.(12分,每空2分) (1)4H2(g)+2CO(g)+1/2O2(g) HOCH2CH2OH(l)+H2O(g) △H3=(1/2a+b+c)kJ·mol-1 < (2)①a bc ②增大 ③ b ④平衡不移动 2021届高二年级第一次月考化学试卷答案 1—5:DDBCC 6—10:CDDCC 11—16:CDCDAC 17. (10分)(每空2分) (1) 温度,锌粒大小 (2) 溶液由橙黄色变为黄色 加 NaOH溶液使c(H+)减小,平衡右移,c(CrO42-)增大 (3)探究温度对反应速率的影响 (4) > 18(8分)答案:(每空2分) (1) HS- (2)H2C2O4>CH3COOH>H2S (3)HS-+HC2O===H2S↑+C2O (4)1.0×10-4 19、 (12分)(每空2分) I、(1). N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣640kJ/mol (书写不完整以零分计) (2). 408 (3). 等于 II(1)确保盐酸被完全中和 (2)−51.8 kJ·mol−1 (3) H2SO4与Ba(OH)2反应生成BaSO4沉淀的生成热会影响中和热的测定 20.(10分,每空2分) (1)-660 (2)①0.16mol/(L·min) 0.53 ② < ③ b 21.(12分,每空2分) (1)4H2(g)+2CO(g)+1/2O2(g) HOCH2CH2OH(l)+H2O(g) △H3=(1/2a+b+c)kJ·mol-1 < (2)①a bc ②增大 ③ b ④平衡不移动查看更多