- 2021-07-05 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届广东省汕头市潮南实验学校高二上学期期中考试(2016
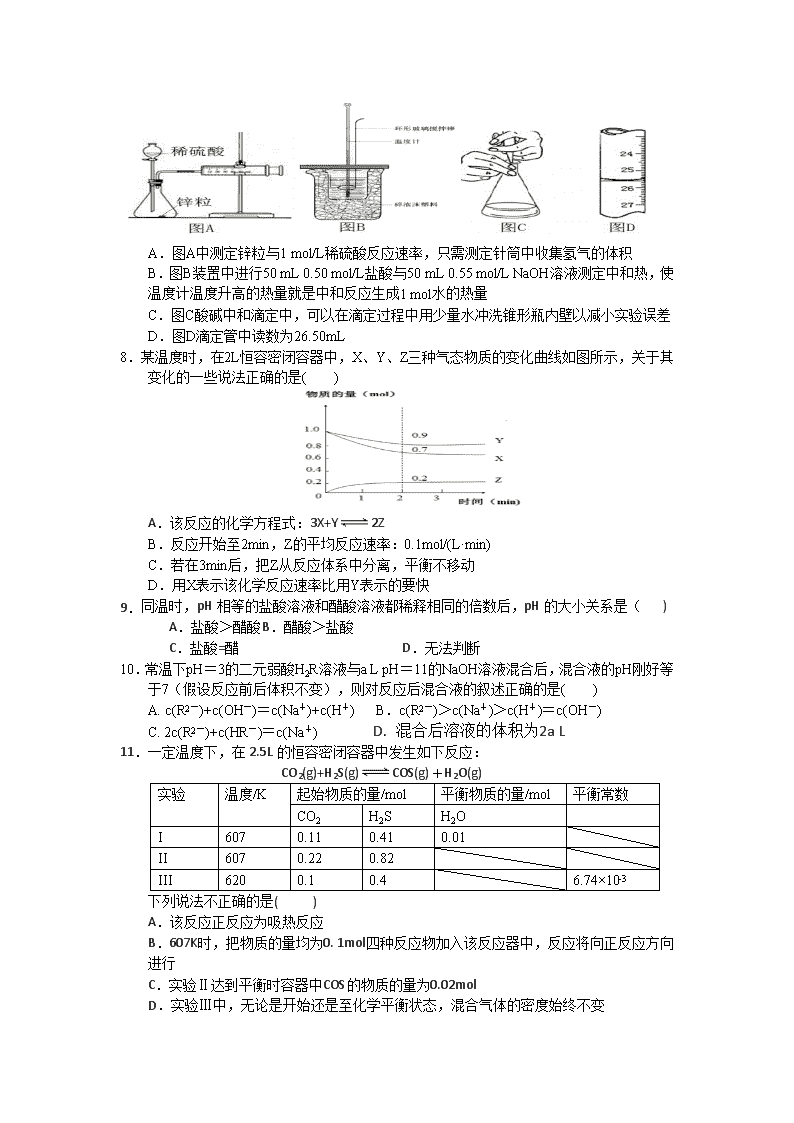
潮南实验学校2016-2017学年度第一学期期中考试 高二化学试题 试卷分值 100分 考试时间 90分钟 一、单项选择题(本题包括20小题,每题 3分,共60分。每小题只有一个选项符合题意) 1.下列物质中,属于强电解质的是( ) A.氨水 B.硫酸 C.乙酸 D.葡萄糖 2.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)⇌N2(g)+2CO2(g),下列说法中正确的是( ) A.使用适当的催化剂不改变反应速率 B.降低压强能提高反应速率 C.升高温度能提高反应速率 D.改变压强对反应速率无影响 3.下列离子方程式正确的是( ) A.碳酸氢钠水解:HCO3-+ H2OH3O++ CO32- B.醋酸铵溶于水:CH3COONH4+ H2OCH3COOH + NH3·H2O C.硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32-(aq)=CaCO3(s) + SO42-(aq) D.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:HSO4-+ OH-=SO42-+ H2O 4.关于浓度均为0.1mol/L的四种溶液:①NH3·H2O、②HCl、③NH4Cl 、④(NH4)2CO3,下列说法正确的是( ) A.由水电离出的c(H+):④>③>①>② B.①、②和③等体积混合后的溶液:pH=7 C.c(NH4+):③>④>① D.①和②等体积混合后的溶液:c(NH4+)+c(NH3·H2O)=0.1mol/L 5.常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见右图。下列说法不正确的是( ) A.常温下CaSO4溶解在水中,c(Ca2+)=c(SO42-) = 3×10-3mol/L B.在d点溶液中加入一定量的CaCl2可能会有沉淀析出 C.a点对应的Ksp等于c点对应的Ksp D.b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3mol/L 6. 物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10, 则HX、HY、HZ的酸性由强到弱的顺序是( ) A.HX、HY、HZ B.HX、HZ、HY C.HZ、HY、HX D.HY、HZ、HX 7.下列有关实验的说法正确的是( ) A.图A中测定锌粒与1 mol/L稀硫酸反应速率,只需测定针筒中收集氢气的体积 B.图B装置中进行50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液测定中和热,使温度计温度升高的热量就是中和反应生成1 mol水的热量 C.图C酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁以减小实验误差 D.图D滴定管中读数为26.50mL 8.某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( ) A.该反应的化学方程式:3X+Y2Z B.反应开始至2min,Z的平均反应速率:0.1mol/(L·min) C.若在3min后,把Z从反应体系中分离,平衡不移动 D.用X表示该化学反应速率比用Y表示的要快 9. 同温时,pH相等的盐酸溶液和醋酸溶液都稀释相同的倍数后,pH的大小关系是( ) A.盐酸>醋酸 B.醋酸>盐酸 C.盐酸=醋 D.无法判断 10.常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是( ) A. c(R2-)+c(OH-)=c(Na+)+c(H+) B.c(R2-)>c(Na+)>c(H+)=c(OH-) C. 2c(R2-)+c(HR-)=c(Na+) D. 混合后溶液的体积为2a L 11. 一定温度下,在2.5L的恒容密闭容器中发生如下反应: CO2(g)+H2S(g)COS(g)+H2O(g) 实验 温度/K 起始物质的量/mol 平衡物质的量/mol 平衡常数 CO2 H2S H2O I 607 0.11 0.41 0.01 II 607 0.22 0.82 III 620 0.1 0.4 6.74×10-3 下列说法不正确的是( ) A.该反应正反应为吸热反应 B.607K时,把物质的量均为0. 1mol四种反应物加入该反应器中,反应将向正反应方向进行 C.实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol D.实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变 12.下列叙述I和叙述Ⅱ均正确且有因果关系的是( ) 选项 叙述I 叙述Ⅱ A H2有还原性,浓硫酸有强氧化性 不能用浓硫酸干燥H2 B CuS难溶于水和硫酸 反应:H2S+CuSO4═CuS↓+H2SO4可以发生 C 海水中含有大量的Cl﹣、Br﹣等离子 向海水中通入F2可大量获得Cl2、Br2 D SO2具有酸性和漂白性 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 13.下列各组离子在溶液中能够大量共存的是( ) A.Na+、Al3+、Cl-、HCO3- B.使pH试纸显蓝色的溶液:K+、Cu2+、Cl-、SO42- C.滴入甲基橙指示剂呈红色的溶液:Na+、NH4+、ClO4-、NO3- D.水电离出的c(H+)=1×10-13mol/L的溶液:K+、NH4+、SO32-、Cl- 14.25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是 A.相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) B.在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 C.等物质的量浓度的NaClO和NaHCO3 混合溶液中: c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为: 2ClO-+CO2+H2O=CO32-+2HClO 15.某温度下,水的离子积Kw=1×10-13,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比是( ) A.11﹕1 B.9﹕1 C.1﹕11 D.1﹕9 16.下列实验操作、现象和结论均正确的是( ) 选项 实验操作 现象 结论 A SO2通入溴水中 溶液褪色 SO2有漂白性 B 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 溶液变红 Fe(NO3)2样品已氧化变质 C 向饱和碳酸钠溶液中通入CO2 有晶体析出 溶解度:NaHCO3>Na2CO3 D 向盛有少量NaHCO3的试管中滴加草酸溶液 有气泡产生 酸性:草酸>碳酸 17. 一定量的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可 向稀H2SO4中加入( ) A.NaOH固体 B.Na2SO4固体 C.NH4Cl饱和溶液 D.CH3COONa固体 18.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( ) A.饱和食盐水中:c(Na+)+c(H+)=c(Cl﹣)+c(OH﹣) B.饱和小苏打溶液中:c(Na+)=c(HCO3﹣) C.pH=4的醋酸中:c(H+)=4.0mol•L﹣1 D.pH=12的纯碱溶液中:c(OH﹣)=1.0×10﹣2mol•L﹣1 19.(2008·广东,9)已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol/L]。若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( ) 20.化合物Bilirubin在一定波长的光照射下发生分解反应(不可逆),反应物浓度随反应时间变化如下图所示,计算反应在4~8min间的平均反应速率和推测反应进行到16min时反应物的浓度,结果应是( ) A.2.5μmol·L-1·min-1和2.0μmol·L-1 B.2.5μmol·L-1·min-1和2.5μmol·L-1 C.3.0μmol·L-1·min-1和3.0μmol·L-1 D.5.0μmol·L-1·min-1和3.0μmol·L-1 二、非选择题(本大题共4小题,共55分) 21.(16分)已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下: (1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=______,C=___________,E=___________ 实验编号 温度 初始pH 0.1mol/L草酸溶液体积/mL 0.01mol/LKMnO4 溶液体积/mL 蒸馏水体积/mL 待测数据(混合液褪色时间/s) ① 常温 1 20 50 30 t1 ② 常温 A B C 30 t2 ③ 常温 2 40 D E t3 (2)该反应的离子方程式_____________________________。 (3)若t1<t2,则根据实验①和②得到的结论是________________________。 (4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: ①____________________________;②___________________________________。 (5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是:__________;实验中所需的定量仪器有__________(填仪器名称)。该KMnO4溶液的物质的量浓度为________mol/L。 22.(13分)二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳: ①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) ΔH1=-55.7 kJ/mol ②2CH3OH(l) =CH3OCH3(g)+H2O (l) ΔH2=-23.4 kJ/mol ③CO2 (g)+H2(g) =CO(g) + H2O (l) ΔH3 ④H2O (l) = H2O (g) ΔH4=+ 44.0 kJ/mol (1)已知反应CO2 (g)+H2(g) =CO(g) + H2O (g) ΔH,中相关的化学键键能数据如下: 化学键 H-H CO H-O C-H C=O E/(kJ·mol-1) 436 1076 465 413 745 由此计算ΔH=_____________________,则ΔH3 =______________________。 (2)CO2(g)加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式是_______________________。 (3)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示,图中A点和B点的平衡常数比较: KA______KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:___________________。 (4)常温常压下,向一个2.00 L的密闭恒容容器中加入等量2.00 mol二氧化碳和氢气,平衡时二甲醚的浓度为0.150 mol/L,计算此时二氧化碳的转化率及该反应的平衡常数,要求写出计算过程(计算结果保留3位有效数字)。 23.(12分)高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝: (1)“除杂”操作是加入H2O2后,然后用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中少量的Fe2+。 ① 酸性溶液中Fe2+与H2O2反应的离子方程式为 。 ② 过滤操作中所得到滤渣主要成分的化学式为 ; (2) 检验上述流程中“过滤”后杂质是否除尽的实验方法_____ 。 (3 )配制硫酸铝溶液时,需用硫酸酸化的目的是 。 (4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水),母液不能蒸干的原因是 。 (5)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中, c(NH4+)、c(Al3+) 、c(SO42-)三种离子浓度由大到小的顺序为 。 2016-2017学年高二期中化学考试答案 题号 1 2 3 4 5 6 7 8 9 10 答案 B C C A A A C A A C 题号 11 12 13 14 15 16 17 18 19 20 答案 B D C C D D c A B B 16.(16分) (1)A=2,C=50,E=10(每空1分,共3分) (2)5H2C2O4+2MnO4-+6H+=10CO2+2Mn2++8H2O (2分,反应物、产物正确得1分,配平1分,没有气体符号不扣分) (3)其他条件相同时,溶液的初始pH越小,该反应的反应速率越快 (2分,“其他条件相同时”漏写不扣分) (4)①该反应放热;②产物Mn2+是反应的催化剂(每空1分,共2分,未指明催化剂是Mn2+不扣分) (5)滴入最后一滴KMnO4溶液,溶液呈浅紫红色,且30秒内不恢复;(2分,后两个点各1分) 托盘天平、250mL容量瓶、酸式滴定管;(1×3=3分) 20a63V 或0.32aV(2分) 17.(12分) (1)-80kJ/mol(2分)-124kJ/mol(1分); (2)2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(l) △H =-134.8kJ/mol(2分,方程式1分,焓变1分) (3)= (1分) a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小。(2分,其它正确答案均可得分) (4)(4分)起始状态c(H2) = c(CO2)=2.00 mol2.00 L = 1.00 mol/L 2CO2(g)+ 6H2(g)== CH3OCH3(g)+3H2O(l) c(起始)/mol/L 1.00 1.00 0 0 c(转化)/mol/L 0.300 0.900 0.150 0.450 c(平衡)/mol/L 0.700 0.100 0.150 0.450 CO2的转化率=0.300 mol/L1.00 mol/L×100%=30.0% 26.(12分) (1)① 2Fe2++H2O2+2H+=2Fe3++2H2O(2分,未配平扣1分) ;② Fe(OH)3 (2分) (2)取少量过滤后溶液于试管中,滴入几滴KSCN溶液,若溶液未变红色,说明杂质已经除尽(2分,每个要点1分)。 (3)抑制(防止)Al3+水解(2分); (4)防止晶体失去结晶水,避免可溶性杂质结晶析出(2分,答对一点给1分)。 (5)c(SO42-) > c(NH4+) > c(Al3+) (2分)查看更多