2020届高考化学二轮复习物质结构与性质(选修③)学案
1.原子结构与元素的性质:(1)了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和电子排布图;(2)了解电离能的含义,并能用以说明元素的某些性质;(3)了解电子在原子轨道之间的跃迁及其简单应用;(4)了解电负性的概念并能用以说明元素的某些性质。 2.化学键与分子结构:(1)理解离子键的形成,能根据离子化合物的结构特征解释其物理性质;(2)了解共价键的形成、极性、类型(σ键和π键),
了解配位键的含义;(3)能用键能、键长、键角等说明简单分子的某些性质;(4)了解杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3);(5)能用价层电子对互斥理论或者杂化轨道理论推测简单分子或离子的空间结构。 3.分子间作用力与物质的性质:(1)了解范德华力的含义及对物质性质的影响;(2)了解氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。 4.晶体结构与性质:(1)了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别;(2)了解晶格能的概念,了解晶格能对离子晶体性质的影响;(3)了解分子晶体结构与性质的关系;(4)了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系;(5)理解金属键的含义,能用金属键理论解释金属的一些物理性质,了解金属晶体常见的堆积方式;(6)了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。
1.(2019·全国卷Ⅱ)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:(相对原子质量:Fe:56,Sm:150,As:75,F:19,O:16)
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH3的________(填“高”或“低”),其判断理由是__________________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
(3)比较离子半径:F-________O2-(填“大于”“等于”或“小于”)。
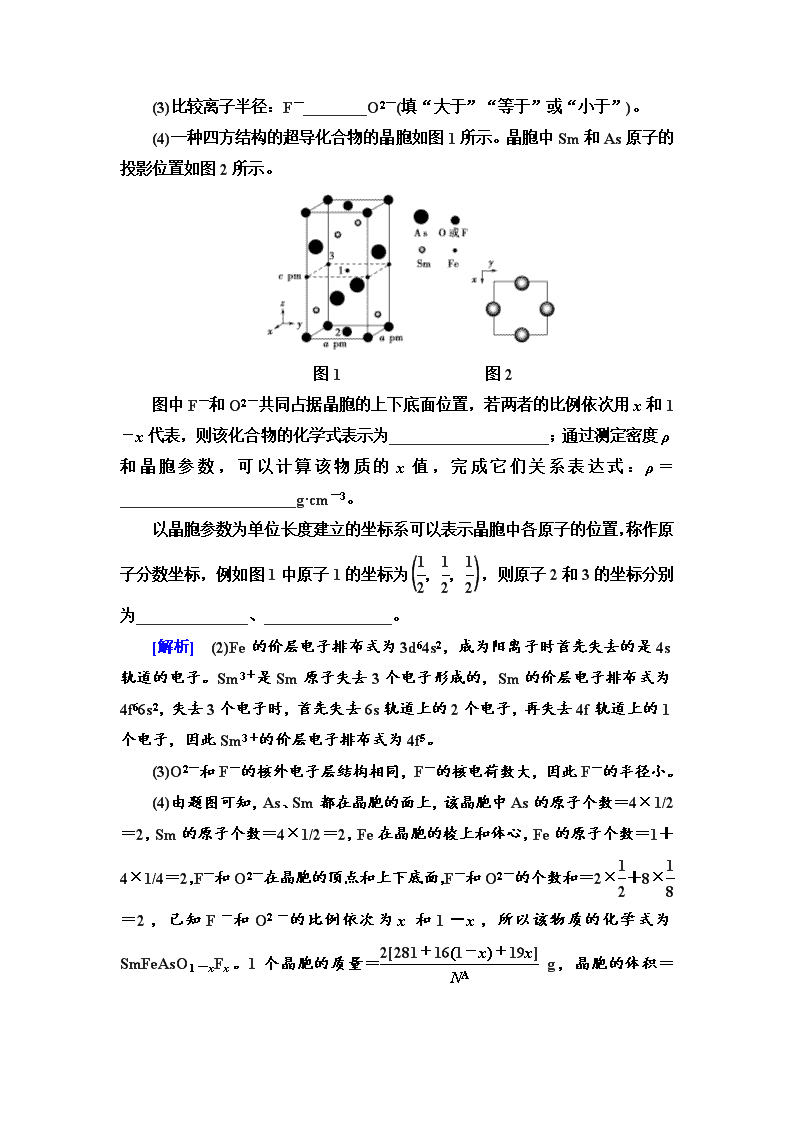
(4)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。
图1 图2
图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为____________________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=______________________g·cm-3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为,则原子2和3的坐标分别为______________、________________。
[解析] (2)Fe的价层电子排布式为3d64s2,成为阳离子时首先失去的是4s轨道的电子。Sm3+是Sm原子失去3个电子形成的,Sm的价层电子排布式为4f66s2,失去3个电子时,首先失去6s轨道上的2个电子,再失去4f轨道上的1个电子,因此Sm3+的价层电子排布式为4f5。
(3)O2-和F-的核外电子层结构相同,F-的核电荷数大,因此F-的半径小。
(4)由题图可知,As、Sm都在晶胞的面上,该晶胞中As的原子个数=4×1/2=2,Sm的原子个数=4×1/2=2,Fe在晶胞的棱上和体心,Fe的原子个数=1+4×1/4=2,F-和O2-在晶胞的顶点和上下底面,F-和O2-的个数和=2×+8×=2,已知F-和O2-的比例依次为x和1-x,所以该物质的化学式为SmFeAsO1-xFx。1个晶胞的质量= g,晶胞的体积=a
2c×10-30 cm3,所以晶胞的密度= g·cm-3。根据图1中原子1的坐标为,可看出原子2的z轴为0,x、y轴均为,则原子2的坐标为;原子3的x、y轴均为0,z轴为,则原子3的坐标为。
[答案] (1)三角锥形 低 NH3分子间存在氢键
(2)4s 4f5 (3)小于 (4)SmFeAsO1-xFx
2.(2018·全国卷Ⅰ)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是_____________________________________________________。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为________。LiAlH4中,存在________(填标号)。
A.离子键 B.σ键
C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
图(a)
可知,Li原子的第一电离能为________ kJ·mol-1,O===O键键能为________ kJ·mol-1,Li2O晶格能为________ kJ·mol-1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为________ g·cm-3(列出计算式)。
图(b)
[解析] (1)根据能级能量E(1s)
Al,P>S。
②逐级电离能逐渐增大(即I11.8,非金属元素;电负性<1.8,金属元素。
②确定化学键类型:一般来说,两成键元素电负性差值>1.7,离子键;两成键元素电负性差值<1.7,共价键。
③
判断元素价态正负:一般来说,电负性大的元素呈现负价,电负性小的元素呈现正价。
原子结构及核外电子排布
1.(2019·各地模拟精选)(1)氮族(ⅤA族)元素的外围电子排布式的通式为________。Sb的元素名称为______。基态P原子中,电子占据的最高能级符号为________,该能层具有的原子轨道数为________。
(2)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为________。
(3)基态Ca原子M能层电子排布图________,若价层电子由4s2状态变化为4s14p1状态所得原子光谱为______光谱(填“发射”或“吸收”)。
(4)下列氧原子电子排布图表示的状态中,能量最高的是________(填序号,下同),能量最低的是________。
(5)第四周期中,与N原子未成对电子数相同的金属元素有______种;最外层电子排布式为4s1的元素有______种。
(6)Si原子中未成对电子数与成对电子数的个数之比为________,最高能级的原子轨道形状为________。
[答案] (1)ns2np3 锑 3p 9
(2)4d105s1 (3) 吸收 (4)D A
(5)3 3 (6)1∶6 哑铃形
元素的主要性质
2.(2019·各地模拟精选)(1)对于呋喃(和吡咯)所含的元素中,电负性最大的是________,最小的是________;第一电离能最大的是________。
(2)Ca的第一电离能________(填“大于”或“小于”)Ga。理由是______________________________________________________
_____________________________________________________。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为:ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu<IZn的原因是_____________________________________________________。
(4)FeO和Fe2O3中较稳定的是________,从原子结构角度分析,其理由是______________________________________________
_____________________________________________________。
(5)组成HClO4~NaClO4的4种元素的电负性由小到大的顺序为________________。
(6)从原子结构的角度解释形成焰色反应的原因为___________
_____________________________________________________。
[答案] (1)O H N (2)大于 Ga的4p轨道上有一个电子,易失去,而Ca的4p轨道上全空较稳定 (3)锌失去的是全充满的4s2电子,铜失去的是4s1电子
(4)Fe2O3 Fe2O3中的+3价Fe的3d为半充满状态,很稳定 (5)Nasp2>sp3。
②杂化类型相同,中心原子孤电子对越多,键角越小,如H2OPH3。
④杂化类型和孤电子对数相同,配位原子的电负性越大,键角越小,如NCl3Mg2+,Cu2+的配位数比Mg2+大,故乙二胺与Cu2+形成的配合物更稳定。
(2)①在周期表中存在“对角线”关系的元素化学性质相似,如Li和Mg、Be和Al、B和Si等,所以与Li的化学性质最相似的邻族元素是Mg。Mg元素基态原子核外M层上只有3s轨道上2个自旋状态相反的电子。
②在蒸汽状态下FeCl3以双聚分子存在,即分子式为Fe2Cl6;每个Fe原子与3个Cl原子形成共价键,还可以提供空轨道与另1个Cl原子提供的孤对电子形成配位键,结构式可表示为
;由结构式可知,Fe的配位数为4。
[答案] (1)①A
②sp3 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+
(2)①Mg 相反
5.(2018·全国卷Ⅱ,节选)硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S
S8
FeS2
SO2
SO3
H2SO4
熔点/℃
-85.5
115.2
>600
(分解)
-75.5
16.8
10.3
沸点/℃
-60.3
444.6
-10.0
45.0
337.0
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________________________________________
______________________________________________________
_____________________________________________________。
图(a) 图(b)
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
[解析] (2)价层电子对数包括成键电子对数和孤电子对数,H2
S中S的成键电子对数为2,孤电子对数为=2,故价层电子对数为4(或价层电子对数为=4),同理,SO2中S的价层电子对数为=3,SO3中S的价层电子对数为=3,H2S中S的价层电子对数不同于SO2、SO3。(4)气态SO3为单分子,分子中S无孤电子对,其分子的立体构型为平面三角形,S和O之间形成双键,故共价键有σ键和π键两种。固态SO3为三聚分子,分子中每个S与4个O成键,S无孤电子对,故原子的杂化轨道类型为sp3。
[答案] (1) 哑铃(纺锤)
(2)H2S
(3)S8相对分子质量大,分子间范德华力强
(4)平面三角 2 sp3
晶体结构与性质
(对应学生用书第111页)
1.四类晶胞结构及其代表物
(1)离子晶体
(2)金属晶体:简单立方堆积(Po),体心立方堆积(Na、K),六方最密堆积(Mg、Zn),面心立方最密堆积(Cu、Ag)。
(3)分子晶体(图a)
(4)原子晶体(图b)
图a 图b
2.晶胞计算的思维方法
(1)“均摊法”原理
注意:①立方体晶胞中各线段之间的关系
②对于不是平行六面体的晶胞,用均摊法计算粒子数时,要注意均摊比例的不同,如三棱柱晶胞和六棱柱晶胞等。
(2)晶体密度的相关计算
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρV g(V为晶胞的体积),则1 mol晶胞的质量为ρVNA g,因此有xM=ρVNA。注意计算V时要注意晶胞的立体形状灵活计算,且注意V与ρ单位一致。
(3)晶胞中原子空间利用率=×100%。如面心立方最密堆积(如图所示)
分析:a=2r;
V(球)=4×πr3;
V(晶胞)=a3=(2r)3=16r3;
空间利用率=×100%=×100%≈74%。
3.比较晶体熔、沸点高低的规律方法
(1)不同类型晶体的熔、沸点高低一般规律
原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大。如钨、铂等熔点很高,汞、铯等熔点很低。
(2)同类型晶体的熔、沸点高低一般规律
①原子晶体
由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅。
②离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,晶格能就越大,其晶体的熔、沸点就越高。如熔点:MgO>NaCl>CsCl。
③分子晶体
a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。如H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。如SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。如CO>N2。
④金属晶体
金属离子半径越小,离子电荷数越多,金属键越强,金属熔、沸点就越高。如熔、沸点:Al>Mg>Na。
晶体结构及其晶胞计算
1.(2019·潍坊模拟)某磷青铜晶胞结构如下图所示:
(1)其中原子坐标参数A为(000);B为。则P原子的坐标参数为________。
(2)该晶体中距离Cu原子最近的Sn原子有________个,这些Sn原子所呈现的构型为________。
(3)若晶体密度为a g·cm-3,最近的Cu原子核间距为________pm(用含NA和a的代数式表示)。
[答案] (1) (2)4 平面正方形
(3)×1010
2.(2019·济宁模拟)萤石(CaF2)的晶胞如图所示。
(1)白球的代表粒子为________。
(2)Ca2+和F-的配位数分别为________、________。
(3)晶体中F-配位的Ca2+形成的空间结构为________形;Ca2+配位的F-形成的空间结构为________形。
(4)已知晶胞参数为0.545 nm,阿伏加德罗常数的值为NA,则萤石的密度为________g·cm-3(列出计算式,不必计算)。
[解析] 萤石的化学式为CaF2,即晶胞中钙离子与氟离子个数比为1∶2,从晶胞示意图看,每个晶胞中实际占有黑球的个数=8×1/8+6×1/2=4,晶胞中实际占有白球的个数为8,据此可知黑球代表Ca2+,白球代表F-。将该面心立方晶胞分割成8个小立方,每个小立方的4个顶点上是Ca2+,体心是F-,先选取1个顶点(Ca2+)作为考查对象,经过该顶点的小立方体有8个,即与该顶点的Ca2+距离相等且最近的F-共有8个,所以Ca2+的配位数为8。萤石的一个晶胞中实际占有4个Ca2+和8个F-,即4个CaF2组成。根据(0.545×10-7)3ρNA=4×78,可得ρ。
[答案] (1)F- (2)8 4 (3)正四面体、立方体
(4)
3.(2019·青岛模拟)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为________,已知该晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA,则密度ρ为________g·cm-3(用含a和NA的代数式表示)。
[解析] 1个A和1个B中含有的Fe2+、Fe3+、O2-分别为248,故1个晶胞中含8个Fe3O4。故:(a×10-7)3ρNA=8×M(Fe3O4)。ρ=。
[答案] Fe3O4
4.利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如下图所示。
(1)该晶胞原子坐标参数A为(000);B为(100);C为。则D原子的坐标参数为________,它代表__________________原子。
(2)若Cu2O晶体的密度为d g·cm-3,Cu和O的原子半径分别为rCu pm和rO pm,阿伏加德罗常数值为NA,列式表示Cu2O晶胞中原子的空间利用率为__________________________________________________________________
_____________________________________________________。
[解析] (1)根据晶胞的结构,D在A和C中间,因此D的坐标是,白色的原子位于顶点和体心,个数为8×+1=2,D原子位于晶胞内,全部属于晶胞,个数为4,根据化学式,推出D为Cu。(2)空间利用率是晶胞中球的体积与晶胞体积的比值,晶胞中球的体积为(4×πr+2×πr)×10-30cm3,晶胞的体积可以采用晶胞的密度进行计算,即晶胞的体积为 cm3,因此空间利用率为×100%。
[答案] (1) Cu
(2)×100%(答案合理即可)
5.如图为碳化钨晶体结构的一部分,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙固溶体。
(1)在此结构中,1个钨原子周围距离该钨原子最近的碳原子有________个,该晶体的化学式为________。
(2)该部分晶体的体积为V cm3,则碳化钨的密度为______g·cm-3(用NA表示阿伏加德罗常数的值)。
[解析] (1)据图可知,距离一个钨原子最近的碳原子的个数为6,钨原子位于顶点、棱上、面上、内部,属于该晶胞的个数为12×+6×+2×+1=66个碳原子位于内部,即化学式为WC。(2)晶胞的质量为 g,根据密度的定义可知,WC的密度为 g·cm-3。
[答案] (1)6 WC (2)
三类典型晶胞的体积计算
(1)立方体(晶胞边长为a):V=a3。
(2)长方体:V=abc。
(3)三棱柱或六棱柱:V=S底面×h。
晶体的主要性质
6.(1)Mn与Re属于同一族,研究发现,Mn的熔点明显高于Re的熔点,原因可能是________________________。
(2)CuSO4的熔点为560 ℃,Cu(NO3)2的熔点为115 ℃,CuSO4熔点更高的原因是__________________________________________
_____________________________________________________。
(3)根据下表提供的数据判断,熔点最高、硬度最大的是________(填化学式)。
离子晶体
NaF
MgF2
AlF3
晶格能/(kJ·mol-1)
923
2 957
5 492
(4)已知金刚石结构中C—C比石墨结构中C—C的键长长,则金刚石的熔点________石墨的熔点(填“高于”或“低于”或“等于”)理由是___________________________________________。
(5)碳酸盐的热分解示意图如图所示:
热分解温度:CaCO3________(填“高于”或“低于”)SrCO3,原因是____________________________________________________
_____________________________________________________。
[答案] (1)Mn的金属键比Re的金属键强
(2)CuSO4和Cu(NO3)2均为离子晶体,SO所带电荷比NO多,故CuSO4晶格能较大,熔点较高
(3)AlF3
(4)低于 键长越长,键能越小,键越不稳定,熔点越低
(5)低于 CaO晶格能大于SrO晶格能,故CaCO3更易分解生成CaO
7.(2019·模拟精选)(1)MnO的熔点(1650 ℃)比MnS的熔点(1610 ℃)高,它们都属于________晶体。前者熔点较高的原因是_________
_____________________________________________________。
(2)SiCl4和SnCl4通常均为液体。
①Si、Sn、Cl三种元素电负性由小到大的顺序为________(用元素符号表示)。
②SiCl4的立体构型为________。
③SiCl4的熔点低于SnCl4的原因为_______________________
_____________________________________________________。
(3)晶格能不可以用实验的方法直接测得,但是可以根据“盖斯定律”间接计算。NaCl是离子晶体,其形成过程中的能量变化如图所示:
由图可知,Na原子的第一电离能为________kJ·mol-1,NaCl的晶格能为________ kJ·mol-1。
(4) 中C原子的杂化方式为________,其熔点比NaF________(填“高”或“低”)。
(5)铜、银、金的晶体结构均为面心立方最密堆积。
①下列不属于晶体的共同性质的是________(填选项字母),判断晶体和非晶体最可靠的方法是________。
A.自范性 B.透明
C.固定的熔点 D.各向异性
E.热塑性
②已知金的相对原子质量为197,常温常压下密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则金原子的半径为________ cm(用含ρ、NA的代数式表示)。
[解析] (3)由图可知,Na(g)失去一个电子得到Na+(g)所需的能量为496 kJ·mol-1,因此Na原子的第一电离能为496 kJ·mol-1。根据盖斯定律可知, NaCl的晶格能为411 kJ·mol-1+108 kJ·mol-1+121 kJ·mol-1+496 kJ·mol-1-349 kJ·mol-1=787 kJ·mol-1。
(4)离子半径越大,晶格能越小,熔点越低,的半径比F-的半径大,因此其熔点低于NaF。
(5)②金的晶胞为面心立方最密堆积,一个晶胞中含有4个金原子,所以晶胞的体积为 cm3,边长为 cm;面对角线长度等于4倍的原子半径,所以原子半径为 cm。
[答案] (1)离子 O2-半径小于S2-半径,MnO的晶格能较大
(2)①SnLi2O,分子间力(分子量)P4O6>SO2
②a a
(2)①分子晶体 苯胺分子之间存在氢键 ②O sp3 σ ③(PnO3n+1)(n+2)-
突破物质结构与性质的“三步”思维
(1)审题——正确推断题中元素或物质
有些物质结构与性质题不需要进行元素与物质的推断,题干很简单,往往介绍简单的背景材料,略作了解即可;有些题需进行元素与物质的推断,认真阅读题目所提供信息,根据原子结构、元素周期律知识、物质的性质正确推断题中元素与物质。
(2)析题——认真分析,关注有效信息
①物质结构特点:有些题目常考查物质所含σ键和π键,需正确书写物质的结构式进行分析;单键均为σ键,双键、三键中只有一个为σ键,其余为π键。运用等电子体知识,理解物质中原子的杂化方式和立体结构,以及电子式的书写方法等。
②关注晶胞结构:题目中有关晶体的理解常提供晶胞结构,需认真分析,想象晶体中原子在空间的连接方式,正确确定物质的化学式。
(3)答题——关注细节,规范正确答题
①原子结构的考查,应注意看清是原子的电子排布式、离子的电子排布式、价电子排布式还是电子排布图等。
②第一电离能的考查,特别注意第ⅡA和ⅤA族的特殊性。
③对于物质熔、沸点的高低比较,特别注意不要忽略氢键的问题。
④注意问题表达(因果、对比)及书写规范。
“物质结构与性质”大题中的简答题专练
(对应学生用书第115页)
原子结构与性质
1.(1)Cr的价电子排布式为3d54s1而不是3d44s2的理由是
_____________________________________________________。
(2)P的第一电离能比S的第一电离能大的理由是__________
_____________________________________________________。
(3)若I4表示元素的第四电离能,则I4(Co)________I4(Fe)(填“>”或“<”)。理由是____________________________________
_____________________________________________________。
(4)在高温条件CuO转化为Cu2O的理由是________________
_____________________________________________________。
[答案] (1)3d5为半充满,能量低,稳定
(2)P的3p轨道为3p3,电子半充满,能量低,稳定,难失去电子
(3)< Co、Fe失去3个e-后的价电子排布为3d6、3d53d5为半充满,稳定,难失去电子
(4)Cu2O中+1价Cu的价电子排布为3d10,轨道处于全充满状态,能量低,较稳定
2.烟花燃放过程中,天空呈现五彩缤纷的焰花,其理由是
______________________________________________________
_____________________________________________________。
[答案] 处于激发态的电子跃迁至较低能级的激发态或基态,以光的形式释放能量
3.已知电离能:I2(Ti)=1 310 kJ·mol-1,I2(K)=3 051 kJ·mol-1,I2(Ti)”“<”或“=”)理由是_________________________________
______________________________________________________;
AsH3的沸点低于NH3的原因是___________________________
_____________________________________________________。
[答案] < AsH3中As采用sp3杂化,As有一对孤电子对,孤电子对对成键电子对的斥力大,导致键角小于109°28′ NH3分子间形成氢键而AsH3分子间只有范德华力
16.已知CoCl2的熔点为86 ℃,易溶于水,则CoCl2是______晶体。又知CoO的熔点是1 935 ℃,CoS的熔点是1 135 ℃,试分析CoO的熔点比CoS高的原因是____________________________
_____________________________________________________。
[答案] 分子 两者均为离子晶体,但S2-半径大于O2-半径,CoO的晶格能大于CoS,因此CoO的熔点较高
17.碳化硅(SiC)晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因是__________________________
_____________________________________________________。
[答案] 两种晶体都是原子晶体,原子半径越小,键长越短,键能越大,熔点越高。原子半径:C
查看更多