- 2021-07-05 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年吉林省梅河口市第五中学高二(奥赛班)暑期考试化学试题(Word版)
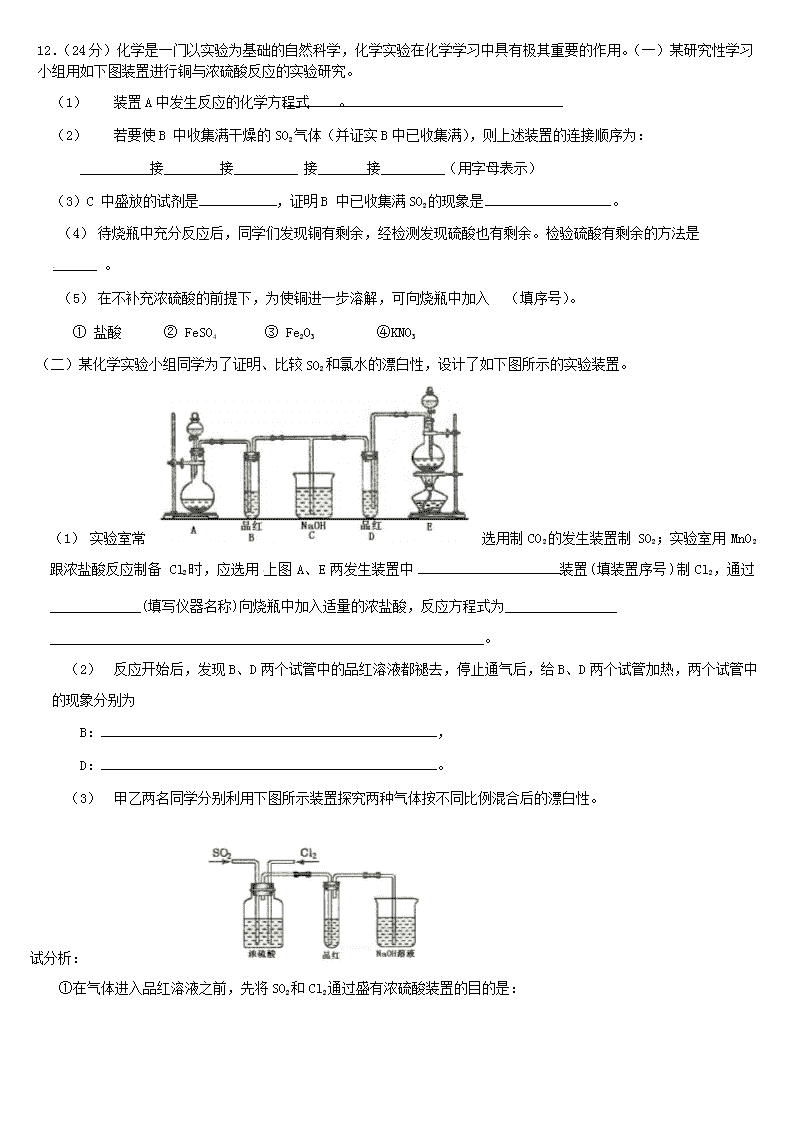
2017-2018学年吉林省梅河口市第五中学高二(奥赛班)暑期考试化学 (测试时间90分钟,共100分)第Ⅰ卷(20分)可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 一、选择题(每小题只有一个选项符合题意,每题2分,共10个小题,共20分) 1.下列叙述正确的是 ① 久置于空气中的氢氧化钠溶液,加硫酸时有气体产生 ② 浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体 ③ SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应 ④ 玻璃、水泥、水晶项链都是硅酸盐制品 ⑤ 蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性 ⑥ 氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质 A. ①④⑤B. ①⑤⑥ C. ②③④ D.④⑤⑥ 2.用氯气消毒的自来水配制下列溶液时,会使配得的溶液变质的是 ①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2 A.只有②④ B.只有④⑤ C.只有②④⑤ D.全部 3.室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是 A.①②③④ B.②④①③ C.④①②③ D.①④③② 4.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是 A.洗气瓶中产生的沉淀中有碳酸钡 B.在Z导管出来的气体中无二氧化碳 C.洗气瓶中产生的沉淀是硫酸钡 D.洗气瓶中无沉淀产生 5.某温度下,将Cl2通入KOH溶液中得KCl、KClO3和KClO的混合溶液。经测定ClO3-和ClO-物质的量之比为2:1,则 反应中被还原的Cl2与被氧化Cl2的的物质的量之比为 A.2:3 B.3:4 C.11:3 D.10:3 6.下列有机物命名正确的是 A. 2-甲基-3-丁炔 B. 1,3,4-三甲苯 C . 2- 甲基 -2- 氯丙烷 D . 2- 甲基 -1- 丙醇 7 . 下列关于 C H C C H 3 C 的说法正确的是 CHCCl3 A.所有原子有可能都在同一平面上 B.最多可能有10个碳原子在同一平面上 C.8个碳原子可能都在同一直线上 D.最多只可能有6个碳原子在同一直线上 COOH 8.邻甲基苯甲酸(CH3 )有多种同分异构体,其中属于酯类,且分子结构中有甲基和苯环的异构体有 A.3种 B. 4种 C. 5种 D. 6种 9.可用于鉴别以下三种化合物的一组试剂是 乙酰水杨酸 丁香酚 肉桂酸 ①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液 A.②与③ B.③与④ C.①与④ D. ①与② 10.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述正确的是 A.迷迭香酸属于芳香烃 B.1mol迷迭香酸最多能和9mol氢气发生加成反应 C.迷迭香酸可以发生水解反应、取代反应和酯化反应[来源:学科网ZXXK] D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 第Ⅱ卷 (80分) 二、非选择题(本题包括4个题,共计80分) 11.(6分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:[来源:学科网] NO3-+4H++3 e-= NO+2H2O KMnO4、Na2CO3、FeO、Al(OH)四种物质中的一种物质(甲)能使上述还原过程发生。 (1) 写出并配平该氧化还原反应的方程式,并标出电子转移的方向和数目。 [来源:Zxxk.Com] (2) 如反应转移了0.6mol e-,则产生的气体在标准状况下体积为_______________L。 (3) 若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。 12.(24分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。(一)某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。 (1) 装置A中发生反应的化学方程式 。 (2) 若要使B 中收集满干燥的SO2气体(并证实B中已收集满),则上述装置的连接顺序为: 接 接 接 接 (用字母表示) (3)C 中盛放的试剂是 ,证明B 中已收集满SO2的现象是 。 (1) 待烧瓶中充分反应后,同学们发现铜有剩余,经检测发现硫酸也有剩余。检验硫酸有剩余的方法是 。 (2) 在不补充浓硫酸的前提下,为使铜进一步溶解,可向烧瓶中加入 (填序号)。 ① 盐酸 ② FeSO4 ③ Fe2O3 ④KNO3 (二) 某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。 ( 1 ) 实验室常 选用制 CO 2 的发生装置制 SO 2 ;实验室用 MnO 2 跟浓盐酸反应制备 Cl 2 时,应选用 上图 A 、 E 两发生装置中 装置 ( 填装置序号 ) 制 Cl 2 ,通过 _____________(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应方程式为________________ ______________________________________________________________。[来源:Z#xx#k.Com] (2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为 B: , D: 。 (3) 甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。 试分析: ①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: ___________________________________________________________________________________________________ ______________________。 ②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:[来源:Zxxk.Com] (结合反应方程式 ) 。 (二) 某小组同学设计右图装置测量SO2、N2、O2混合气体中SO2含量;反应管中装有碘的淀粉溶液。SO2和I2能反应,N2、O2不与I2反应。 (1) 气体进入反应管后,量气管内增加的水的体积等于 ______________________的体积(填写气体的分子式)。 (2) 反应管内的碘的淀粉溶液也可以用 。 A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4 C.双氧水、稀硫酸 D.氨水、酚酞试液 (3) 若碘溶液体积为VamL,浓度为 cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用c、Va、Vb 表示SO2的体积百分含量为。 13.无机推断(24分) (一)下图所示反应I、反应II和反应III均是工业生产中常见的反应。其中A、B为化合物,C是温室气体之一,D 和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同。 A C D M B E F G H J K H H/ 电解 反应 II 反应 I 反应 III 高温 (1) C的电子式是 。 (2) 反应II的离子方程式是 。 (3)J 久置后,即便不接触水、空气,本身也逐渐分解生成 K,并放出气体,该反应的化学方程式是 。 (4)工业上测定反应III产品的有效成分J的含量,先将一定量产品的溶液中加入过量的KI溶液和稀硫酸,使之反应生成I2,然后用标准Na2S2O3溶液滴定I2,计算出结果。 ① 用Na2S2O3标准溶液滴定I2时选用的指示剂是 。 ② 生成I2的反应的离子方程式是。 (5)已知:2Fe2+ + Br2=2Fe3+ +2Br-。若将0.1 mol E通入100 mL FeBr2溶液中,溶液中有三分之一的Br-被氧化成 Br2,则此反应离子方程式是 ,原 FeBr 2 溶液的物质的量浓度为 mol/L。(二)下图中A~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体,且A是一种不含金属元素的盐,受热分解能得到三种物质的量相等......的产物, A加热后生成的气体混合物若通过碱石灰,只剩余气体B(B为无色有刺激性气味的气体),若通过浓硫酸则只剩余气体D(D为无色无味气体); C为淡黄色固体。各物质间的转化关系如下图所示: A 混 合 气 体 △ B C D 浓硫酸 碱石灰 E F H 点燃 催化剂 G △ I E G H N △ K G I D + E 请回答下列问题: (1) 写出C的电子式 。 (2) 写出固体A的溶液与足量NaOH溶液反应的离子方程式 。 (3) 写出实验室制取B的化学方程式 。[来源:学.科.网] (4) 写出N与K反应方程式 。 (5) 火星探测车在火星大气中检测到了气体M。资料显示,M分子是三原子分子,其相对分子质量为60,在地球环境下M易分解。粉末状的KSCN与浓硫酸在一定条件下可得到气体M和两种硫酸氢盐,生成物的物质的量之比是 1∶1∶1。则气体M的结构式是 。 14.有机题(26分) (一)根据下面的反应路线及所给信息填空。 Cl 2 ,光照 ① NaOH ,乙醇 △ , ② Br 2 的 CCl 4 溶液 ③ B ④ , B 的名称是 。 , ③ 的反应类型是 。 ( 3 )反应 ④ 的化学方程式是 。 ( 二 )碳碳双键有如下的断裂方式: Cl A (1) A的结构简式是 (2) ①的反应类型是 高分子单体A(C6H10O3)可进行如下反应(反应框图): 对框图中某些化合物性质说明: 室温下A不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na作用放出 H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na作用放出H2。 (1)写出A、D、E的结构简式。 A: D: E: (2)B 在浓 H2SO4 存在下与甲醇反应的产物能在一定条件下聚合,写出这个聚合物的结构简式: 。 (( 3 )写出 F → G 的化学反应方程式: 。 (注: R,R ’ 为烃基) 三)已知 A(分子式为C4H8O2)为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其 中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。 试回答: (1) 写出符合下述条件A的同分异构体结构简式(各任写一种): a.具有酸性______________________b.能发生水解反应______________________ (1) A分子中的官能团是_____________,D的结构简式是_____________。 (2) C→D的反应类型是___________,E→F的反应类型是___________ a.氧化反应 b.还原反应 c.加成反应 d.取代反应[来源:Zxxk.Com] (3) 写出A与银氨溶液反应的化学方程式: ________________________________________________________________________________。 (4) 写出C生成高聚物的化学方程式: 参考答案 1.B 2.D 3.B 4.C 5.C 6.C 7.D 8.C 9.10.C 11.(8分)(1)10HNO3+3FeO=3Fe(NO3)3+2NO↑+5H2O(2分) 电子转移(1分)略 (2)酸性 氧化性(2分) (3)4.48L(2分) (4)使用了较浓的硝酸,产物中有部分二氧化氮生成(1分) 12.(24分) (一) 10分()[来源:学科网] (二) 10分 (1) E 分液漏斗 ………MnO2+4HCl=………………………………………(4分) (2) B:溶液由无色变成红色 D: 溶液没有明显的变化 …………………(2分) (3) ① 使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比例混 合。……………………………………………………………………………………(2分) ②SO2和Cl2按1:1进气,二者恰好完全反应,生成无漂白性的H2SO4和HCl… SO2+Cl2 +2H2O===4H++SO42- +2Cl- ………………………………………(2分) (二) (1) (2分) (2) NH4++HCO3-+2OH-= (2分) (3) Ca(OH)2 + 2NH4Cl CaCl2 + 2H2O + 2NH3↑ (2分) (4) C+4HNO3 △ 4NO2 ↑+ CO2 ↑+2H2O (2分) (2) S=C=O(2分) — Br — Br 14.(一)(1) 1,2-二溴环已烷 (2)取代反应 加成反应 (3) + 2NaOH 乙醇 △ +2NaBr + 2H2O (二) (1) (3) [来源:学科网] (4) (三) (1)a、CH3CH2CH2COOH b、CH3CH2COOCH3 (2) 羟基、醛基CH3COCH2COOH (3) a; b、c (4) CH3CHOHCH2CHO+2Ag(NH3)3 = (5) n CH3CHOHCH2COOH查看更多