2019届二轮复习元素周期律作业(全国通用)
元素周期律
1、短周期主族元素X、Y、Z、W、R的原子序数依次增大,X-的电子层结构与氦相同,Y是地壳中含量最多的元素,Y2-和Z+的电子层结构相同,W的最高化合价为最低化合价绝对值的3倍,W与R同周期,R的原子半径小于W。下列说法不正确的是( )
A.元素的非金属性次序为R>W>X
B.Z和其他四种元素均能形成离子化合物
C.离子半径:W2->Y2->Z+
D.氧化物对应的水化物的酸性:W
HClO2>HClO3>HClO4
3、最近医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的叙述正确的是( )
A.14C与C60中普通碳原子的化学性质不同
B.14C与12C互为同位素
C.14C是C60的同素异形体
D.14C与14N含的中子数相同
4、下列解释中,不正确的是( )
A.水在结冰时体积膨胀,是由于水分子中存在分子间氢键
B.水很稳定1000℃以上才会部分分解是因为水中含有大量的氢键所致
C.MgO的熔点比MgCl2高主要是因为MgO的晶格能比MgCl2大
D.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
5、几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是( )
A.X、Y元素的金属性XW
B.Y、Z、W的最高价氧化物对应水化物之间能两两反应
C.原子半径:Y>Z>W>X
D.工业上获得Y、Z单质的主要方法是电解其熔融的氯化物
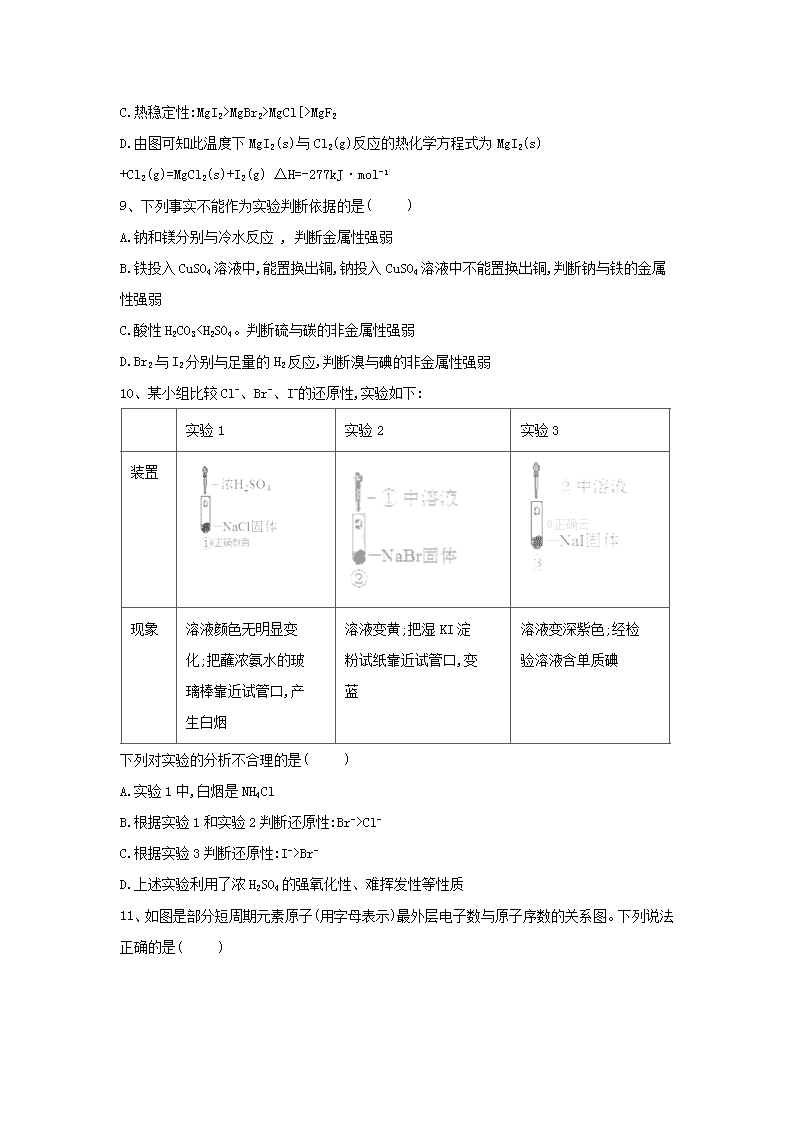
8、如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
A.卤素单质(X2)与水反应均可生成两种酸
B.用电子式表示的形成过程:
C.热稳定性:MgI2>MgBr2>MgCl[>MgF2
D.由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为MgI2(s) +Cl2(g)=MgCl2(s)+I2(g) ΔH=-277kJ·mol-1
9、下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应 , 判断金属性强弱
B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属性强弱
C.酸性H2CO3Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
11、如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:X>Y
D.X、Z形成的化合物中可能含有共价键
12、下图为元素周期表截取的短周期的一部分,即
四种元素均不是稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值一定不相等
D.Z的最高价氧化物的水化物可能为弱酸
答案以及解析
1答案及解析:
答案:D
解析:根据题意可知, X为H,Y为O,Z为Na,W为S,R为Cl。Cl、S、H的非金属性依次减弱,A正确;Na和H、O、S、Cl均能形成离子化合物,如NaH、NaCl等,B正确;离子结构相同时,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,则离子半径S2->O2->Na+,C正确;酸性H2SO4> HCIO,应是最高价氧化物对应的水化物的酸性HClO4>H2SO4,D错误。
2答案及解析:
答案:B
3答案及解析:
答案:B
解析:A.14C与C60中普通碳原子,为同种元素的碳原子,则碳原子的化学性质相同,故A错误;
B.14C与12C的质子数均为6,中子数分别为8、6不同,互为同位素,故B正确;
C.14C是原子,不是单质,与C60单质不是同素异形体,故C错误;
D.14C的中子数为14﹣6=8,14N的中子数为14﹣7=7,二者不同,故D错误;故选B。
4答案及解析:
答案:B
5答案及解析:
答案:D
解析:根据题表中信息可推知,W是O,Z是N,Y是Al,X是Mg。A项,金属性:X>Y。B项,一定条件下,N2和O2直接化合只能生成NO。C项,Al(OH)3溶于稀氨水。D项,NH3在纯氧中点燃可生点燃成N2:4NH3+3O22N2+6H2O。故选D。
6答案及解析:
答案:D
解析:
A项,HF分子间存在氢键,沸点:HF>HI>HCl,错误;B项,Na+、Mg2+、Al3+电子层结构相同,电子层结构相同的粒子,核电荷数越大,离子半径越小,错误;C项,亚硫酸不是硫的最高价氧化物对应的水化物,错误;D项,非金属性:Cl>S>P,还原性:Cl-<S2-<P3-,正确.
7答案及解析:
答案:D
解析:X的一种单质具有杀菌、消毒能力,X 是O;Y单质与X单质在不同条件下反应会生成两种不同化合物,Y是Na;Z简单离子半径是同周期元素简单离子中最小的,Z是Al;W原子最外层电子数是其电子层数的2倍,W是S。O的非金属性强于S,则气态氢化物的稳定性X>W,A正确:NaOH、Al(OH)3和硫酸,它们之间能两两反应正确;同主族从上到下,原子半径逐渐增大,同周期自左向右,原子半径逐渐减小,则原子半径Y>Z>W>X,C正确;工业上获得Na、Al单质的主要方法是电解熔融的NaCl和Al2O3,AlCl3是共价化合物,熔融时不导电,D错误;
8答案及解析:
答案:D
解析:A.氟气与水反应方程式:2F2+2H2O=4HF+O2,不符合X2+H2O═HXO+HX,故A错误;
B.用电子式表示MgF2的形成过程为:,故B错误;
C.物质的能量越低越稳定,易图象数据分析,化合物的热稳定性顺序为:MgI2Cl>O,错误;C选项,非金属性越强,气态氢化物越稳定,HF>H2O,错误;D选项,X、Z形成的Na2O2含有共价键,正确。
12答案及解析:
答案:D