- 2021-07-05 发布 |
- 37.5 KB |
- 24页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版化学反应与能量变化学案(1)
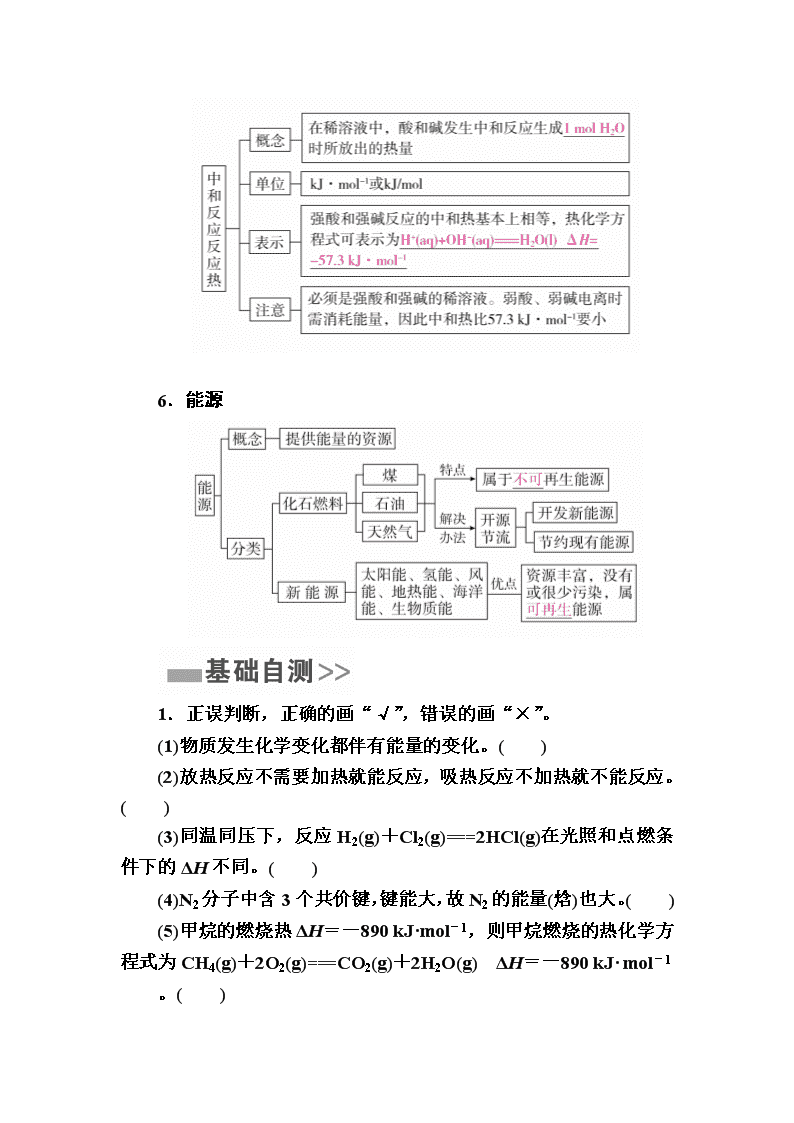
第六章 化学能与热能 第21讲 化学反应与能量变化 1.化学反应的实质与特征 (1)实质:反应物中化学键断裂和生成物中化学键形成。 (2)特征:既有物质变化,又伴有能量变化;能量转化主要表现为热量的变化,也有光能和电能等。 2.焓变和反应热 (1)反应热:化学反应中吸收或放出的热量。 (2)焓变:生成物与反应物的内能差,ΔH=H(生成物)-H(反应物)。在恒压条件下化学反应的热效应,其符号为ΔH,单位是kJ·mol-1或kJ/mol。 3.吸热反应与放热反应 (1)从能量守恒的角度理解 ΔH=生成物的总能量-反应物的总能量。 (2)从化学键变化角度理解 ΔH=反应物的总键能-生成物的总键能。 (3)常见的放热反应和吸热反应 ①放热反应:大多数化合反应、中和反应、金属与酸的反应、所有的燃烧反应。 ②吸热反应:大多数分解反应、盐的水解反应、Ba(OH)2·8H2O和NH4Cl反应、C与H2O(g)反应、C与CO2反应。 4.燃烧热 5.中和热 6.能源 1.正误判断,正确的画“√”,错误的画“×”。 (1)物质发生化学变化都伴有能量的变化。( ) (2)放热反应不需要加热就能反应,吸热反应不加热就不能反应。( ) (3)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同。( ) (4)N2分子中含3个共价键,键能大,故N2的能量(焓)也大。( ) (5)甲烷的燃烧热ΔH=-890 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890 kJ· mol-1 。( ) (6)S(s)+O2(g)===SO3(g) ΔH=-315 kJ·mol-1(燃烧热)(ΔH的数值正确)。( ) 答案 (1)√ (2)× (3)× (4)× (5)× (6)× 2.教材改编题 (据人教必修二P37 T6)下列有关能量的说法中,正确的是( ) A.化学反应中的能量变化主要是由电子转移引起的 B.化学反应必然伴随发生能量变化 C.化学反应中能量变化的大小与反应物的状态无关 D.化学反应中能量变化的大小与反应物的多少无关 答案 B 考点1 焓变、反应热 典例1 (北京高考)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法正确的是( ) A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 解析 A项,状态Ⅰ总能量为反应物总能量,状态Ⅲ总能量为生成物总能量,由图示知反应物的总能量大于生成物的总能量,该反应为放热反应;B项,从状态Ⅰ、Ⅱ、Ⅲ的图示可以看出,反应中CO并未断裂成C和O,C、O原子间一直有化学键;C 项,由图示可以看出,CO和O生成了CO2,CO2分子中C与O形成极性共价键;D项,状态Ⅰ→状态Ⅲ表示CO与O反应生成CO2的过程,并不是CO与O2的反应过程。 答案 C 名师精讲 解答能量变化图像题的“三”关键 (1)注意活化能在图示中的意义。 ①从反应物至最高点的能量数值表示正反应的活化能(E1); ②从最高点至生成物的能量数值表示逆反应的活化能(E2); ③ΔH=E1-E2。 (2)催化剂只影响正、逆反应的活化能,而不影响反应的焓变。 (3)涉及反应热的有关计算时,要特别注意图示中反应物和生成物的物质的量。 1.下图表示某反应的能量变化,对于该图的理解正确的是( ) A.曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 B.曲线 Ⅱ 可表示反应2NH3N2+3H2的能量变化 C.该反应不需要加热就能发生 D.该反应的ΔH=E2-E1 答案 D 解析 图中曲线Ⅰ和曲线Ⅱ的始态、终态相同,表示同一个化学反应的能量变化,A错误;反应物的能量大于生成物的能量,该反应是放热反应,NH3的分解反应是吸热反应,B错误;放热反应是指在反应过程中放出热量,并不表示反应不需要加热,C错误;D正确。 2.某反应使用催化剂后,其反应过程中能量变化如图。 下列说法错误的是( ) A.总反应为放热反应 B.使用催化剂后,活化能不变 C.反应①是吸热反应,反应②是放热反应 D.ΔH=ΔH1+ΔH2 答案 B 解析 由题图可知,反应①是吸热反应,反应②是放热反应,总反应是放热反应,且ΔH=ΔH1+ΔH2,A、C、D项正确;使用催化剂能降低反应所需的活化能,B项错误。 考点2 中和热及测定 典例2 现利用如图装置进行中和热的测定,请回答下列问题: (1)该图中有两处未画出,它们是__________、__________。 (2)把温度为15.0 ℃,浓度为0.5 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如 下: ①试计算上述两组实验测出的中和热ΔH1=__________,ΔH2=__________。 ②两组实验结果差异的原因是_________________________。 ③写出HCl+NH3·H2O的热化学方程式:_____________。 解析 (2)①根据题目给出的酸、碱的物质的量,酸为0.025 mol,碱为0.0275 mol,碱是过量的,应根据酸的量进行计算,即反应生成了0.025 mol H2O。根据实验数据算出生成1 mol H2O所放出的热量,即得出两组实验测出的中和热数值:ΔH1=-[4.18×(50+50)×(18.4-15.0)×10-3]÷0.025 kJ·mol-1≈-56.8 kJ·mol-1,ΔH2=-[4.18×(50+50)×(18.1-15.0)×10-3]÷0.025 kJ·mol-1≈-51.8 kJ·mol-1。 答案 (1)环形玻璃搅拌棒 烧杯上方的泡沫塑料盖 (2)①-56.8 kJ·mol-1 -51.8 kJ·mol-1 ②NH3·H2O是弱碱,在中和过程中NH3·H2O发生电离,要吸热,因而总体放热较少 ③HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l) ΔH=-51.8 kJ·mol-1 名师精讲 中和热的测定 1.测定原理 ΔH=- c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1;n为生成H2O的物质的量。稀溶液的密度用1 g·mL-1进行计算。 2.注意事项 (1)碎泡沫塑料(或纸条)及泡沫塑料板的作用是保温、隔热,减少热量损失。 (2)为保证酸、碱完全中和,常采用碱稍稍过量(0.5 mol·L-1 HCl、0.55 mol·L-1 NaOH溶液等体积混合)。 (3)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是铜丝导热性好,比用环形玻璃搅拌棒误差大。 3.问题设计 (1)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。 已知盐酸、NaOH溶液密度近似为1.00 g·mL-1,中和后混合液的比热容c=4.18×10-3kJ·g-1·℃-1,则该反应的中和热ΔH=-55.176 kJ·mol-1。 (2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小,其原因是醋酸电离要吸热。 (3)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热偏小。 3.为了测量某酸碱反应生成1 mol水时的反应热,如下数据在计算时至少需要的数据有( ) ①酸的浓度 ②碱体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度变化 ⑦操作所需的时间 A.①②③④ B.①③④⑤ C.③④⑤⑥ D.全部 答案 C 解析 测定中和热的原理为Q=c·m·Δt,ΔH=- ,故需要的数据有比热容、反应后溶液的质量、反应前后温度变化、生成水的物质的量,C项正确。 4.某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。测定中和热的实验装置如下图所示。 (1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):______________________。 (2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。 ①请填写下表中的空白: ②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,则中和热ΔH=________(取小数点后一位)。 ③上述实验结果的数值与57.3 kJ·mol-1有偏差,产生偏差的原因可能是________(填字母)。 a.实验装置保温、隔热效果差 b.在量取NaOH溶液的体积时仰视读数 c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中 d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 答案(1)H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 (2)①4.0 ②-53.5 kJ·mol-1 ③acd 解析 (2)1、2、3、4次实验的温度差分别为4.0 ℃、6.1 ℃、3.9 ℃、4.1 ℃,与其他三组数据相比,6.1 ℃误差较大,应舍去,其余三次温度差的平均值为4.0 ℃。0.50 mol·L-1 H2SO4(aq)和0.50 mol·L-1 NaOH(aq)的密度为1 g·cm-3,故m(H2SO4)=ρ(H2SO4)·V(H2SO4)=1 g·mL-1×30 mL=30 g,m(NaOH)=ρ(NaOH)·V(NaOH)=1 g·mL-1×50 mL=50 g。中和后生成的溶液为稀溶液,其比热容c=4.18 J·g-1·℃-1,由此可以计算出30 mL H2SO4(aq)和50 mL NaOH(aq)发生反应时放出的热量Q放=[m(NaOH)+m(H2SO4)]·c·(T2-T1),中和热为生成1 mol H2O(l)时放出的热量,ΔH=-=-×10-3 kJ·mol-1≈-53.5 kJ·mol-1。 考点3 燃烧热 典例3 一些烷烃的标准燃烧热如下表: 下列说法正确的是( ) A.热稳定性:正丁烷>异丁烷 B.正戊烷的标准燃烧热大约为ΔH=-3540 kJ·mol-1 C.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1 D.在101 kPa下,甲烷的热值是891.0 kJ·g-1 解析 由表格中的数据可知,异丁烷燃烧放出热量比正丁烷小,则异丁烷的能量低,即热稳定性:正丁烷<异丁烷,A错误;正戊烷和2甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,互为同分异构体的化合物,支链多的燃烧放出热量小,则正戊烷燃烧放出热量大于2甲基丁烷,B正确;根据乙烷燃烧热的含义:完全燃烧1 mol乙烷生成二氧化碳和液态水时会放出 1560.8 kJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-3121.6 kJ·mol-1,C错误;燃料的热值是指一定条件下单位质量的物质完全燃烧所放出的热量,在101 kPa下,甲烷的热值是×891.0 kJ·g-1,D错误。 答案 B 名师精讲 理解燃烧热概念四要素 (1)压强→101 kPa; (2)可燃物物质的量→1 mol; (3)完全燃烧; (4)产物→元素完全燃烧对应的稳定氧化物。 例:C—CO2(g) H—H2O(l) S—SO2(g)等。 5.已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出b kJ热量,则表示乙炔燃烧热的热化学方程式正确的是( ) A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g) ΔH=-2b kJ·mol-1 B.C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1 C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1 D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=b kJ·mol-1 答案 B 解析 由题意知2 mol CO2~2b kJ~1 mol C2H2,则表示乙炔燃烧热的热化学方程式为:C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1,故答案为B。 6.下列热化学方程式正确的是( ) A.表示硫的燃烧热的热化学方程式:S(s)+O2(g)===SO3(g) ΔH=-315 kJ·mol-1 B.表示中和热的热化学方程式:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 C.表示H2燃烧热的热化学方程式:H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1 D.表示CO燃烧热的热化学方程式:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 答案 B 解析 表示燃烧热的热化学方程式,可燃物质的物质的量为1 mol,反应生成稳定氧化物,A中应生成SO2;C中应生成H2O(l),D中CO的物质的量应为1 mol。 考点4 能源 典例4 (2016·天津高考)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题: (1)与汽油相比,氢气作为燃料的优点是____________________________________________(至少答出两点)。 (2)氢气可用于制备H2O2。已知: H2(g)+A(l)===B(l) ΔH1 O2(g)+B(l)===A(l)+H2O2(l) ΔH2 其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)===H2O2(l)的ΔH________0(填“>”“<”或“=”)。 (3)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为________。 解析 (2)题目中的两个反应都是熵减的反应,由于两个反应均能自发进行,所以两个反应都是放热反应,即ΔH1<0,ΔH2<0,根据盖斯定律,将题目中两个方程式相加得:H2(g)+O2(g)===H2O2(l) ΔH=ΔH1+ΔH2<0。 答案 (1)污染小、可再生、来源广、资源丰富、燃烧热值高(任写其中两个) (2)< (3)光能转化为化学能 名师精讲 能源使用效率的提高方式 科学控制燃烧反应,使燃料充分燃烧。一是保证燃烧时有适当过量的空气,如鼓入空气、增大O2浓度等。二是保证燃料与空气有足够大的接触面积,如将固体粉碎成粉末,使液体喷成雾状等。 7.未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生。下列能源符合未来新能源标准的是( ) ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ 答案 B 解析 ①天然气、②煤、④石油属于三大化石燃料,不可再生;③核能对环境会产生污染。 8.下列说法不正确的是( ) A.煤、石油、天然气均为化石燃料,它们属于可再生能源 B.生物质能来源于植物及其加工产品所贮存的能量 C.氢气的燃烧产物是水,不会污染环境,是理想的清洁燃料 D.大自然利用太阳能最成功的是植物的光合作用 答案 A 解析 化石燃料包括煤、石油和天然气,是由远古时代的动植物转化而来,属于不可再生能源,故A错误。 (建议用时:40分钟) 一、选择题(每题6分,共66分) 1.伴随下列变化而发生的能量变化中,属于反应热的是( ) A.形成1 mol H—Cl键放出的能量 B.石墨转化成金刚石吸收的能量 C.Na变成Na+吸收的能量 D.水蒸气变成液态水放出的能量 答案 B 解析 反应热是化学反应放出或吸收的热量。 2.下列物质间的反应,其能量变化符合右图的是( ) A.由Zn和稀硫酸制氢气 B.灼热的炭粉与二氧化碳反应 C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.碳酸钙的分解 答案 A 解析 该图示为放热反应能量图,A正确。 3.在一定温度时,N2与H2反应过程中能量变化的曲线如下图,下列叙述正确的是( ) A.该反应的热化学方程式为N2+3H2===2NH3 ΔH=-92 kJ·mol-1 B.a曲线是加入催化剂时的能量变化曲线 C.加入催化剂,该化学反应的放热减少 D.反应物的总能量高于生成物的总能量 答案 D 解析 热化学方程式要注明物质的聚集状态 ,A错误;a曲线是未加催化剂时的能量变化曲线,B错误;催化剂不影响反应热的大小,C错误;由图中看出反应物的总能量高于生成物的总能量,D正确。 4.已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol ②稀溶液,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol 下列结论正确的是( ) A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 答案 A 解析 ①反应没有生成稳定氧化物,因此碳的燃烧热比此处反应热的绝对值大,故A正确;①的反应热为-221 kJ/mol,故B错误;已知中和反应为放热反应,则叙述中和热时不用“-”,即稀硫酸与稀 NaOH溶液反应的中和热为57.3 kJ/mol,故C错误;醋酸为弱电解质,电离过程为吸热过程,则稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ,故D错误。 5.已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是( ) A.X的能量一定低于M的能量,Y的能量一定低于N的能量 B.因为该反应为吸热反应,故一定要加热反应才能进行 C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 D.X和Y的总能量一定低于M和N的总能量 答案 D 解析 已知X+Y===M+N ΔH>0,说明X与Y总能量低于M与N总能量,A错误,D正确;破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,C错误;吸热反应有的不需要加热也可反应,如氢氧化钡晶体与氯化铵混合搅拌即可发生反应,B错误。 6.下列说法不正确的是( ) A.CO2、甲烷都属于温室气体 B.用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体 C.太阳能、风能和生物质能属于新能源 D.太阳能电池可将太阳能直接转化为电能 答案 B 解析 乙醇作燃料产生CO2气体,会引起温室效应,B项错误。 7.根据如图所给信息,得出的结论正确的是( ) A.48 g碳完全燃烧放出的热量为1574 kJ/mol B.2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol C.2CO2(g)===2CO(g)+O2(g) ΔH=+283.0 kJ/mol D.C(s)+O2(g)===CO2(s) ΔH=-393.5 kJ/mol 答案 B 解析 48 g碳完全燃烧生成二氧化碳气体,放出的热量为1574 kJ,A项错误;根据图像可知,C(s)+O2(g)===CO(g) ΔH= -110.5 kJ/mol,故2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol,B项正确;根据图像可知,CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ/mol,故2CO2(g)===2CO(g)+O2(g) ΔH=+566.0 kJ/mol,C项错误;根据图像可知,C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol,D项错误。 8.下列图像分别表示有关反应的反应过程与能量变化的关系 据此判断下列说法正确的是( ) A.白磷比红磷稳定 B.石墨转变为金刚石是吸热反应 C.S(g)+O2(g)===SO2(g) ΔH1,S(s)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2 D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0 答案 B 解析 A项,由题给图像知,白磷具有的能量比红磷高,物质具有的能量越低越稳定,红磷比白磷稳定,错误;B项,由题给图像知,金刚石具有的能量比石墨高,则石墨转变为金刚石是吸热反应,正确;C项,由题给图像知,S(g)燃烧放出的热量比S(s)燃烧放出的热量多,则ΔH1<ΔH2,错误;D项,由题给图像知,CO(g)+H2O(g)===CO2(g)+H2(g)为放热反应,ΔH<0,错误。 9.下列关于热化学反应的描述中正确的是( ) A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4和Ba(OH)2稀溶液反应生成2 mol H2O的反应热ΔH= 2×(-57.3) kJ·mol-1 B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+ O2(g) ΔH=+571.6 kJ·mol-1 D.葡萄糖的燃烧热是2800 kJ·mol-1,则C6H12O6(s)+ 3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 答案 D 解析 稀H2SO4和Ba(OH)2稀溶液反应时还生成了BaSO4沉淀,故反应热还应包括BaSO4沉淀的生成热,A错;甲醇蒸气的燃烧热是1 mol CH3OH(g)完全燃烧生成液态水和二氧化碳所放出的热量,该方程式中生成的是H2,而不是液态水,B错;若ΔH=+571.6 kJ·mol-1,则热化学方程式中的水应该为液态,C错;葡萄糖的燃烧热是2800 kJ·mol-1,故C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1,D正确。 10.(2017·广西重点高中模拟)如图为1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的能量变化示意图,已知E1=x kJ·mol-1、 E2=y kJ·mol-1,下列有关说法中正确的是( ) A.若在反应体系中加入催化剂,E1不变 B.若在反应体系中加入催化剂,ΔH减小 C.反应活化能等于y kJ·mol-1 D.1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的ΔH=(x-y) kJ·mol-1 答案 D 解析 观察图像,E1 为反应的活化能,加入催化剂反应的活化能降低,但是ΔH不变;1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的反应热数值为反应物和生成物的能量差,即ΔH=(x-y) kJ·mol-1,故选D。 11.下列说法正确的是( ) A.已知C2H6的燃烧热为1090 kJ·mol-1,则C2H6燃烧的热化学 方程式为C2H6(g)+3.5O2(g)===2CO2(g)+3H2O(g) ΔH=-1090 kJ·mol-1 B.已知2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热 ΔH=-283 kJ C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后最高温度 D.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 答案 C 解析 A项,燃烧热指1 mol可燃物完全燃烧所放出的热量,完全燃烧指C生成CO2,H元素生成液态水,正确的为C2H6(g)+3.5O2(g)===2CO2(g)+3H2O(l) ΔH=-1090 kJ·mol-1,错误;B项,CO的燃烧热为283 kJ·mol-1,错误;C项,测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后最高温度,正确;D项,醋酸为弱电解质,在电离时吸收热量,所以稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出的热量小于57.3 kJ,错误。 二、非选择题(共34分) 12.(16分) 已知某反应A(g)+B(g)??C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。 (1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。 (2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)。 答案 (1)吸热 E1-E2 一定低 (2)减小 减小 不变 解析 (2)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变。 13.(18分)二氧化碳的回收利用是环保领域研究的热点课题。 (1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为 ____________________________________________________。 (2)CO2经过催化氢化合成低碳烯烃。其合成乙烯的反应为2CO2(g)+6H2(g)??CH2===CH2(g)+4H2O(g) ΔH。几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示: 物质 H2(g) CO2(g) CH2===CH2(g) H2O(g) 能量/(kJ·mol-1) 0 -394 52 -242 则ΔH=______________。 答案 (1)CO2C+O2 (2)-128 kJ·mol-1 解析 (1)在700 K条件下,CO2和FeO反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,Fe3O4是中间产物,总反应的化学方程式为CO2C+O2。 (2)焓变等于生成物总能量减去反应物总能量,所以ΔH=(52-242×4+394×2-0) kJ·mol-1=-128 kJ·mol-1。查看更多