- 2021-07-05 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习同步练习:第3章 第10讲 金属材料及金属矿物的开发利用
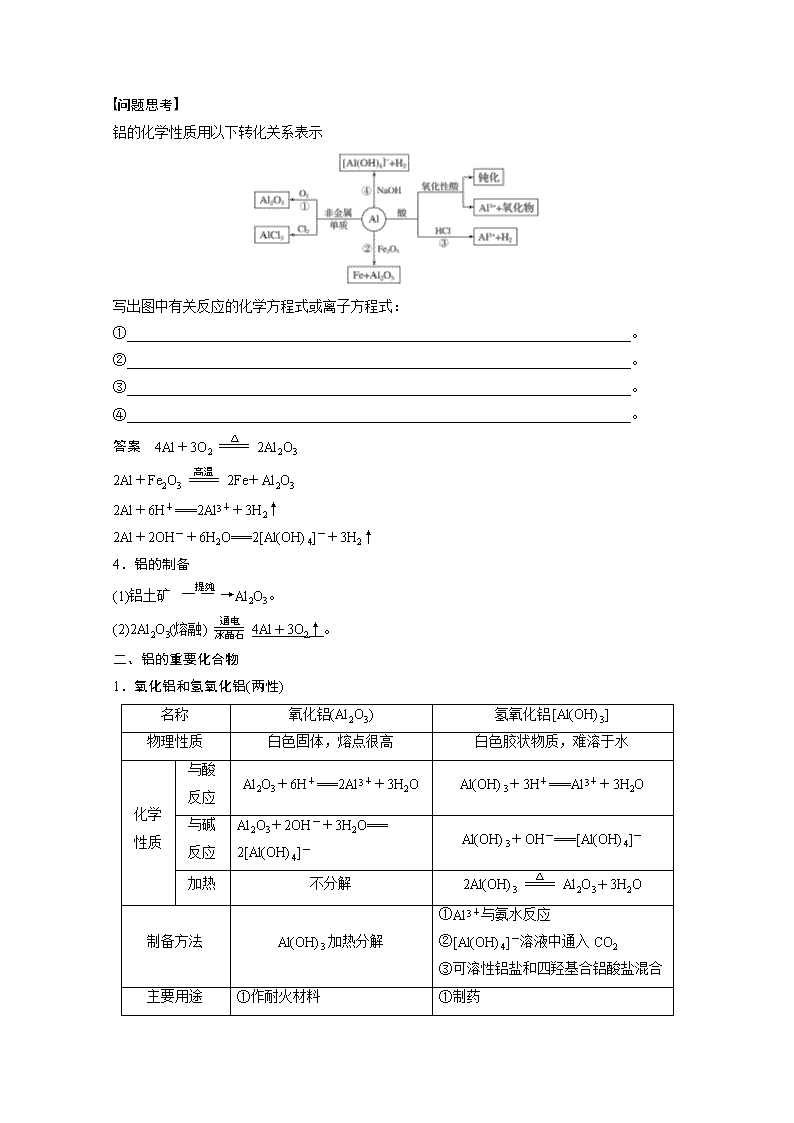
第 10 讲 金属材料及金属矿物的开发利用 目标要求 1.结合真实情景中的应用实例或通过实验探究,了解金属材料及其重要化合物的 主要性质,了解其在生产、生活中的应用。2.结合实例认识金属性质的多样性,了解通过化学 反应可以探索物质性质、实现物质的转化,认识物质及其转化在自然资源综合利用和环境保 护中的重要作用。 一、镁、铝单质的性质 1.镁、铝的结构和存在 镁、铝分别位于元素周期表的第 3 周期ⅡA 族和ⅢA 族,原子结构示意图为 和 , 它们都是活泼的金属,在自然界中全部以化合态的形式存在。铝是地壳中含量最多的金属元 素。 2.金属铝的物理性质 银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。铝 的熔点比镁高,硬度比镁大。 3.对比掌握镁、铝的化学性质 铝 镁 与非金 属反应 能被 Cl2、O2 氧化 2Mg+O2 =====点燃 2MgO 3Mg+N2 =====点燃 Mg3N2 与水反应 反应很困难 能与沸水反应 Mg+2H2O =====△ Mg(OH)2+H2↑ 与酸(H+) 反应 能与 H+反应产生 H2 反应速度比 Al 快 Mg+2H+===Mg2++H2↑ 与碱反应 能溶于强碱溶液产生 H2 不反应 与某些氧 化物反应 能与 Fe2O3、MnO2、Cr2O3 等金 属氧化物发生铝热反应 能在 CO2 中燃烧: 2Mg+CO2 =====点燃 2MgO+C 问题思考 铝的化学性质用以下转化关系表示 写出图中有关反应的化学方程式或离子方程式: ①________________________________________________________________________。 ②________________________________________________________________________。 ③________________________________________________________________________。 ④________________________________________________________________________。 答案 4Al+3O2 =====△ 2Al2O3 2Al+Fe2O3 =====高温 2Fe+Al2O3 2Al+6H+===2Al3++3H2↑ 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑ 4.铝的制备 (1)铝土矿 ― ― →提纯 Al2O3。 (2)2Al2O3(熔融) =====通电 冰晶石 4Al+3O2↑。 二、铝的重要化合物 1.氧化铝和氢氧化铝(两性) 名称 氧化铝(Al2O3) 氢氧化铝[Al(OH)3] 物理性质 白色固体,熔点很高 白色胶状物质,难溶于水 与酸 反应 Al2O3+6H+===2Al3++3H2O Al(OH)3+3H+===Al3++3H2O 与碱 反应 Al2O3+2OH-+3H2O=== 2[Al(OH)4]- Al(OH)3+OH-===[Al(OH)4]- 化学 性质 加热 不分解 2Al(OH)3 =====△ Al2O3+3H2O 制备方法 Al(OH)3 加热分解 ①Al3+与氨水反应 ②[Al(OH)4]-溶液中通入 CO2 ③可溶性铝盐和四羟基合铝酸盐混合 主要用途 ①作耐火材料 ①制药 ②冶炼铝的原料 ②净水作用 氢氧化铝的电离: 酸式电离:Al(OH)3+H2O[Al(OH)4]-+H+; 碱式电离:Al(OH)3Al3++3OH-。 2.常见的铝盐——明矾 (1)明矾的化学式为 KAl(SO4)2·12H2O,属于复盐。 (2)明矾净水的原理 明矾溶于水时发生电离,电离方程式为 KAl(SO4)2===K++Al3++2SO2-4 ,其中 Al3+发生水解 反应,产生 Al(OH)3(胶体),其吸附能力很强,可以吸附水中的杂质并形成沉淀,使水澄清。 问题思考 (1)铝与氢氧化钠溶液反应时,反应机理是怎样的?请用双线桥法标出该反应电子转移的方向 与数目。 答 案 铝 先 与 强 碱 溶 液 中 的 水 反 应 生 成 H2 和 Al(OH)3 , Al(OH)3 可 溶 于 NaOH 生 成 Na[Al(OH)4]和 H2O,反应中 Al 为还原剂,水为氧化剂。 (2)中学化学学习阶段接触到许多既能与酸反应又能与碱反应的物质,除了 Al 及其重要化合物 外,你还知道哪些? 答案 ①弱酸的铵盐,如:NH4HCO3、CH3COONH4、(NH4)2S 等;②弱酸的酸式盐,如: NaHCO3、KHS、NaHSO3 等;③氨基酸。 (1)铝在自然界中有游离态和化合态两种形式( ) (2)MgO 与 Al 粉的混合物也可称为铝热剂( ) (3)冶炼铝时常用焦炭作还原剂( ) (4)铝与少量 NaOH 溶液反应得到铝盐,与足量 NaOH 溶液反应生成四羟基合铝酸盐( ) (5)相同质量的镁条分别在足量的 CO2 和 O2 中完全燃烧,所得固体的质量相同( ) (6)工业上制造镁粉时,可将镁蒸气在 N2 中冷却( ) (7)Al2O3 的熔点高,可作耐高温材料,实验室可用氧化铝坩埚熔化 NaOH、Na2CO3 固体等( ) (8)明矾可作净水剂,起到杀菌消毒的作用( ) (9)[Al(OH)4]-、HCO -3 在水溶液中因发生双水解反应而不能大量共存( ) (10)[Al(OH)4]-与 NH +4 在水溶液中因发生双水解反应不能大量共存( ) 答案 (1)× (2)× (3)× (4)× (5)× (6)× (7)× (8)× (9)× (10)√ 题组一 镁、铝单质的性质及应用 1.镁是一种活泼的金属单质,下列关于金属镁的说法中正确的是( ) A.镁能与 NaOH 溶液反应生成 Mg(OH)2 沉淀 B.大量镁条燃烧引起的火灾不能用干冰灭火器灭火 C.镁在任何条件下都不能与水反应 D.镁能在 N2 中燃烧,且生成 MgN 答案 B 解析 镁不是两性金属,不能与 NaOH 溶液反应,故 A 错误;镁能在 CO2 中燃烧,故 B 正确; 镁在加热条件下能与水反应生成氢氧化镁和氢气,故 C 错误;镁能在 N2 中燃烧,且生成 Mg3N2, 故 D 错误。 2.下列关于铝单质的叙述中,正确的是( ) A.不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 B.铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定 C.铝和 NaOH 溶液反应:Al+2OH-+2H2O===[Al(OH)4]-+H2↑ D.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝会滴落下 来,是因为金属铝的熔点较低 答案 A 解析 A 项,无论是铝还是其氧化物都能与酸或碱反应,正确;B 项,铝表面形成致密的氧化 膜,错误;C 项,电荷、原子均不守恒,正确的离子方程式为 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑, 错误;D 项,打磨后的铝箔在酒精灯上灼烧表面生成 Al2O3,高熔点的 Al2O3 兜住了熔融的液 态铝,不会滴落,错误。 题组二 氧化铝、氢氧化铝的特性及应用 3.下列除去杂质的方法不正确的是( ) A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 B.用过量氨水除去 Fe3+溶液中的少量 Al3+ C.Al(OH)3 中混有少量 Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量 CO2 后过滤 D.MgO 中混有少量 Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到 MgO 答案 B 解析 Al(OH)3 不溶于氨水,故向含少量 Al3+的 Fe3+溶液中加入过量氨水时,Fe3+、Al3+均 转化为氢氧化物沉淀,达不到除杂的目的。 4.用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是( ) ①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量 CO2 生成 Al(OH)3 沉淀 ⑤加入盐 酸生成 Al(OH)3 沉淀 ⑥加入过量烧碱溶液 A.①⑥⑤③ B.②③④③ C.②③⑤③ D.①③⑤③ 答案 B 5.工业上以铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下: 下列叙述正确的是( ) A.反应①中试剂 X 是氢氧化钠溶液 B.试剂 Y 是 HCl,它与[Al(OH)4]-反应生成氢氧化铝 C.图中所示转化反应中包含 2 个氧化还原反应 D.将 X 与 Y 试剂进行对换,最终可以达到相同结果 答案 A 解析 B 项,若试剂 Y 是 HCl,它与[Al(OH)4]-反应生成 Al3+,错误;C 项,图中所示转化 只有一步是氧化还原反应 2Al2O3 =====通电 4Al+3O2↑,错误;D 项,试剂 X 为氢氧化钠,滤渣 C 为氧化铁,滤液 A 为四羟基合铝酸钠和氢氧化钠混合溶液,通入过量二氧化碳气体,发生 反应:Na[Al(OH)4]+CO2===Al(OH)3↓+NaHCO3,不能对换,错误。 含铝杂质的提纯方法归类 利用 Al、Al2O3、Al(OH)3 可溶于强碱的特性,可除去许多物质中的含铝杂质,如: (1)Mg(Al):加足量 NaOH 溶液。 (2)Fe2O3(Al2O3):加足量 NaOH 溶液。 (3)Mg(OH)2[Al(OH)3]:加足量 NaOH 溶液。 (4)Mg2+(Al3+):加过量 NaOH 溶液,过滤,再加酸充分溶解。 1.单质铜 (1)物理性质:紫红色固体,具有良好的延展性、导热性和导电性。 (2)化学性质 ①常温下,铜在干燥的空气中性质稳定,但在潮湿的空气里则会被锈蚀,在其表面逐渐形成 一层绿色的铜锈。有关化学方程式:_______________________________________________ ____________________________________________________________________________。 ②写出下列化学方程式: 铜在空气中加热:___________________________________________________________; 铜丝在硫蒸气中反应:_______________________________________________________。 答案 ①2Cu+O2+CO2+H2O===Cu2(OH)2CO3 ②2Cu+O2 =====△ 2CuO 2Cu+S =====△ Cu2S 2.铜及其常见化合物的颜色 物质 颜色 物质 颜色 Cu 紫红色 CuSO4 白色 CuO 黑色 CuSO4·5H2O 蓝色 Cu2O 砖红色 Cu2(OH)2CO3 绿色 Cu2S 黑色 Cu(OH)2 蓝色 问题思考 铜的重要化合物转化关系如下, 完成下列方程式: (1)铜的氧化物 ①CuO 高温分解得 Cu2O,化学方程式为 4CuO =====高温 2Cu2O+O2↑。 ②Cu2O 溶于稀硫酸产生蓝色溶液和紫红色固体,离子方程式为 Cu2O+2H+===Cu+Cu2++ H2O。 (2)氢氧化铜 氢氧化铜悬浊液煮沸变黑的原因,用化学方程式表示为 Cu(OH)2 =====△ CuO+H2O。 (3)硫酸铜晶体受热分解为白色的硫酸铜粉末,化学方程式为 CuSO4·5H2O =====△ CuSO4+ 5H2O。 (4)Cu2(OH)2CO3 的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的 氧化铜,化学方程式:Cu2(OH)2CO3 =====△ 2CuO+CO2↑+H2O,可溶于稀硫酸,离子方程式: Cu2(OH)2CO3+4H+===2Cu2++CO2↑+3H2O。 (1)CuO 是黑色固体,与水反应生成 Cu(OH)2( ) (2)铜锈是铜被空气中的氧气缓慢氧化生成的氧化物( ) (3)无水硫酸铜可用于检验酒精中是否含有水( ) (4)将铜片置于干燥的空气中,不易被腐蚀( ) (5)CuSO4·5H2O 失去结晶水属于物理变化( ) 答案 (1)× (2)× (3)√ (4)√ (5)× 题组一 铜及其化合物的性质和应用 1.(2018·衡阳二模)我国宋代沈括在《梦溪笔谈》中记载:“信州铅山县有苦泉,流以为涧。 挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜。”下列对文中词语的理解,正确的是( ) A.“苦泉”中泉水属于胶体 B.“熬”表示加热蒸馏 C.“胆矾”化学式为 CuSO4 D.“化”表示置换转化 答案 D 解析 由题意可知,“苦泉”泉水中含有硫酸铜,属于溶液,不属于胶体,故 A 错误;硫酸 铜溶液蒸发得到硫酸铜晶体,从溶液中获取晶体,属于蒸发操作,故 B 错误;胆矾是硫酸铜 晶体,“胆矾”化学式为 CuSO4·5H2O,故 C 错误;熬胆矾铁釜,久之亦化为铜,是发生了: Fe+CuSO4===Cu+FeSO4,硫酸铜与 Fe 置换反应生成 Cu,即“化”表示置换转化,故 D 正 确。 2.某研究小组通过实验探究 Cu 及其化合物的性质,下列操作正确且能达到实验目的的是( ) A.将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 B.常温下将铜丝伸入盛满氯气的集气瓶中,观察 CuCl2 的生成 C.将 CuCl2 溶液在蒸发皿中加热蒸干,得到无水 CuCl2 固体 D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 答案 D 解析 Cu 与 Cl2 在常温下不反应,需要加热才能发生反应,B 项错误;CuCl2 水解生成的 HCl 易挥发,加热蒸干能促进 CuCl2 的水解而得不到 CuCl2 固体,C 项错误。 题组二 铜及其化合物的制备 3.(2020·铜川调研)某炼铁废渣中含有大量 CuS 及少量铁的化合物,工业上以该废渣为原料生 产 CuCl2·2H2O 晶体的工艺流程如下: 下列说法正确的是( ) A.焙烧过程中每消耗 1 mol CuS 则消耗 3 mol O2 B.焙烧后的废气能够使酸性高锰酸钾溶液退色 C.滤渣中主要含铁的氧化物 D.将获得的 CuCl2·2H2O 晶体加热可制得 CuCl2 固体 答案 B 解析 A 项,2CuS+3O2 =====高温 2CuO+2SO2,由方程式可知,1 mol CuS 消耗 1.5 mol O2,错 误;B 项,废气中含有 SO2,能使酸性高锰酸钾溶液退色,正确;C 项,调节 pH 时,Fe3+水 解转化为 Fe(OH)3 而除去,错误;D 项,将 CuCl2·2H2O 直接加热脱水,Cu2+水解,HCl 挥发 会产生 Cu(OH)2,无法得到 CuCl2,错误。 4.(2019·西宁检测)工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下: (1)气体 A 中的大气污染物可选用下列试剂中的______(填字母)吸收。 a.浓硫酸 b.稀硝酸 c.NaOH 溶液 d.氨水 (2)由泡铜冶炼粗铜的化学方程式为____________________________________________ ________________________________________________________________________。 (3)以 CuSO4 溶液为电解质溶液进行粗铜(含 Al、Zn、Ag、Pt、Au 等杂质)的电解精炼,下列说 法正确的是__________(填字母)。 a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应 c.溶液中 Cu2+向阳极移动 d.从阳极泥中可回收 Ag、Pt、Au 等金属 (4)利用反应 2Cu+O2+2H2SO4===2CuSO4+2H2O 可制备 CuSO4,若将该反应设计为原电池, 其正极电极反应式为___________________________________________________________。 答案 (1)cd (2)3Cu2O+2Al =====高温 Al2O3+6Cu (3)bd (4)4H++O2+4e-===2H2O 解析 (1)气体 A 中的大气污染物为 SO2,可以用 NaOH 溶液或氨水吸收。(2)依据图示,泡铜 中的 Cu2O 与 Al 高温下发生铝热反应制得铜。(3)电解精炼铜过程中,电能转变为化学能的同 时,部分电能也转化为热能,a 错;电解精炼粗铜时,粗铜作阳极,与电源正极相连,发生氧 化反应,b 对;电解过程中 Cu2+向阴极移动,c 错;粗铜中 Ag、Pt、Au 的放电能力比铜的弱, 形成阳极泥,可以回收,d 对。(4)根据总反应,O2 发生还原反应,因此正极反应式为 O2+4H ++4e-===2H2O。 铜的冶炼“两方法” (1)湿法炼铜:Fe+CuSO4===FeSO4+Cu。 (2)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜): 2CuFeS2+4O2 =====800 ℃ Cu2S+3SO2+2FeO(炉渣) 2Cu2S+3O2 =====1 200 ℃ 2Cu2O+2SO2 2Cu2O+Cu2S =====1 200 ℃ 6Cu+SO2↑ 粗铜中铜的含量为 99.5%~99.7%,主要含有 Ag、Zn、Fe、Au 等杂质,粗铜通过电解精炼可 得到纯度达 99.95%~99.98%的铜。电解精炼铜的原理是用粗铜作阳极,失电子变为 Cu2+,用 纯铜棒作阴极即可得精铜。 1.合金的概念及性能 2.常见的金属材料 (1)金属材料分类 (2)几种常见的合金 ①钢铁 ② ③ 3.金属矿物的开发利用 (1)金属在自然界中的存在。 (2)金属冶炼的实质。 金属的冶炼过程就是把金属从化合态还原为游离态的过程。即 Mn++ne-===M(写反应通式, 用 M 表示金属)。 (3)金属冶炼的方法(用化学方程式表示)。 4.铝热反应实验中的有关问题 实验 装置 实验 ①镁带剧烈燃烧,放出大量的热,并发出耀眼的白光,氧化铁与铝粉在较高 现象 温度下发生剧烈的反应;②纸漏斗的下部被烧穿,有熔融物落入沙中 实验 结论 高温下,铝与氧化铁发生反应,放出大量的热 Fe2O3+2Al =====高温 2Fe+Al2O3 原理 应用 ①制取熔点较高、活动性弱于 Al 的金属,如铁、铬、锰、钨等; ②金属焊接,如野外焊接钢轨等 (1)金属元素的单质只有还原性,其离子只有氧化性( ) (2)金属元素的单质在常温下均为固体( ) (3)合金材料中不可能含有非金属元素( ) (4)铁是人类在生产、生活中最早使用的金属( ) (5)合金的硬度一般大于成分金属,而熔点一般低于成分金属( ) (6)金属氧化物与铝粉的混合物都是铝热剂( ) (7)人类历史上使用铝的时间比铁晚,原因是铝的冶炼成本高( ) (8)电解氯化镁溶液制取金属镁( ) 答案 (1)× (2)× (3)× (4)× (5)√ (6)× (7)× (8)× 题组一 金属材料、合金的性能及应用 1.(2019·中原区校级月考)青铜的主要成分是铜和锡,锡的熔点是 232 ℃,含锡 25%的青铜熔 点约为 800 ℃,《吕氏春秋·别类编》中有关于青铜的记载“金(铜)柔锡柔,合两柔则为刚,燔 (烧)之则为淖(液体)。”下列说法正确的是( ) A.在轮船外壳悬挂锌、锡等金属块可减慢钢铁的腐蚀 B.合金的熔点一定低于各组分金属的熔点 C.铜和锡在元素周期表均位于第 4 周期 D.“合两柔则为刚”体现了合金的硬度通常大于各组分金属的特点 答案 D 解析 要保护钢铁,在和海水构成的原电池中应该让钢铁作正极才能被保护,活泼性比 Fe 强 的金属作负极,锡金属性弱于铁,不能保护铁,故 A 错误;青铜的主要成分是铜和锡,锡的 熔点是 232 ℃,含锡 25%的青铜熔点约为 800 ℃,青铜的熔点高于锡,故 B 错误;锡位于周 期表的第 5 周期,故 C 错误;“金(即铜)柔锡柔,合两柔则刚”体现了合金硬度大于成分金属 硬度,故 D 正确。 2.C919 大型飞机的制造采用了大量新材料铝锂合金。下列关于铝锂合金的说法不正确的是 ( ) A.铝锂合金是铝与锂形成的混合物 B.铝锂合金的硬度比锂大 C.铝锂合金的熔、沸点比铝低 D.铝锂合金耐酸碱腐蚀 答案 D 解析 铝锂合金中的铝既能与酸反应,又能与碱反应,锂能与酸反应,故铝锂合金不耐酸碱 腐蚀。 题组二 金属冶炼、金属矿物的开发利用(不定项选择题) 3.(2020·成都模拟)《五金·铁》中记载:“若造熟铁,则生铁流出时,相连数尺内,低下数寸, 筑一方塘,短墙抵之。其铁流入塘内,数人执柳木排立墙上……众人柳棍疾搅,即时炒成熟 铁。”以下说法不正确的是( ) A.金属冶炼方法由金属活动性决定 B.熟铁比生铁质地更硬,延展性稍差 C.炒铁是为了降低铁水中的碳含量 D.该法与近代往生铁水吹空气炼钢异曲同工 答案 B 解析 活泼性不同的金属,其冶炼方法不同,即金属冶炼方法由金属活动性决定,故 A 正确; 熟铁比生铁质地更软,且延展性好,故 B 错误;炒铁过程中降低了铁水中的碳含量,从而将 生铁转化成熟铁,故 C 正确;该冶炼方法和近代往生铁水吹空气炼钢,都是利用空气中氧气 氧化 C 元素,其原理基本相同,故 D 正确。 4.(2020·新乡质检)下列说法正确的是( ) A.工业上通过电解氯化钠溶液制备金属钠和氯气 B.金属冶炼的本质是金属阳离子得到电子变成金属原子 C.工业上电解熔融状态的 Al2O3 制备 Al 涉及氧化还原反应 D.MgCl2(aq) ― ― →石灰乳 Mg(OH)2 ― ― →煅烧 MgO ― ― →电解 Mg 答案 BC 解析 电解 NaCl 溶液生成 NaOH、H2 和 Cl2,得不到单质钠,A 错误;电解熔融 Al2O3 发生 的是氧化还原反应,C 正确;工业上冶炼镁是电解熔融 MgCl2 而不是 MgO,D 错误。 5.(2019·潍坊期中)以高硫铝土矿(主要成分为 Al2O3、Fe2O3、SiO2、少量 FeS2)为原料,生产 Fe3O4 的部分工艺流程如下: 下列说法错误的是( ) A.用 NaOH 溶液吸收焙烧过程产生的 SO2 有利于保护环境和资源再利用 B.从高硫铝土矿中可制得 Al、Fe 的化合物 C.向“过滤”得到的滤液中通入过量 CO2,铝元素存在的形式由[Al(OH)4]-转化为 Al3+ D.FeS2 与 Fe2O3 混合后在无氧条件下焙烧的目的是生成 Fe3O4 和 SO2 答案 C 解析 C 项,通入过量的二氧化碳,滤液中的[Al(OH)4]-只能转化为氢氧化铝沉淀。 题组三 铝热反应及应用 6.铝热反应的本质是利用铝的还原性,将难熔金属从其氧化物中置换出来,关于铝热反应解 答下列问题: (1)用铝粉和 Fe2O3 做铝热反应实验,需要的试剂还有________(填字母)。 A.KCl B.KClO3 C.MnO2 D.Mg (2)用等物质的量的 MgO 和 Fe2O3 组成的混合物在一定条件下与 Al 粉进行铝热反应。 ①引发铝热反应的操作是________________________________________________________。 ②产物中单质是________(写名称)。 (3)取少量(1)中铝热反应所得的固体混合物,将其溶于足量稀 H2SO4,滴加 KSCN 溶液无明显 现象,________(填“能”或“不能”)说明固体混合物中无 Fe2O3,理由是___________ _____________________________________________________________(用离子方程式说明)。 答案 (1)BD (2)①加少量 KClO3,插上镁条并将其点燃 ②铁 (3)不能 Fe2O3+6H+===2Fe3++3H2O、Fe+2Fe3+===3Fe2+ 解析 (1)做铝热反应的实验时,需要 KClO3 作助燃剂,且用镁条引燃。(2)在混合物上加少量 KClO3 固体并插上 Mg 条,点燃 Mg 条后放出热量,使 KClO3 固体分解放出 O2,进一步加剧 Mg 的燃烧,可在短时间内使混合物温度迅速升高,引发反应。MgO 不能与铝发生铝热反应,所 以产物中单质为 Fe。(3)反应后固体混合物中若有 Fe2O3,因发生反应:Fe2O3+6H+===2Fe3++ 3H2O、Fe+2Fe3+===3Fe2+,Fe3+转化为 Fe2+,加 KSCN 溶液不会变红。 1.(高考选项组合)下列说法或性质对应用途正确的是( ) A.氢氧化铝不可用于中和过多胃酸(2018·全国卷Ⅱ,7C 改编) B.KAl(SO4)2·12H2O 溶于水可形成 Al(OH)3 胶体(2018·江苏,6B) C.Al2O3 是两性氧化物,可用作耐高温材料(2018·江苏,3C) D . 给 定 条 件 转 化 : Al(s) ― ― ― ― →NaOH(aq) Na[Al(OH)4](aq) ― ― ― ― ― ― →过量 HCl(aq) Al(OH)3(s)(2018·江苏,9B) 答案 B 2.(2018·全国卷Ⅰ,7)磷酸亚铁锂(LiFePO 4)电池是新能源汽车的动力电池之一。采用湿法冶 金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下: 下列叙述错误的是( ) A.合理处理废旧电池有利于保护环境和资源再利用 B.从“正极片”中可回收的金属元素有 Al、Fe、Li C.“沉淀”反应的金属离子为 Fe3+ D.上述流程中可用硫酸钠代替碳酸钠 答案 D 解析 Li2SO4 易溶于水,用硫酸钠代替碳酸钠,不能形成含 Li 沉淀,D 项错误;合理处理废 旧电池有利于保护环境和资源再利用,A 项正确;LiFePO4 中含有 Li 和 Fe 元素,正极片碱溶 所得滤液中含有 Al 元素,B 项正确;Fe2+能被 HNO3 氧化为 Fe3+,Fe3+遇到碱液后沉淀,而 另一种金属离子——锂离子遇到碳酸钠后沉淀,C 项正确。 3.[2016·海南,14(1)(2)(3)]KAl(SO 4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实 验室中,采用废易拉罐(主要成分为 Al,含有少量的 Fe、Mg 杂质)制备明矾的过程如下图所示。 回答下列问题: 易拉罐 ― ― →试剂① 微热,过滤 滤液 A ― ― ― ― →NH4HCO3 沉淀 B ― ― →稀 H2SO4 K2SO4 产物 (1)为尽量少引入杂质,试剂①应选用______(填标号)。 a.HCl 溶液 b.H2SO4 溶液 c.氨水 d.NaOH 溶液 (2)易拉罐溶解过程中主要反应的化学方程式为_________________________________ ________________________________________________________________________。 (3)沉淀 B 的化学式为_____________________________________________________; 将少量明矾溶于水,溶液呈弱酸性,其原因是________________________________ ________________________________________________________________________。 答案 (1)d (2)2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑ (3)Al(OH)3 Al3+水解,使溶液中 H+浓度增大 解析 (2)选用 NaOH 溶液溶解易拉罐,主要发生反应为 2Al+2NaOH+6H2O===2Na[Al(OH)4] +3H2↑。(3)滤液 A 中铝元素以[Al(OH)4]-形式存在,与溶液中 HCO -3 发生反应:[Al(OH)4]-+ HCO-3 ===Al(OH)3↓+CO2-3 +H2O,故沉淀 B 为 Al(OH)3,明矾溶于水时,KAl(SO4)2===K++Al3 ++2SO2-4 ,Al3++3H2OAl(OH)3+3H+,使溶液呈弱酸性。 4.[2019·全国卷Ⅰ,26(1)(2)(4)]硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、 肥料等工业。一种以硼镁矿(含 Mg2B2O5·H2O、SiO2 及少量 Fe2O3、Al2O3)为原料生产硼酸及轻 质氧化镁的工艺流程如下: 回答下列问题: (1) 在 95 ℃“ 溶 浸 ” 硼 镁 矿 粉 , 产 生 的 气 体 在 “ 吸 收 ” 中 反 应 的 化 学 方 程 式 为 ________________________________________________________________________ ________________________________________________________________________。 (2)“滤渣 1”的主要成分有_________________________________________________。 为检验“过滤 1”后的滤液中是否含有 Fe3+离子,可选用的化学试剂是________。 (3)在“沉镁”中生成 Mg(OH)2·MgCO3 沉淀的离子方程式为_____________________, 母液经加热后可返回________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是 ________。 答案 (1)NH4HCO3+NH3===(NH4)2CO3 (2)SiO2、Fe2O3、Al2O3 KSCN (3)2Mg2 + + 3CO2-3 + 2H2O===Mg(OH)2·MgCO3↓ + 2HCO-3 [ 或 2Mg2 + + 2CO2-3 + H2O===Mg(OH)2·MgCO3↓+CO2↑] 溶浸 高温焙烧 解析 (1)由流程图加入物质可知,“溶浸”时产生的气体只能是 NH3,NH3 与 NH4HCO3 反应 生成用于“沉镁”的物质只能是(NH4)2CO3。(2)由流程图可知,在过滤获取 H3BO3 之前没有除 Fe3+、Al3+的步骤,推知氧化铁、氧化铝在“溶浸”时没有溶解,而二氧化硅不溶于硫酸铵 溶液,因而滤渣 1 的主要成分是二氧化硅、氧化铁、氧化铝。检验 Fe3+的试剂可选用 KSCN。 (3)“沉镁”中,结合反应物有 Mg2+、CO2-3 ,生成物为 Mg(OH)2·MgCO3,依据离子方程式书 写要求,即可写出方程式。母液含硫酸铵,可以将母液返回“溶浸”工序循环使用,体现绿 色化学理念和环境保护思想。碱式碳酸镁转化成轻质氧化镁,联系碳酸镁、氢氧化镁受热都 能分解生成氧化镁。查看更多