- 2021-07-05 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山西省临汾市2020届高三上学期月考化学
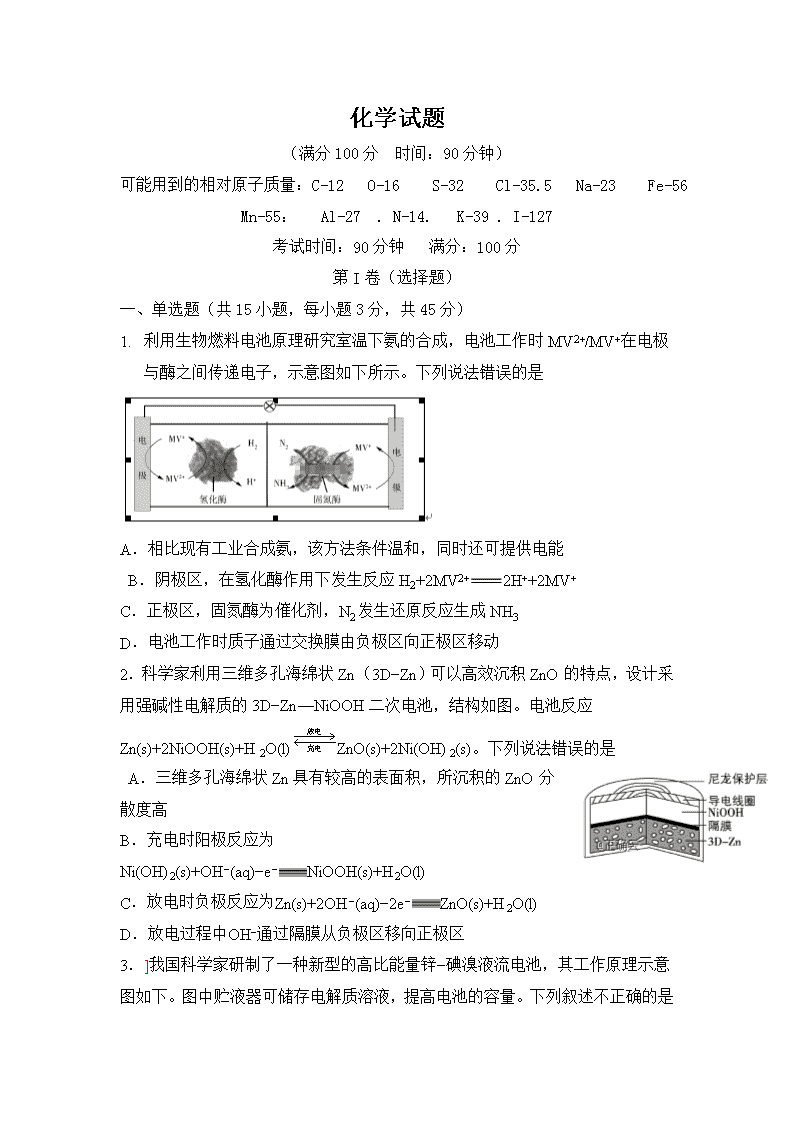
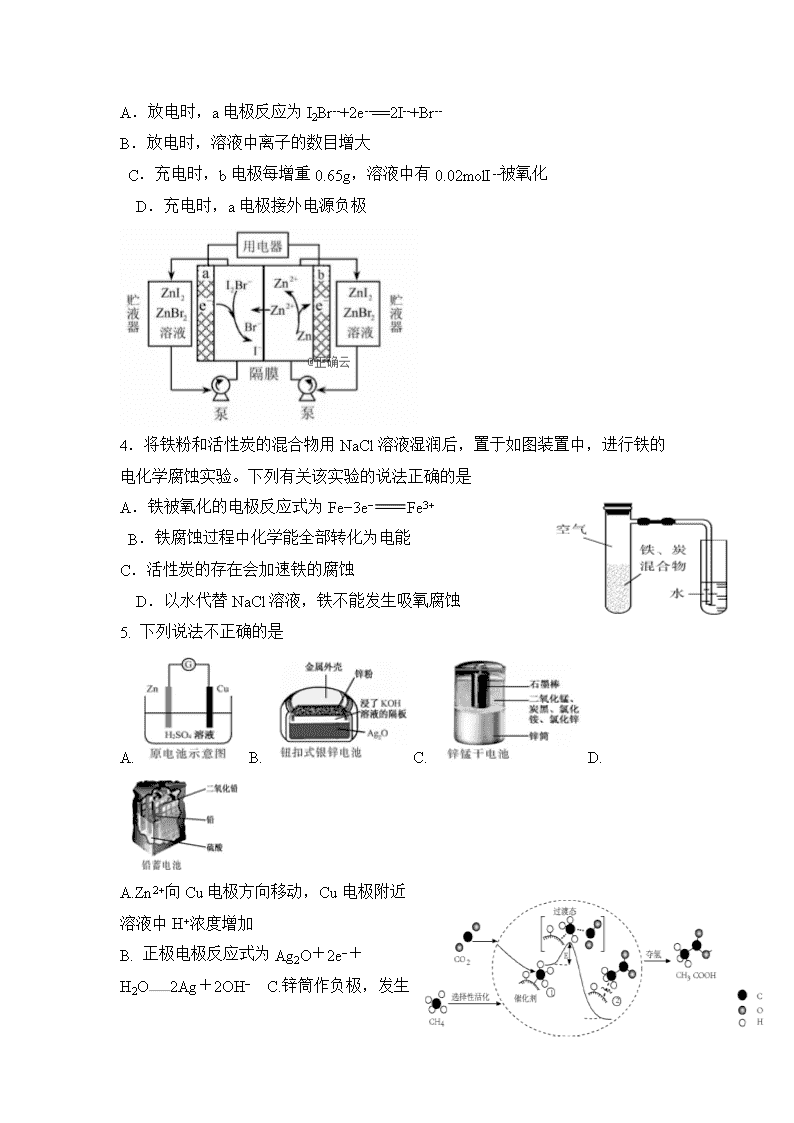
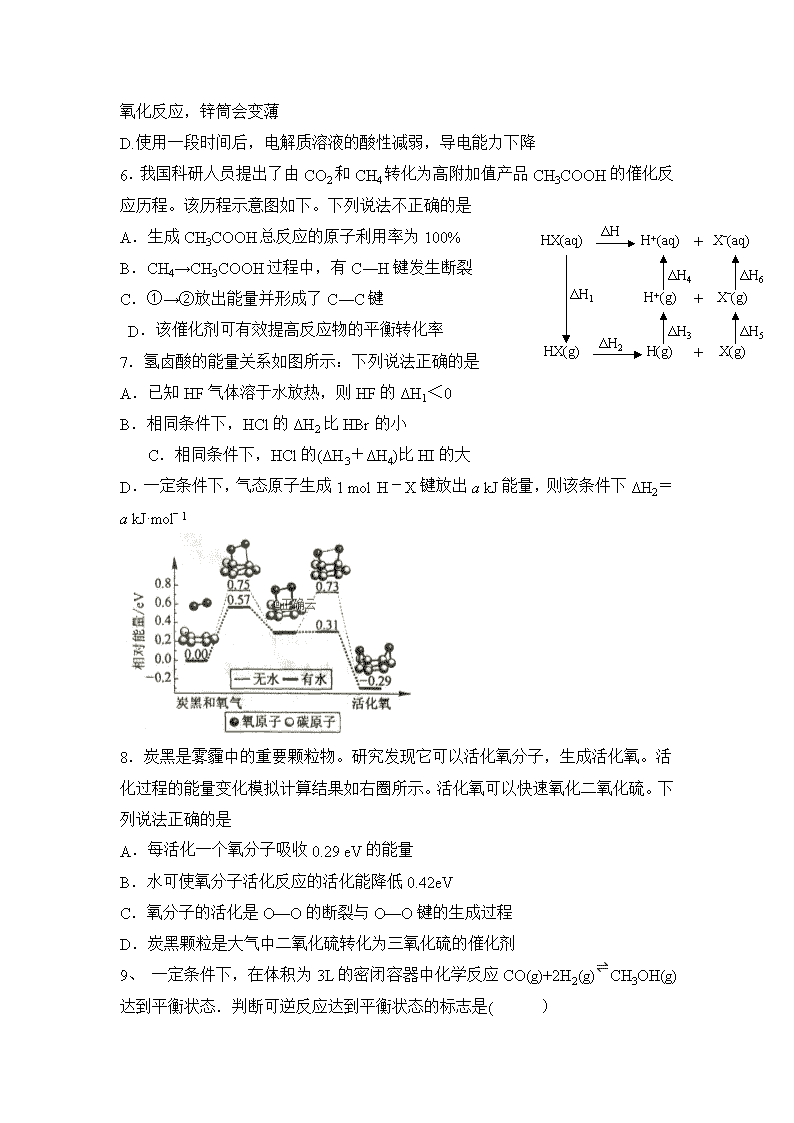
化学试题 (满分100分 时间:90分钟) 可能用到的相对原子质量:C-12 O-16 S-32 Cl-35.5 Na-23 Fe-56 Mn-55: Al-27 . N-14. K-39 . I-127 考试时间:90分钟 满分:100分 第I卷(选择题) 一、 单选题(共15小题,每小题3分,共45分) 1. 利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是 A.相比现有工业合成氨,该方法条件温和,同时还可提供电能 B.阴极区,在氢化酶作用下发生反应H2+2MV2+2H++2MV+ C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3 D.电池工作时质子通过交换膜由负极区向正极区移动 2.科学家利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如图。电池反应Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)。下列说法错误的是 A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高 B.充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e−NiOOH(s)+H2O(l) C.放电时负极反应为Zn(s)+2OH−(aq)−2e−ZnO(s)+H2O(l) D.放电过程中OH−通过隔膜从负极区移向正极区 3.]我国科学家研制了一种新型的高比能量锌−碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是 A.放电时,a电极反应为I2Br--+2e--==2I--+Br-- B.放电时,溶液中离子的数目增大 C.充电时,b电极每增重0.65g,溶液中有0.02molI--被氧化 D.充电时,a电极接外电源负极 4.将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是 A.铁被氧化的电极反应式为Fe−3e−Fe3+ B.铁腐蚀过程中化学能全部转化为电能 C.活性炭的存在会加速铁的腐蚀 D.以水代替NaCl溶液,铁不能发生吸氧腐蚀 5. 下列说法不正确的是 A. B. C. D. A.Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加 B. 正极电极反应式为Ag2O+2e−+H2O2Ag+2OH− C.锌筒作负极,发生氧化反应,锌筒会变薄 D.使用一段时间后,电解质溶液的酸性减弱,导电能力下降 6.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是 HX(aq) H+(aq) Xˉ(aq) + HX(g) H(g) X(g) + H+(g) Xˉ(g) + ΔH2 ΔH ΔH1 ΔH4 ΔH6 ΔH3 ΔH5 A.生成CH3COOH总反应的原子利用率为100% B.CH4→CH3COOH过程中,有C―H键发生断裂 C.①→②放出能量并形成了C―C键 D.该催化剂可有效提高反应物的平衡转化率 7.氢卤酸的能量关系如图所示:下列说法正确的是 A.已知HF气体溶于水放热,则HF的ΔH1<0 B.相同条件下,HCl的ΔH2比HBr的小 C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大 D.一定条件下,气态原子生成1 mol H-X键放出a kJ能量,则该条件下ΔH2=a kJ·molˉ1 8.炭黑是雾霾中的重要颗粒物。研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如右圈所示。活化氧可以快速氧化二氧化硫。下列说法正确的是 A.每活化一个氧分子吸收0.29 eV的能量 B.水可使氧分子活化反应的活化能降低0.42eV C.氧分子的活化是O—O的断裂与O—O键的生成过程 D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂 9、 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)⇌CH3OH(g)达到平衡状态.判断可逆反应达到平衡状态的标志是( ) A、υ生成(CH3OH)=υ消耗(CO) B、混合气体的密度不再改变 C、混合气体的平均相对分子质量不再改变 D、CO、H2、CH3OH的浓度相等 10、可逆反应3A(g)3B(?)+C(?);ΔH>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是( ) A.B和C可能都是气体 B.B和C一定都是气体 C.若C为固体,则B一定是气体 D.有可能B为固体,C为气体 11、某密闭带活塞的容器中,反应达到平衡A(g)+2B(g)3C(?),测得C(A)=0.6mol/L,将容积体积缩小为原来的一半并重新达到平衡,测得C(A)=1.0mol/L,下列说法正确的是 A、建立新平衡时,原平衡不移动 B、建立新平衡时,原平衡向左移动 C、C为非气体物质,加压时平衡向右移动 D、C为气体 12、已知298.15 K时,可逆反应:Pb2+(aq)+Sn(s)Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是( ) A.向正反应方向进行 B.向逆反应方向进行 C.处于平衡状态 D.无法判断 13、已知反应X (g)+Y (g) n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图。下列说法不正确的是( ) A.反应方程式中n=1 B.10 min时,曲线发生变化的原因是升高温度 C.10 min时,曲线发生变化的原因是增大压强 D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1 14、 K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是 A.①中溶液橙色加深,③中溶液变黄 B.②中Cr2O72-被C2H5OH还原 C.对比②和④可知K2Cr2O7酸性溶液氧化性强 D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色 15、根据下列图示所得出的结论不正确的是 A.图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0 B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸 D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小 一、单选题(共15小题,每小题3分,共45分) 题号 1 2 3 4 5 6 7 8 答案 题号 9 10 11 12 13 14 15 答案 二、填空题(共三小题,除标注外每空3分,共22分。) 17、(2分)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下: (1)反应Ⅰ:2H2SO4(l) === 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1 反应Ⅲ:S(s)+O2(g) === SO2(g) ΔH3=-297 kJ·mol-1 反应Ⅱ的热化学方程式:________________________________________________________________。 18、将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。①写出电解时阴极的电极反应式_______________________________________。 ②电解过程中通过阳离子交换膜的离子主要为________。 ③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向___________极室(填“阴”或者“阳”)加入____________(填化学式)。 19.全钒液流电池是一种新型的绿色环保储能系统,工作原理如图: 离子种类 VO2+ VO2+ V3+ V2+ 颜色 黄色 蓝色 绿色 紫色 (1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_________________________________________。(2)(2分)当完成储能时,正极溶液的颜色是________(3)质子交换膜的作用是___________________________________________ 四、综合题(共二小题,每空3分,共33分) 20、(1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应: t/min 0 40 80 160 260 1300 1700 ∞ p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1 其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解 ②研究表明,N2O5(g)分解的反应速率。t=62 min时,测得体系中=2.9 kPa,则此时的=________________kPa,v=__________________kPa·min−1。 ③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是_____________________________________________________________________。 ④25℃时N2O4(g)=== 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。 21、 对于反应2SiHCl3(g) = SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。 ①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。 ②在343 K下:要提高SiHCl3转化率,可采取的措施是_____________________________ 要缩短反应达到平衡的时间,可采取的措施有________________________________________________________________________________。 ③比较a、b处反应速率大小:υa______υb(填“大于”“小于”或“等于”)。反应速率υ=υ正−υ逆=,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处=**________(保留1位小数)。查看更多