- 2021-07-05 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省大庆十中2018-2019学年高二上学期期末考试化学试卷
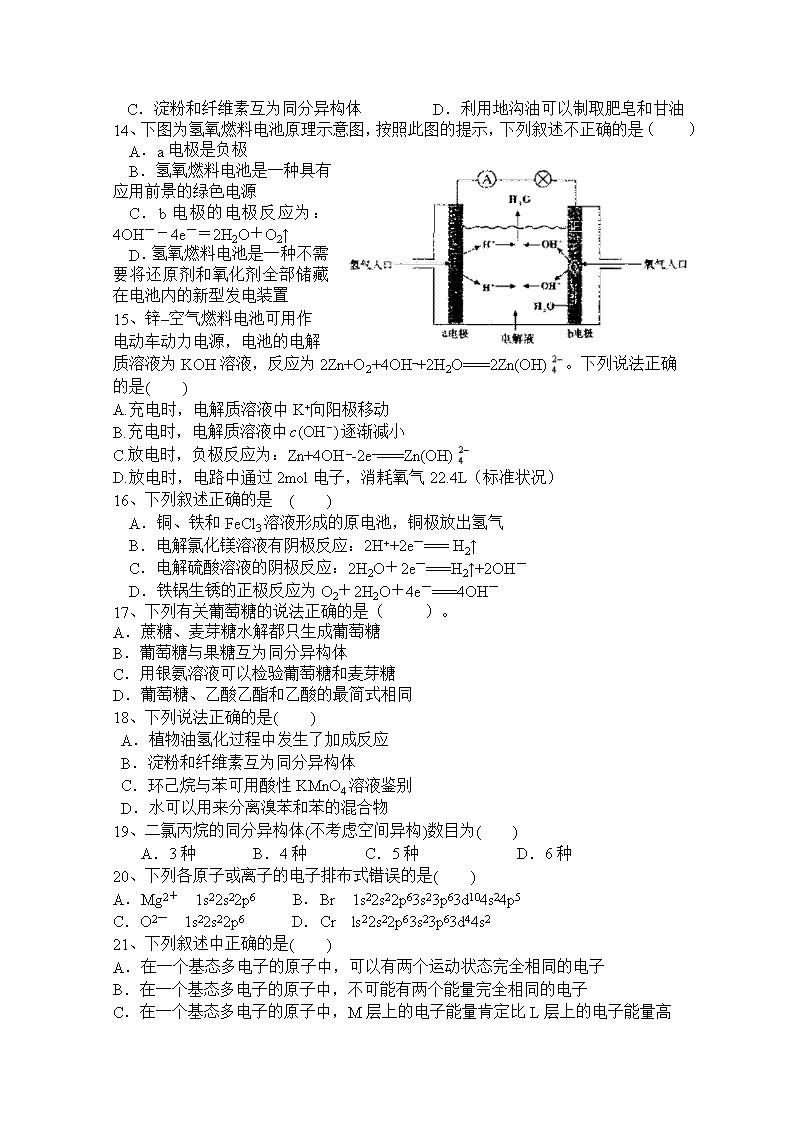
2018-2019第一学期高二期末考试化学试题 (时间:90分钟 满分:100分) 一、选择题(本题包括21小题,每小题3分,共63分;每小题只有一个选项符合题意) 1、为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入( ) ① 适量的HCl ② 适量的NaCl ③ 适量的氨水 ④ 适量的NaOH A.①② B.③ C.③④ D.④ 2、用已知浓度盐酸滴定未知浓度的NaOH溶液会导致测得NaOH溶液浓度偏高的是 ( ) A.滴定前滴定管中有气泡,滴定后消失 B.碱式滴定管量取NaOH溶液时,未进行润洗操作 C.滴定时达到滴定终点时俯视读数 D.锥形瓶取用NaOH待测液前加少量水洗涤 3、下列关于电解质溶液的叙述正确的是( ) A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)=c(OH-) B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大 4、在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( ) A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) C.c(Na+)=c(CH3COO-)+c(CH3COOH) D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) 5、向ZnSO4溶液中加入Na2S的溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( ) A.白色沉淀为ZnS,而黑色沉淀为CuS B.上述现象说明 ZnS的Ksp小于CuS的Ksp C.利用该原理实现一种沉淀转化为更难溶的沉淀 D.该过程破坏了ZnS的溶解平衡 6、已知如下物质的溶度积常数FeS:Ksp=6.3×10-18 mol2·L-2; CuS:Ksp=1.3×10-36mol2·L-2。下列说法正确的是( ) A.同温度下,CuS的溶解度大于FeS的溶解度 B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小 C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS D.除去工业废水中的Cu2+,可选用FeS做沉淀剂 7、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)= Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是( ) A.电池工作时,锌失去电子 B.电池工作时,电子由Zn 极通过外电路流向MnO2极 C.电池正极为MnO2 ,发生氧化反应 D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g 8、下列叙述正确的是( ) A. 95 ℃纯水的pH<7,说明加热可导致水呈酸性 B. pH = 3的醋酸溶液,稀释至10倍后pH = 4 C. 0.2 mol·L-1的盐酸,与等体积水混合后pH = 1 D. pH = 3的醋酸溶液与pH = 11的氢氧化钠溶液等体积混合后pH = 7 9、 25 ℃时,水的电离达到平衡: H2OH++OH-;DH>0, 下列叙述正确的是 ( ) A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 D. 将水加热,KW增大,pH不变 10、下列说法错误的是 A. 乙烷室温下能与浓盐酸发生取代反应 B.乙烯可以用作生产食品包装材料的原料 C.乙醇室温下在水中的溶解度大于溴乙烷 D.乙酸和甲酸甲酯互为同分异构体 11、下列各组中的物质均能发生就加成反应的是 A. 乙烯和乙醇 B. 苯和氯乙烯 C. 乙酸和溴乙烷 D. 丙烯和丙烷 12、下列由实验得出的结论正确的是 实验 结论 A. 将乙烯通入溴的四氧化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳 B. 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢与水分子中的氢具有相同的活性 C. 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性小于碳酸的酸性 D. 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性 13、下列说法正确的是( )。 A.糖类、油脂都能发生水解反应 B.燃烧法检验植物油和矿物油 C.淀粉和纤维素互为同分异构体 D.利用地沟油可以制取肥皂和甘油 14、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( ) A.a电极是负极 B.氢氧燃料电池是一种具有应用前景的绿色电源 C.b电极的电极反应为:4OH--4e-=2H2O+O2↑ D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 15、锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)。下列说法正确的是( ) A.充电时,电解质溶液中K+向阳极移动 B.充电时,电解质溶液中逐渐减小 C.放电时,负极反应为:Zn+4OH–-2e–===Zn(OH) D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) 16、下列叙述正确的是 ( ) A.铜、铁和FeCl3溶液形成的原电池,铜极放出氢气 B.电解氯化镁溶液有阴极反应:2H++2e-=== H2↑ C.电解硫酸溶液的阴极反应:2H2O+2e-===H2↑+2OH- D.铁锅生锈的正极反应为O2+2H2O+4e-===4OH- 17、下列有关葡萄糖的说法正确的是( )。 A.蔗糖、麦芽糖水解都只生成葡萄糖 B.葡萄糖与果糖互为同分异构体 C.用银氨溶液可以检验葡萄糖和麦芽糖 D.葡萄糖、乙酸乙酯和乙酸的最简式相同 18、下列说法正确的是( ) A.植物油氢化过程中发生了加成反应 B.淀粉和纤维素互为同分异构体 C.环己烷与苯可用酸性KMnO4溶液鉴别 D.水可以用来分离溴苯和苯的混合物 19、二氯丙烷的同分异构体(不考虑空间异构)数目为( ) A.3种 B.4种 C.5种 D.6种 20、下列各原子或离子的电子排布式错误的是( ) A.Mg2+ 1s22s22p6 B.Br 1s22s22p63s23p63d104s24p5 C.O2- 1s22s22p6 D.Cr ls22s22p63s23p63d44s2 21、下列叙述中正确的是( ) A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 D.如果某一基态3p能级上仅有2个电子,它们自旋状态必然相反 二、非选择题(本题包括3小题,共37分) 22.(10分)(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。 (2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。 (3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。 ①2s ②3d ③4s ④3s ⑤4p ⑥3p 轨道能量由低到高排列顺序是__________ 23、(14分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液. (1)该电池的负极材料是______.电池工作时,电子流向______(填“正极”或“负极”),正极上电极反应式__________________. (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀.其主要原因是__________________________.欲除去Cu2+,最好选用下列试剂中的______(填代号). a.NaOH b.Zn c.Fe d.NH3·H2O (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液.阳极的电极反应式是:________________________.若电解电路中通过2mol电子,MnO2的理论产量为______g.(Mn相对原子质量为55) 24.(13分)如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: (1)打开K2,闭合K1,若所盛溶液为CuSO4溶液:则A为 极,B极的电极反应式为 . (2)打开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则: ①A电极附近可观察到的现象是 .总反应化学方程式是 . 如要用电解方法精炼粗铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”). 2018-2019第一学期高二期末考试化学试题答案 1-5 、B A D A B 6-10、 D C C B A 11-15、B A D C C 16-21、D B A B D C 22.(10分)各2分:(1) ③ ②④⑥ (2) 1s22s22p63s23p4 H2SO4 (3)、①④⑥③②⑤ 23(14分)(各2分)(1)Zn(或锌); 正极;2H++2e-=H2↑ (2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;b; (3)Mn2+ + 2H2O - 2e-= MnO2 + 4H+; 87g. 24.(13分)(1)负(2分);Cu2++2e﹣═Cu(2分); (2)①产生无色气泡,溶液变红色(2分);2NaCl+2H2O2NaOH+H2↑+Cl2↑;(3分) (3)纯铜(2分);减小.(2分)查看更多