- 2021-07-05 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020_2021学年高中化学专题1化学家眼中的物质世界2_4溶液的配制和分析课时作业含解析苏教版必修1
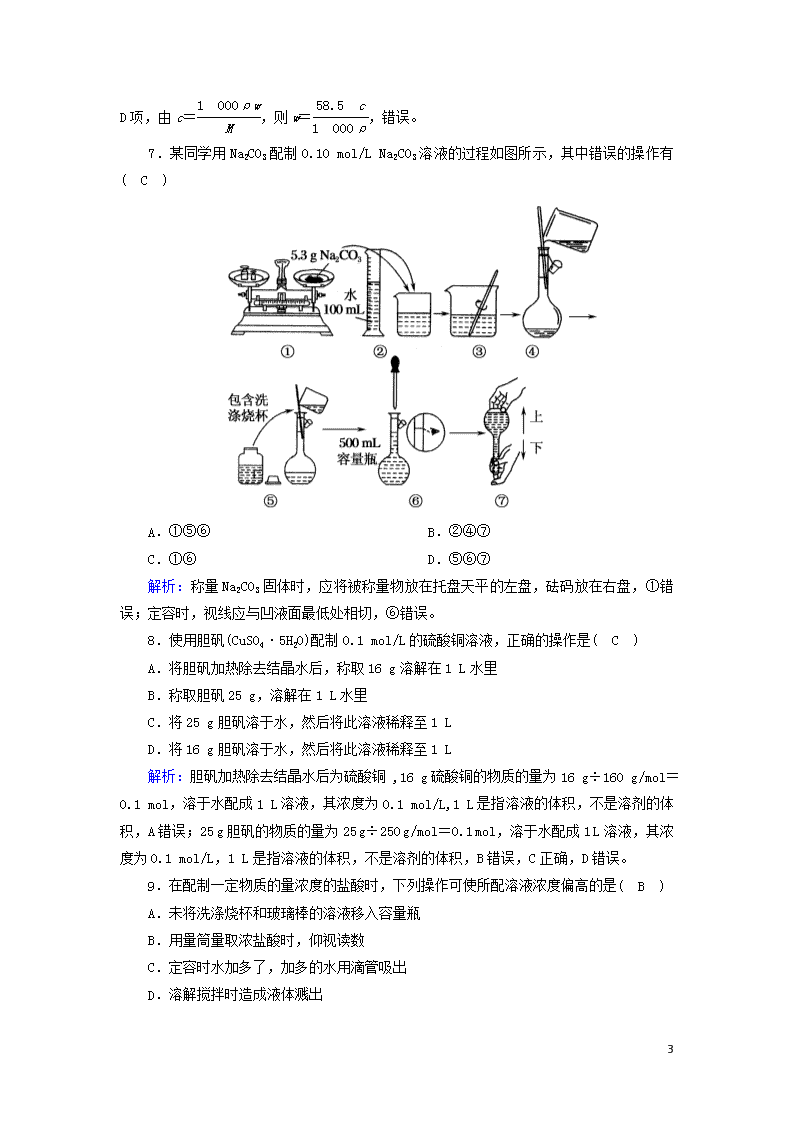
课时作业8 溶液的配制和分析 时间:45分钟 满分:100分 一、选择题(每小题4分,共48分) 1.在容量瓶的使用方法中,下列操作不正确的是( C ) A.使用容量瓶前检查它是否漏液 B.容量瓶用蒸馏水洗净后,配制溶液不需要干燥 C.配制溶液时,如果试样是固体,把称好的试样用纸槽小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管加蒸馏水到刻度线 D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶颠倒摇匀多次 解析:使用容量瓶前必须检查其是否漏液,选项A正确;容量瓶用蒸馏水洗净后,因为配制溶液过程中需加水,所以不需要干燥,选项B正确;容量瓶不能用来溶解固体溶质,选项C不正确;定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶反复上下颠倒,摇匀,选项D正确。 2.下列溶液中,物质的量浓度为1 mol·L-1的是( B ) A.将40 g NaOH溶于1 L水所得的溶液 B.将80 g SO3溶于水并配成1 L的溶液 C.将0.5 mol·L-1 NaNO3溶液100 mL加热蒸发掉50 g水的溶液 D.含K+ 2 mol的K2SO4溶液 解析:要想知道溶质的物质的量浓度必须要确定溶质的物质的量与溶液的体积。A、C、D三项溶液的体积不能确定;B项中SO3溶于水生成H2SO4恰好为1 mol,溶液的体积为1 L,故c(H2SO4)=1 mol·L-1。 3.设NA为阿伏加德罗常数的值,下列对于0.3 mol/L的硫酸钾溶液的说法中不正确的是( C ) A.1 L溶液中含有0.6NA个钾离子 B.1 L溶液中含有钾离子和硫酸根离子总数为0.9NA C.2 L溶液中钾离子浓度为1.2 mol/L D.2 L溶液中含有硫酸根离子0.6NA个 解析:C项,2 L溶液中钾离子浓度为0.6 mol/L,错误。 4.下列关于物质的量浓度表述正确的是( D ) A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO的总物质的量为0.9 mol B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 7 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1 C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO的物质的量相等,则K+和Cl-的物质的量浓度一定相同 D.10 ℃时,0.35 mol·L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1 解析:A项中,没有指明溶液的体积,故溶液中Na+和SO的总物质的量不一定等于0.9 mol。B项中,虽然强调了氨水的体积为1 L,而不是溶剂为1 L,但是没有指明22.4 L的氨气是标准状况下的气体,则氨气的物质的量不一定是1 mol,制成1 L溶液时,浓度也不一定是1 mol·L-1。C项中,当Na+与SO的物质的量浓度相等时,根据化学式中K+与SO,Na+与Cl-的比例关系,c(K+)c(Cl-)=21。D项中,对于10 ℃时0.35 mol·L-1的KCl饱和溶液,蒸发水分后,必析出KCl晶体,温度恢复到10 ℃时,仍为饱和溶液,故浓度不变。D项正确。 5.在0.5 L由KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1 mol/L,c(Mg2+)=0.25 mol/L,c(NO)=0.2 mol/L,则往混合溶液中滴加足量的AgNO3后产生的沉淀的物质的量为( B ) A.0.15 mol B.0.20 mol C.0.25 mol D.0.40 mol 解析:根据电荷守恒:c(K+)+2c(Mg2+)=c(NO)+c(Cl-),可得c(Cl-)=0.4 mol/L,n(Cl-)=0.4 mol/L×0.5 L=0.20 mol,由反应Ag++Cl-===AgCl↓,可得产生氯化银沉淀的物质的量为0.20 mol,故选B。 6.已知某饱和氯化钠溶液的体积为V mL,密度为ρ g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中所含NaCl的质量为m g。下列选项正确的是( C ) A.该温度下NaCl的溶解度S= g B.溶液中溶质的物质的量浓度c(NaCl)= mol·L-1 C.溶液中溶质的物质的量浓度c(NaCl)= mol·L-1 D.溶液中溶质的质量分数w=% 解析:A项,饱和溶液中100 gS=(1-w)w,即S= g,错误;B项,c(NaCl)== mol·L-1,错误;C项,c(NaCl)= mol·L-1,正确;D项,由c=,则w=,错误。 7 7.某同学用Na2CO3配制0.10 mol/L Na2CO3溶液的过程如图所示,其中错误的操作有( C ) A.①⑤⑥ B.②④⑦ C.①⑥ D.⑤⑥⑦ 解析:称量Na2CO3固体时,应将被称量物放在托盘天平的左盘,砝码放在右盘,①错误;定容时,视线应与凹液面最低处相切,⑥错误。 8.使用胆矾(CuSO4·5H2O)配制0.1 mol/L的硫酸铜溶液,正确的操作是( C ) A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水里 B.称取胆矾25 g,溶解在1 L水里 C.将25 g胆矾溶于水,然后将此溶液稀释至1 L D.将16 g胆矾溶于水,然后将此溶液稀释至1 L 解析:胆矾加热除去结晶水后为硫酸铜 ,16 g硫酸铜的物质的量为16 g÷160 g/mol=0.1 mol,溶于水配成1 L溶液,其浓度为0.1 mol/L,1 L是指溶液的体积,不是溶剂的体积,A错误;25 g胆矾的物质的量为25 g÷250 g/mol=0.1 mol,溶于水配成1 L溶液,其浓度为0.1 mol/L,1 L是指溶液的体积,不是溶剂的体积,B错误,C正确,D错误。 9.在配制一定物质的量浓度的盐酸时,下列操作可使所配溶液浓度偏高的是( B ) A.未将洗涤烧杯和玻璃棒的溶液移入容量瓶 B.用量筒量取浓盐酸时,仰视读数 C.定容时水加多了,加多的水用滴管吸出 D.溶解搅拌时造成液体溅出 解析: 7 未将洗涤烧杯和玻璃棒的溶液移入容量瓶中,会使溶质减少,浓度偏低,A错误;用量筒量取浓盐酸时,仰视读数,量取的盐酸体积偏大,所配溶液浓度偏高,B正确;定容时水加多了,加多的水用滴管吸出,导致溶质减少,浓度偏低,C错误;溶解搅拌时造成液体溅出,导致溶质减少,浓度偏低,D错误。 10.用如图浓硫酸配制稀硫酸,下列说法正确的是( D ) A.若需要配制200 mL 1.00 mol· L-1的稀硫酸,通过计算后,用10 mL量筒量取9.20 mL浓硫酸 B.浓硫酸与等质量的水混合后冷却,所得溶液的浓度大于9.2 mol·L-1 C.若定容时加水超过刻度线,应用胶头滴管吸出多余的液体 D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁 解析:浓硫酸的浓度是 mol/L=18.4 mol/L,若需要配制200 mL 1.00 mol·L-1的稀硫酸,需要浓硫酸的体积是 mL≈10.9 mL,A错误;浓硫酸与等质量的水混合后冷却,溶液的质量分数变为49%,密度减小,根据c=可知,所得溶液的浓度小于9.2 mol·L-1,B错误;定容时加水超过刻度线,需要重新配制,C错误;向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁,D正确。 11.标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( A ) A.ρ=(17V+22 400)/(22.4+22.4V) B.ω=17c/(1 000ρ) C.ω=17V/(17V+22 400) D.c=1 000Vρ/(17V+22 400) 解析:B项,由物质的量浓度与质量分数之间的关系c=变形可得;C项,ω===;D项,由c===;至于A项,变形后为ρ=,可以看出该项错误的原因在于认为氨水的体积为氨气和水的体积的简单加和。 7 12.实验室中配制100 mL 1.0 mol·L-1 Na2CO3溶液时,下列操作正确的是( D ) A.称取10.6 g Na2CO3固体,加入100 mL容量瓶中,加水溶解、定容 B.称取10.6 g Na2CO3固体,加入100 mL蒸馏水,搅拌、溶解 C.转移Na2CO3溶液时,直接倒入容量瓶中 D.定容后,塞好瓶塞,反复上下颠倒、摇匀 解析:10.6 g Na2CO3固体应放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌溶解,不能直接加入100 mL容量瓶中,溶解、冷却后的溶液要用玻璃棒引流转入容量瓶中,然后用少量蒸馏水洗涤烧杯内壁和玻璃2~3次,并把洗涤液都转入容量瓶中。溶解及洗涤所用蒸馏水的总体积不能超过100 mL。加蒸馏水定容后,塞好瓶塞,反复上下颠倒、摇匀。 二、非选择题(共52分) 13.(12分)标准状况下,11.2 L HCl气体溶于水形成500 mL溶液。 (1)所得盐酸的物质的量浓度为1_mol·L-1。 (2)向其中加入20.0 g NaOH才能中和完全。 (3)若不考虑加入NaOH对体积造成的影响,所得NaCl的物质的量浓度为1_mol·L-1。 (4)再向其中至少加入200 mL,密度为1.7 g·cm-3,质量分数为25%的AgNO3溶液可使Cl-完全沉淀。 解析:(1)标准状况下,11.2 L HCl的物质的量为0.5 mol,故其浓度为=1 mol·L-1。(2)中和含0.5 mol HCl的盐酸需0.5 mol NaOH,质量为20.0 g。(3)所得NaCl与原HCl的物质的量相等,则浓度也相等。(4)至少加入AgNO3的物质的量为0.5 mol,设所需该AgNO3溶液的体积为V L,则n(AgNO3)===0.5,得V=0.2。 14.(9分)常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O(相对分子质量为250),恰好达到饱和,该溶液密度为1.21 g/cm3,求: (1)该溶液中溶质电离出的阴、阳离子的总物质的量为0.1_mol。 (2)该溶液中CuSO4的物质的量浓度为1.5_mol/L。 (3)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是30 mL。 解析:n(CuSO4)==0.05 mol,所以阴、阳离子的总物质的量为0.05 mol×2=0.1 mol;因为溶液体积V==33 mL, 故c(CuSO4)==1.5 mol/L; 据稀释规律得20.0 mL×1.5 mol/L=1.00 mol/L·V′, 7 所以V′=30 mL。 15.(15分)某化学实验小组需用480 mL 0.5 mol/L的硫酸铜溶液,请回答下列问题: (1)如果用胆矾(CuSO4·5H2O)来配制,需用胆矾的质量为62.5 g。 (2)下面是配制硫酸铜溶液过程中的5个操作步骤:①向盛有胆矾的烧杯中加入20 mL蒸馏水使其溶解;②继续往容量瓶中加蒸馏水,至液面距刻度线1~2 cm处;③将烧杯中的溶液沿玻璃棒注入500 mL容量瓶中;④在烧杯中加入少量的蒸馏水,洗涤烧杯内壁和玻璃棒2~3次后移入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;⑤改用胶头滴管加蒸馏水至刻度线,盖好瓶塞,反复上下颠倒,摇匀。正确的操作顺序为①③④②⑤(填序号)。 (3)上述操作中,①、③都用到玻璃棒,其作用分别为搅拌、引流。 (4)下列操作会导致所配硫酸铜溶液物质的量浓度偏低的是①②⑤⑥(填序号,下同);对所配溶液物质的量浓度无影响的是③。 ①在烧杯中搅拌溶液时,有少量液体溅出 ②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线 ③容量瓶使用前未进行干燥 ④所使用的容量瓶刚用某种浓度的硫酸铜溶液润洗过 ⑤定容后,塞好瓶塞摇匀,装入用蒸馏水洗净的试剂瓶中 ⑥没有洗涤溶解时所用的烧杯和玻璃棒 解析:(1)实验室没有480 mL的容量瓶,必须用500 mL的。需要胆矾的质量为0.5 L×0.5 mol/L×250 g/mol=62.5 g。(4)如果所使用的容量瓶刚刚用硫酸铜溶液润洗过,由于有溶质残留,所配硫酸铜溶液的物质的量浓度偏高。 16.(16分)实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL: (1)配制溶液时,一般可以分为以下几个步骤: ①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却 其正确的操作顺序为②①③⑧⑤⑥⑦④。 (2)本实验用到的玻璃仪器有烧杯、玻璃棒、250_mL容量瓶、量筒、胶头滴管(至少回答3个)。 (3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为27.4 g,要完成本实验该同学应称出10.0 g NaOH。 (4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是④ 7 (填序号)。 ①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面 ③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线 ⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线 解析:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,所以正确的顺序为②①③⑧⑤⑥⑦④。(2)该实验操作中一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,冷却后转移到250 mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2 cm时,改用胶头滴管滴加,所以需要的玻璃仪器有烧杯、玻璃棒、250 mL容量瓶、胶头滴管、量筒等。(3)根据天平的称量原理:左盘物质的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为30 g-2.6 g=27.4 g,因配制溶液的体积为240 mL,而容量瓶的规格没有240 mL,故只能选用250 mL的容量瓶,则NaOH质量m=cVM=1.0 mol·L-1×0.25 L×40 g·mol-1=10.0 g。(4)①没有洗涤烧杯和玻璃棒,会导致溶质的物质的量偏小,溶液浓度偏低,故①不选;②转移溶液时不慎有少量洒到容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低,故②不选;③容量瓶不干燥,含有少量蒸馏水,因后续还需要加水定容,故对所配制的溶液浓度无影响,故③不选;④定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故④正确;⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故⑤不选。所以答案选④。 7查看更多