- 2021-07-05 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习常见气体的实验室制法及其性质探究作业
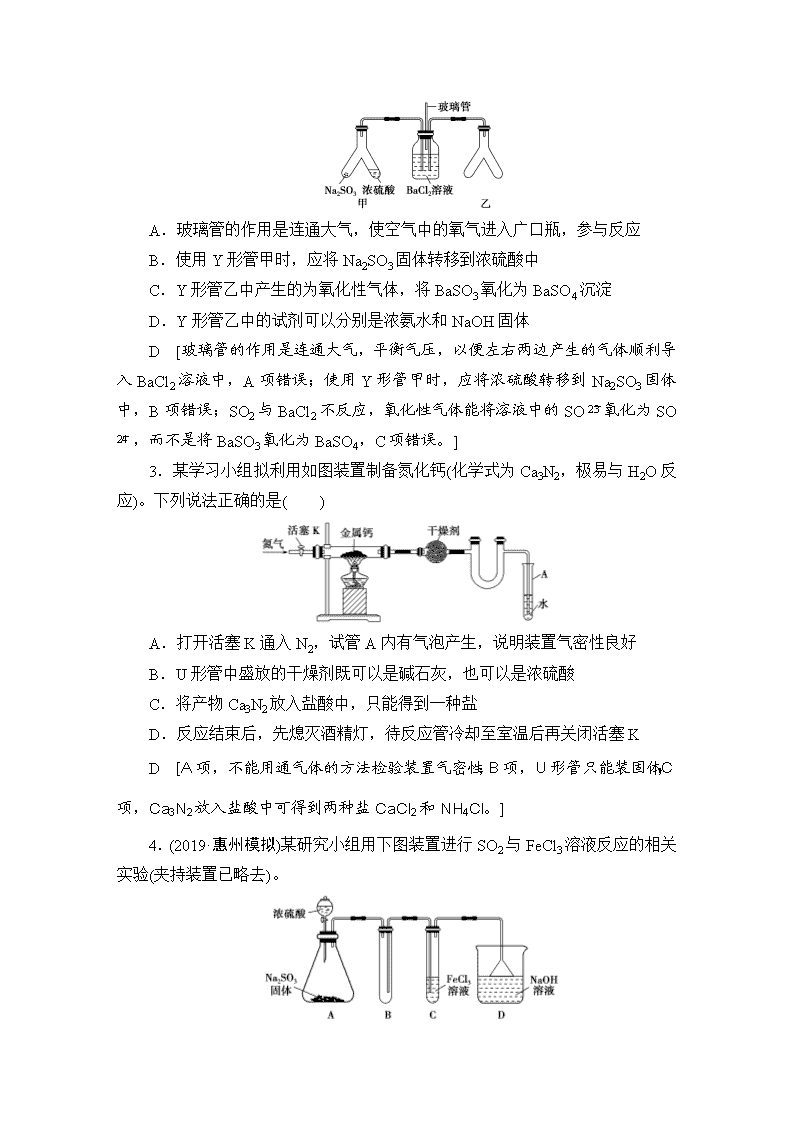
常见气体的实验室制法及其性质探究 (建议用时:35分钟) 1.(2019·郑州模拟)用如图装置制取并收集气体,对应的装置和试剂均正确的是( ) Ⅲ中收集气体 Ⅰ中试剂a、b Ⅱ中试剂c Ⅳ中试剂d A SO2 稀硫酸与铜片 浓硫酸 NaOH溶液 B Cl2 浓盐酸与二氧化锰 饱和氯化钠溶液 NaOH溶液 C HBr 浓硫酸与溴化钠 浓硫酸 水 D CO 甲酸与浓硫酸 浓硫酸 酸性KMnO4溶液 B [铜与稀硫酸不反应,A项错误;浓盐酸与二氧化锰在加热条件下可发生反应:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,制取的Cl2中含有的HCl气体可通过饱和食盐水除去,由于氯气的密度大于空气的密度,可用向上排空气法收集氯气,由于氯气有毒,需用氢氧化钠溶液吸收多余的氯气,B项正确;浓硫酸具有强氧化性,能将HBr氧化为Br2,因此制取和干燥HBr时均不能用浓硫酸,C项错误;CO与酸性高锰酸钾溶液不反应,故不能用酸性高锰酸钾溶液吸收多余的CO气体,CO相对分子质量与空气的相近,不能用排空气法收集,D项错误。] 2.Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。下列判断正确的是( ) A.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应 B.使用Y形管甲时,应将Na2SO3固体转移到浓硫酸中 C.Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀 D.Y形管乙中的试剂可以分别是浓氨水和NaOH固体 D [玻璃管的作用是连通大气,平衡气压,以便左右两边产生的气体顺利导入BaCl2溶液中,A项错误;使用Y形管甲时,应将浓硫酸转移到Na2SO3固体中,B项错误;SO2与BaCl2不反应,氧化性气体能将溶液中的SO氧化为SO,而不是将BaSO3氧化为BaSO4,C项错误。] 3.某学习小组拟利用如图装置制备氮化钙(化学式为Ca3N2,极易与H2O反应)。下列说法正确的是( ) A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好 B.U形管中盛放的干燥剂既可以是碱石灰,也可以是浓硫酸 C.将产物Ca3N2放入盐酸中,只能得到一种盐 D.反应结束后,先熄灭酒精灯,待反应管冷却至室温后再关闭活塞K D [A项,不能用通气体的方法检验装置气密性;B项,U形管只能装固体;C项,Ca3N2放入盐酸中可得到两种盐CaCl2和NH4Cl。] 4.(2019·惠州模拟)某研究小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。 (1)配制氯化铁溶液时,需先把氯化铁晶体溶解在______中,再加水稀释,这样操作的目的是_____________________________________________________ ___________________________________________________________________。 (2)通入足量SO2时,装置C中观察到的现象为__________________________ ___________________________________________________________________。 (3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。 ①写出SO2与FeCl3溶液反应的离子方程式____________________________ ____________________________________________________________________。 ②请设计实验方案检验装置C中有Fe2+生成____________________________ _____________________________________________________________________ ____________________________________________________________________。 ③该小组同学向装置C反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO,该做法____________(填“合理”或“不合理”),理由是______________________________________________________ ___________________________________________________________________。 (4)装置D中倒置漏斗的作用是_____________________________________。 (5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。 a.浓硫酸 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液 [解析] (1)配制FeCl3溶液时,为了抑制Fe3+水解,需先把FeCl3晶体溶解在浓盐酸中,再加水稀释。(2)SO2通入FeCl3溶液中时,SO2表现出还原性,能将Fe3+还原为Fe2+,则装置C中观察到的现象为溶液由棕黄色变为浅绿色。(3)①根据上述分析可知,装置C中发生反应的离子方程式为2Fe3++SO2+2H2O===SO+4H++2Fe2+。②检验装置C中有Fe2+生成的方法为取少量C中反应后的溶液于试管中,滴加酸性KMnO4溶液,现象为KMnO4溶液褪色时说明含有Fe2+,反之无Fe2+。或取少量C中反应后的溶液于试管中,滴加K3[Fe(CN)6]溶液,现象为产生蓝色沉淀时说明含有Fe2+,反之无Fe2+。③加入的HNO3能将溶解的SO2氧化为H2SO4,会干扰实验,故该做法不合理。(4)装置D中倒置漏斗能将SO2尾气充分吸收,且能防止溶液倒吸。(5)要验证SO2 具有还原性,应选择具有较强的氧化性的试剂,且实验过程中有明显的实验现象,b、c项试剂均可代替FeCl3溶液。 [答案] (1)浓盐酸 抑制氯化铁水解 (2)溶液由棕黄色变为浅绿色 (3)①2Fe3++SO2+2H2O===SO+4H++2Fe2+ ②取少量C中反应后的溶液于试管中,向其中滴入酸性高锰酸钾溶液,若褪色,说明有Fe2+,若不褪色,说明没有Fe2+(合理即可) ③不合理 硝酸可以将溶解的SO2氧化为H2SO4,干扰实验 (4)使气体被充分吸收;防止溶液倒吸 (5)bc 5.(2019·桂林模拟)现用下列装置(仪器可重复使用)制备PH3,并证明PH3具有强还原性和热不稳定性。 已知:①标准状况时,PH3是一种无色、微溶于水、有剧毒的气体,具有强还原性,在空气中能自燃; ②白磷(P4)常温下为白色或黄色蜡状固体,不溶于水,在空气中易自燃; ③乙醚是一种易挥发的液体,沸点为34.6 ℃,能溶解白磷。 (1)仪器m的名称为________,装置C名称为________。 (2)实验室用白磷与NaOH浓溶液反应生成NaH2PO2的同时制得PH3,反应的化学方程式为_________________________________________________________ ____________________________________________________________________。 (3)用装置A制取PH3,实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。实验前先微热的目的是__________________________ ____________________________________________________________________。 (4)将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有______性,装置C中发生的化学反应方程式为___________________________, 点燃E处气体的目的为_________________________________________________ ___________________________________________________________________。 (5)将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为A→________→D→________→________→E(在“→”之间的空白处填写装置编号)。能证明PH3分解的气体产物的现象是______________ ___________________________________________________________________。 [解析] (2)NaH2PO2中磷元素为+1价,PH3中磷元素为-3价,根据得失电子守恒,可得到反应方程式为P4+3NaOH(浓)+3H2O3NaH2PO2+PH3↑。(3)乙醚易挥发,实验前微热可生成乙醚蒸气除去装置中的空气,防止P4和PH3自燃。(4)C中溶液黄色变浅,即Fe3+被还原,可证明PH3有还原性;得到白色蜡状固体即生成P4,化学方程式为6Fe2(SO4)3+4PH3===P4↓+12FeSO4+6H2SO4。(5)先由A装置生成PH3,在B装置加热分解,再将产物通过D装置冷却得到P4,然后第一次通过装置C除去PH3,第二次通过装置C检验PH3是否完全除去,然后检验生成的氢气;证明分解生成的是氢气,需先看到第二次通过装置C的溶液不褪色,然后点燃E处气体火焰呈蓝色。 [答案] (1)分液漏斗 洗气瓶 (2)P4+3NaOH(浓)+3H2O3NaH2PO2+PH3↑ (3)排除装置中的空气,防止P4和PH3自燃 (4)还原 6Fe2(SO4)3+4PH3===P4↓+12FeSO4+6H2SO4 防止有毒气体PH3泄漏,污染空气 (5)B C C 第二瓶C中溶液不褪色,点燃E处气体,火焰呈蓝色 6.(2019·湖南各校联考)氯酸钾是一种重要的氧化剂,受热易分解。为充分利用资源,变废为宝,实验室以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下: 回答下列问题: (1)加热下氯化过程发生反应的化学方程式为__________________________ ___________________________________________________________________。 (2)用如图装置制备Cl2,为保证氯化过程中Cl2反应充分,制Cl2 时应采取的措施是_______________________________________________________________ ___________________________________________________________________, 导气口n后所连接装置合适的是________。 (3)操作2包含一系列实验操作,主要为________→降温结晶→过滤→洗涤→低温干燥。 (4)如图是制备过程中处理尾气的部分装置。 ①B中溶液为______________。 ②A中装有蒸馏水,查阅资料可知次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。请设计实验方案测定A中氯元素含量________________________ ____________________________________________________________________。 [解析] (1)加热下氯化过程发生反应的化学方程式为6Cl2+6Ca(OH)2Ca(ClO3)2+5CaCl2+6H2O。 (2)为保证氯化过程中Cl2反应充分,可通过控制该装置中滴液漏斗的活塞来控制加入浓盐酸的速率,从而控制Cl2的产生速率,导气口n后应连接c或d装置。(3)从后续“降温结晶”可知之前的操作为“蒸发浓缩”。(4)①用碱性溶液吸收Cl2,故B中可盛装NaOH溶液。②Cl2部分溶于蒸馏水生成HClO和HCl,要测定A中氯元素的含量,首先需将HClO、Cl2还原为Cl-,再加入AgNO3溶液,通过测定生成的AgCl的量来测定氯元素含量,因Ag2SO4为沉淀,FeCl2会引入氯元素,干扰实验结果,故应选用H2O2进行还原。 [答案] (1)6Cl2+6Ca(OH)2Ca(ClO3)2+5CaCl2+6H2O (2)控制活塞将浓盐酸缓慢而均匀地滴入三颈烧瓶中 cd (3)蒸发浓缩 (4)①氢氧化钠溶液 ②量取一定量A中溶液于试管中,加入足量的H2O2溶液,充分振荡;加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,过滤、洗涤沉淀,干燥后称量沉淀质量 7.(2019·黄冈模拟)某校化学兴趣小组在实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图: 实验步骤如下: (1)制备NH4SCN溶液:CS2+2NH3NH4SCN+H2S。该反应比较缓慢。 ①实验前,应进行的操作是________________。三颈烧瓶内盛有CS2、水和催化剂,三颈烧瓶的下层液体CS2必须浸没导气管口,目的是______________。 ②实验开始时,打开K1,加热装置A、D,缓缓地向装置D中充入气体,装置A中的物质是____________________(以化学式表示),装置C的作用可能是___________________________________________________________________。 (2)制备KSCN溶液:移去A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是________________ __________________________________________________________________。 (3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、________、过滤、干燥,得到硫氰化钾晶体。 [解析] (1)①对于有气体参与的实验过程,实验前应进行装置的气密性检查。制备NH4SCN是利用NH3和CS2的反应,三颈烧瓶的下层液体CS2浸没导气管口,可使NH3和CS2充分接触,又由于NH3易溶于水,下层液体CS2浸没导气管口还可防止发生倒吸。②装置A为NH3的发生装置,通过加热固体制备氨气,故装置A中反应物为NH4Cl、Ca(OH)2 。可通过观察装置C中气泡速率来控制加热温度,从而控制氨气的流速。(2)D中NH3和CS2反应生成NH4SCN,向三颈烧瓶中滴入KOH溶液并进行水浴加热,NH4SCN和KOH发生反应:NH4SCN+KOHKSCN+NH3↑+H2O。 (3)由KSCN溶液得到KSCN晶体的操作为减压蒸发浓缩,冷却结晶,过滤,干燥。 [答案] (1)①检查装置的气密性 使反应物充分接触、防止发生倒吸 ②NH4Cl、Ca(OH)2 观察气泡速率、控制加热温度 (2)NH4SCN+KOHKSCN+NH3↑+H2O (3)冷却结晶 8.NH4NO3热分解十分复杂。在一定条件下:3NH4NO32NH3↑+2NO↑+2NO2↑+3H2O(不考虑2NO2N2O4),现要选用下列装置(部分夹持装置省略),通过实验验证反应产物: 已知:①液化温度:NO2(21 ℃)、NO(-152 ℃); ②NH3与灼热的氧化铜反应得到N2和Cu; ③在无催化剂的条件下NOx不能与灼热的铜反应; ④NO2能使湿润的淀粉碘化钾试纸变蓝。 (1)所选择装置的连接顺序(按左→右连接,填各装置数字)为⑧→________→________→________→④→③→②→⑤。 (2)实验开始应先向装置⑧中通入_________________________________, 再______________。 (3)为验证NO,可在③中通入____________________________________。 (4)装置⑤的作用是_____________________________________________。 [解析] ⑧为加热装置,由题意3NH4NO32NH3↑+2NO↑+2NO2↑+3H2O,为了更好地检验产物中是否含有NO,在加热前先通入一定量的N2,排净装置中的空气(或O2)。加热得到NH3、NO、NO2和H2O,利用装置⑦中无水硫酸铜检验生成的水,装置⑥吸收水蒸气,装置①检验NO2,装置④使二氧化氮液化,二氧化氮气体变成液态,装置③中通入一定量的氧气,无色气体变成红棕色,说明含有NO气体,装置②中NH3与CuO在加热的条件下反应得到N2、Cu和H2O,装置⑤尾气处理,防止污染空气,所以装置的连接顺序为⑧→⑦→⑥→①→④→③→②→⑤。 [答案] (1)⑦ ⑥ ① (2)一定量的N2 点燃酒精灯(或加热) (3)一定量的氧气 (4)尾气处理,防止污染空气查看更多