- 2021-07-05 发布 |
- 37.5 KB |
- 15页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北省2020届高三化学全国1卷模拟试卷20
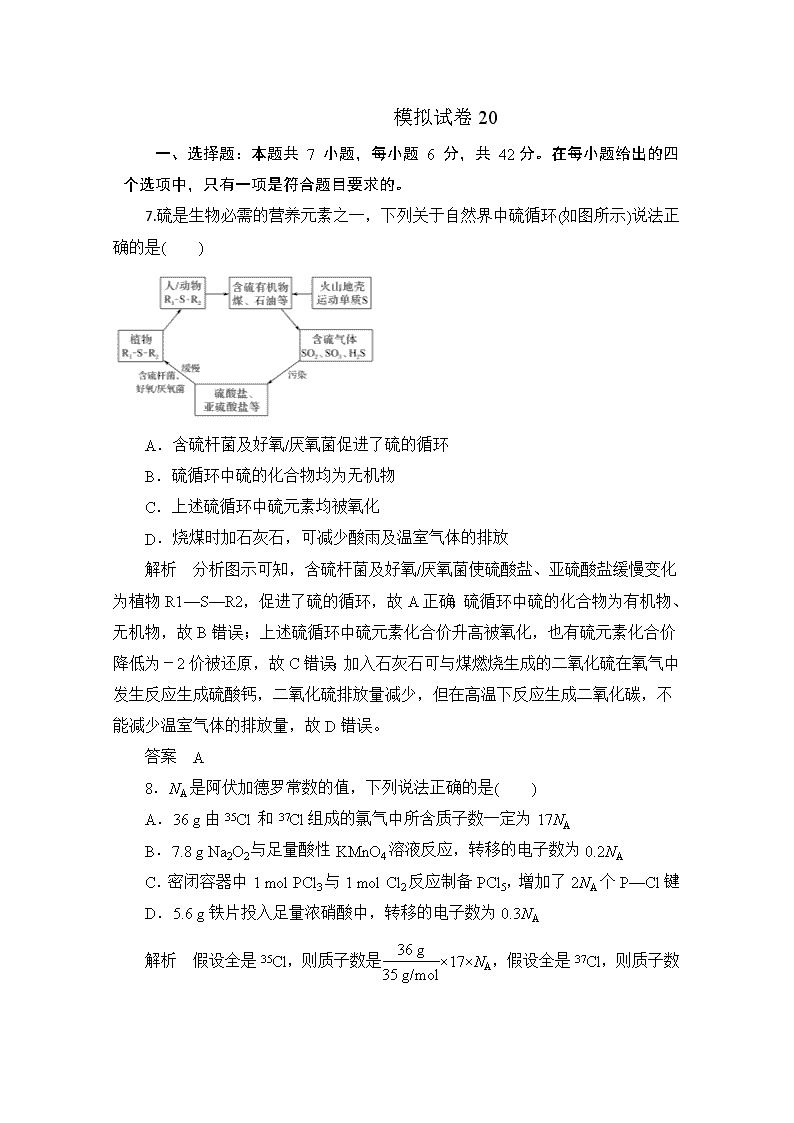
模拟试卷 20 一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的四 个选项中,只有一项是符合题目要求的。 7.硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正 确的是( ) A.含硫杆菌及好氧/厌氧菌促进了硫的循环 B.硫循环中硫的化合物均为无机物 C.上述硫循环中硫元素均被氧化 D.烧煤时加石灰石,可减少酸雨及温室气体的排放 解析 分析图示可知,含硫杆菌及好氧/厌氧菌使硫酸盐、亚硫酸盐缓慢变化 为植物 R1—S—R2,促进了硫的循环,故 A 正确;硫循环中硫的化合物为有机物、 无机物,故 B 错误;上述硫循环中硫元素化合价升高被氧化,也有硫元素化合价 降低为-2 价被还原,故 C 错误;加入石灰石可与煤燃烧生成的二氧化硫在氧气中 发生反应生成硫酸钙,二氧化硫排放量减少,但在高温下反应生成二氧化碳,不 能减少温室气体的排放量,故 D 错误。 答案 A 8.NA 是阿伏加德罗常数的值,下列说法正确的是( ) A.36 g 由 35Cl 和 37Cl 组成的氯气中所含质子数一定为 17NA B.7.8 g Na2O2 与足量酸性 KMnO4 溶液反应,转移的电子数为 0.2NA C.密闭容器中 1 mol PCl3 与 1 mol Cl2 反应制备 PCl5,增加了 2NA 个 P—Cl 键 D.5.6 g 铁片投入足量浓硝酸中,转移的电子数为 0.3NA 解析 假设全是 35Cl,则质子数是 36 g 35 g/mol×17×NA,假设全是 37Cl,则质子数 是 36 g 37 g/mol×17×NA,36 g 由 35Cl 和 37Cl 组成的氯气中所含质子数不一定为 17NA, 故 A 错误;Na2O2 与足量酸性 KMnO4 溶液反应,Na2O2 只作还原剂,过氧化钠中 氧元素化合价由-1 升高为 0,1 mol 过氧化钠转移 2 mol 电子 ,所以 7.8 g Na2O2 与足量酸性 KMnO4 溶液反应,转移的电子数为 0.2NA,故 B 正确;PCl3 与 Cl2 反 应制备 PCl5 的反应可逆,密闭容器中 1 mol PCl3 与 1 mol Cl2 反应制备 PCl5,生成 PCl5 小于 1 mol, P—Cl 键增加小于 2NA 个,故 C 错误;常温下,铁在浓硝酸中钝 化,故 D 错误。 答案 B 9. 某小组设计如图所示装置(夹持装置略去),在实验室模拟侯氏制碱工艺中 NaHCO3 的制备。下列说法不正确的是( ) A.③、⑤中可分别盛放饱和食盐水和浓氨水 B.应先向③中通入足量 NH3,再通入足量 CO2 C.③中反应的离子方程式为 NH3+CO2+H2O===NH+4 +HCO-3 D.装置①也可用于制 H2 解析 A.③、⑤中可分别盛放饱和食盐水和浓氨水,故 A 正确;B.NH3 在 水中溶解度大,应先向③中通入足量 NH3,再通入足量 CO2,故 B 正确;C.③中 反应 NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,离子方程式为 Na++NH3+ CO2+H2O===NH+4 +NaHCO3↓,故 C 错误;D.制二氧化碳是固体与液体反应,不 加热,条件与制氢气相符,装置①也可用于制 H2,故 D 正确。 答案 C 10.对实验室制得的粗溴苯[含溴苯(不溶于水,易溶于有机溶剂,沸点 156.2 ℃)、Br2 和苯(沸点 80 ℃)]进行纯化,未涉及的装置是( ) 答案 C 解析 除去 Br2 可以用 SO2,原理是:Br2+SO2+2H2O===H2SO4+2HBr,故 A 正确;苯和溴苯的混合液与无机溶液互不相溶,分液可得苯和溴苯的混合液, 故 B 正确;由分析可知,不涉及过滤操作,故 C 错误;溴苯的沸点是 156.2 ℃、 苯的沸点是 80 ℃,分离出溴苯用蒸馏法,故 D 正确。 11.短周期元素 W、X、Y、Z 的原子序数依次增加,由这些元素组成的常见物 质的转化关系如图所示,其中 a、b、d、g 为化合物,a 为淡黄色固体,c 是 Z 的 单质,该单质能与沸水反应,且该单质可制造照明弹,f 为固体单质。下列有关说 法正确的是( ) A.简单离子半径:Y>Z>X B.元素的非金属性:W>X C.最高价氧化物对应水化物的碱性:Y>Z D.X、Y 两种元素组成的化合物只含离子键 解析 a 为淡黄色固体,且为常见化合物,故 a 为 Na2O2,c 能与沸水反应, 还可制造照明弹,故 c 为 Mg 单质,即 Z 为 Mg,Y 为 Na;f 为固体单质,根据图 中各物质的转化关系可知 f 为 C 单质,故 W 为 C,X 为 O;转化关系图中 b 为 CO2, d 为 Na2CO3,e 为 O2,g 为 MgO。简单离子半径 O2->Na+>Mg2+,A 项错误; 非金属性 C<O,B 项错误;NaOH 的碱性比 Mg(OH)2 的强,C 项正确;O、Na 可 组成 Na2O、Na2O2,前者只含离子键,后者含离子键和共价键,D 项错误。 答案 C 12.大阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M 电极材料是金属 锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导 Li+的高分子材 料,隔膜只允许 Li+通过,电池反应式为 LixC6+Li1﹣x FepO4 LiFePO4+6C.下 列说法正确的是( ) A.放电时 Li+从左边移向右边,PO43﹣从右边移向左边 B.放电时,正极反应式为:Li1﹣xFePO4+xLi++xe﹣=LiFePO4 C.充电时 M 极连接电源的负极,电极反应为 6C+xe﹣=C6x﹣ D.充电时电路中通过 2.0mol 电子,产生 7.0gLi 解析:A.放电时,阳离子向正极移动,隔膜只允许 Li+通过,所以 Li+从左边 移向右边,PO43﹣不发生移动,故 A 错误;B.放电时,M 电极上失电子发生氧化 反应,N 电极上得电子发生还原反应,正极反应式为 Li1﹣xFePO4+xLi++xe﹣= LiFePO4,故 B 正确;C.充电时 M 为阴极,连接原电池负极,该电极上得电子发 生还原反应,电极反应式为 6C+xLi++xe﹣=LixC6,故 C 错误;D.充电时,没有 Li 单质生成,故 D 错误; 故选:B。 13. 25℃ 时 , H2CO3 的 Kal=4.2×10-7 , Ka2=5.6×10-11 . 室 温 下 向 10mL 0.1mo1•L-1Na2CO3 溶液中逐滴加入 0.1mo1•L-1HCl 溶液.如图是溶液中含碳 元素微粒物质的量分数随 pH 降低而变化的图象(CO2 因有逸出未画出).下列说 法错误的是( ) A. A 点所示溶液的 B. B 点所示溶液: C. A 点 点发生反应的离子方程式为 D. 分步加入酚酞和甲基橙,用滴定法可测定 与 混合物的组成 解析:A.A 点 c(HCO3-)=c(CO32-),Ka2= =5.6×10-11,则 c (H+)=5.6×10-11mol/L,所以 pH<11,故 A 正确;B.室温下向 10mL0.1mo1•L-1Na2CO3 溶液中逐滴加入 0.1mo1•L-1HCl 溶液,B 点溶液中钠离子 的物质的量浓度是含碳粒子的浓度的 2 倍,即 c(Na+)=2c(HCO3-)+2c(CO32-) +2c(H2CO3),故 B 错误;C.A 点→B:CO32-逐渐减少,HCO3-逐渐增加,所以 发生反应的离子方程式为 CO32-+H+═HCO3-,故 C 正确;D.1Na2CO3 溶液中逐滴 加入 HCl,用酚酞作指示剂,滴定产物是 NaHCO3,用甲基橙作指示剂滴定时 NaHCO3 与 HCl 反应产物是 H2CO3,所以分步加入酚酞和甲基橙,用滴定法可测 定 Na2CO3 与 NaHCO3 混合物的组成,故 D 正确。 故选:B。 二、非选择题:共 58 分。第 26~28 题为必考题,每个试题考生都必须作答。 第 35 题~第 36 题为选考题,考生根据要求作答。 26.(2019·沈阳模拟)氯化亚锡用途广泛,在无机工业中用作还原剂。在口腔 护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某 研究小组制取二水氯化亚锡的工艺流程如图 1 所示: 图 1 查阅资料: Ⅰ.酸性条件下,锡在水溶液中有 Sn2+、Sn4+两种主要存在形式,Sn2+易被氧 化。 Ⅱ.SnCl2 易水解生成碱式氯化亚锡。 回答下列问题: (1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味, 生 成 偏 锡 酸 (H2SnO3) , 写 出 该 反 应 的 化 学 方 程 式 ___________________________________________。 (2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是 __________________________________________________________________ ______。 (3)在制备二水氯化亚锡时,温度对锡的转化率的影响如图 2 所示,则该反应 需控制的温度范围为__________℃。 (4)反应原料中盐酸浓度对产品结晶率的影响如图 3 所示,则盐酸浓度应控制 的 范 围 为 ____________________ , 原 因 是 _____________________________________________。 (5) 反 应 釡 中 发 生 反 应 的 化 学 方 程 式 为 ___________________________________________。 (6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应): ①将该试样溶于盐酸,发生反应为 Sn+2HCl===SnCl2+H2↑; ②加入过量 FeCl3 溶液; ③用已知浓度的 K2Cr2O7 溶液滴定②中生成的 Fe2+,则反应的离子方程式为 ______________________________________________________________________ __。 (7)取 1.125 g 锡粉,经上述各步反应后, 共用去 0.100 0 mol·L -1 K2Cr2O7 溶 液 30.00 mL,锡粉中锡的质量分数为________。 解析:(1)根据题中信息和元素守恒可知,有强烈的刺激性气味的气体为 HCl, 则反应的化学方程式为 SnCl4+3H2O===H2SnO3+4HCl。(2)熔融金属锡,泼入冷水 后激成锡花,目的是增大锡与 Cl2 反应的接触面积,利于反应进行。(3)从题图 2 可 看出制备二水氯化亚锡时,温度在 60~95 ℃时,锡的转化率均很高,故该反应需 控制的温度范围为 60~95 ℃。(4)结合题图 3 可知,盐酸的浓度在 1%~3%时,产 品结晶率可达 98%左右;盐酸的浓度太低时,SnCl2 易水解生成碱式氯化亚锡;而 盐酸的浓度大于 3%时,产品结晶率降低,故盐酸的浓度应控制在 1%~3%。(5)结 合题图 1 可知,SnCl4 与 Sn 在反应釡中反应生成 SnCl2,该反应的化学方程式为 Sn+ SnCl4===2SnCl2。(6)K2Cr2O7 与 Fe2+发生氧化还原反应生成 Fe3+和 Cr3+,其离子 方程式为 Cr2O2-7 +6Fe2++14H+===2Cr3++6Fe3++7H2O。(7)根据(6)中①②③ 可得出对应关系,即 Sn~SnCl2、SnCl2~2FeCl3 和 Cr2O2-7 ~6Fe2+,从而得出关系 式 3Sn~6Fe2+~Cr2O2-7 ,结合消耗 0.100 0 mol·L-1 K2Cr2O7 溶液 30.00 mL,可 求出试样中的 m(Sn)=3×119 g·mol-1×0.100 0 mol·L-1×30.00×10-3 L=1.071 g,则 该锡粉中锡的质量分数为1.071 g 1.125 g×100%=95.2%。 答案:(1)SnCl4+3H2O===H2SnO3+4HCl (2)增大反应接触面积,利于反应进行 (3)60~95 (4)1%~3% 盐酸浓度太低,SnCl2 易水解生成碱式氯化亚锡,盐酸浓度大于 3%时,产品结晶率降低(合理即可) (5)Sn+SnCl4===2SnCl2 (6)Cr2O2-7 +6Fe2++14H+===2Cr3++6Fe3++7H2O (7)95.2% 27.(2019·郑州质检)钴的某些化合物与铁的化合物性质相似,某研究性学习 小组为探究钴的化合物的性质,进行了以下实验: Ⅰ.探究草酸钴的热分解产物 (1)为探究草酸钴的热分解产物,按气体流动方向,各装置的连接顺序为: A→E→________________。 (2) 能 证 明 分 解 产 物 中 有 CO 的 实 验 现 象 是 ___________________________________。 (3)取 3.66 g CoC2O4·2H2O 于硬质玻璃管中加热至恒重,冷却、称量,剩余固 体的质量为 1.5 g,球形干燥管增重 0.88 g。则 A 中发生反应的化学方程式为 ___________________________ __________________________________________________________________ ______。 Ⅱ.探究 Co(OH)2 的还原性及 Co(OH)3 的氧化性 取 A 装置所得固体溶解于稀 H2SO4 中得到粉红色溶液,备用。 已知试剂颜色:CoSO4 溶液(粉红色),Co(OH)2(粉红色),Co(OH)3(棕褐色)。 实验记录如表: 实验操作及现象 实验分析 实验 1 取少许粉红色溶液于试管中,滴 加 0.1 mol·L -1 NaOH 溶液,生成粉 红色沉淀,并将该沉淀分成两份 实验 2 取一份实验 1 中所得的粉红色 沉淀,加入 3%的 H2O2 溶液,粉红色 沉淀立即变为棕褐色 反应的化学方程式为 ____________________________ ____________________________ _______ 实验 3 向实验 2 得到的棕褐色沉淀中 滴加浓盐酸,固体逐渐溶解,并有黄 绿色气体产生 反应的离子方程式为 ____________________________ ____________________________ ________ 实验 4 取另一份实验 1 中所得的粉红 色沉淀,滴加浓盐酸,粉红色沉淀溶 解,未见气体生成 酸性条件下,Cl2、Co(OH)2、 Co(OH)3 的氧化能力由大到小的 顺序是 ____________________________ ____________________________ _____ 解析:Ⅰ.(1)本实验的目的为探究草酸钴的热分解产物,由于 CO 可与氧化铜 在加热的条件下发生氧化还原反应生成铜和 CO2,故可将产生的气体通过灼热的 氧化铜来判断 CO 是否存在,可通过碱石灰的质量变化来分析 CO2 是否存在,由 于 CO 与氧化铜反应也生成了 CO2,故应先检验 CO2 是否存在,再检验 CO 是否存 在,故装置的连接顺序为 A→E→C→D→B。(2)如果分解产物中有 CO 气体,则 D 装置中发生反应 CuO+CO ===== △ Cu+CO 2 ,黑色 CuO 变为红色的铜。(3)3.66 g CoC2O4·2H2O 为 0.02 mol,根据钴元素守恒,可知剩余的 1.5 g 固体为 0.02 mol CoO, 球形干燥管增加的质量即为 CO2 质量,即 CO2 的物质的量为 0.02 mol,根据碳元 素守恒,还应生成 0.02 mol CO,由各物质的量的关系可得出 A 中发生反应的化学 方程式为 CoC2O4·2H2O =====890~920 ℃ CoO+CO↑+CO2↑+2H2O↑。 Ⅱ.A 装置中所得固体为 CoO,与稀硫酸反应生成粉红色 CoSO4 溶液;CoSO4 溶液与 NaOH 溶液反应生成粉红色的 Co(OH)2 沉淀;由实验 2 知 Co(OH)2 与 H2O2 反应生成棕褐色的 Co(OH)3,化学方程式为 2Co(OH)2+H2O2===2Co(OH)3。由实 验 3 知,Co(OH)3 可将浓盐酸中的 Cl-氧化为黄绿色的氯气,离子方程式为 2Co(OH)3+6H++2C1-===Cl2↑+2Co2++6H2O。由实验 4 知 Co(OH)2 与浓盐酸不 能发生氧化还原反应;根据实验 3 和实验 4 可知,酸性条件下,Cl2、Co(OH)2、 Co(OH)3 的氧化能力由大到小的顺序为 Co(OH)3>Cl2>Co(OH)2。 答案:Ⅰ.(1)C→D→B (2)D 装置中 CuO 由黑色变红色 (3)CoC2O4·2H2O =====890~920 ℃ CoO+CO↑+CO2↑+2H2O↑ Ⅱ.2Co(OH)2+H2O2===2Co(OH)3 2Co(OH)3+6H++2Cl-===Cl2↑+2Co2++ 6H2O Co(OH)3、Cl2、Co(OH)2 或 Co(OH)3>Cl2>Co(OH)2 28.(2019·安徽省 A10 联盟高三下学期开年考试理综,28)已知 NH3、NO、NO2 都是有毒气体,必须经过严格处理,否则会污染空气。请回答下列问题: (1)已知如下热化学方程式: ①N2(g)+O2 (g)===2NO(g) ΔH1=+a kJ/mol; ②4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=b kJ/mol ③2NO(g)+O2(g)===2NO2(g) ΔH3=c kJ/mol; 则 4NH3(g)+7O2(g)===4NO2(g)+6H2O(g) ΔH=________kJ/mol。 (2)工业合成 NH3 的反应,解决了世界约三分之一的人粮食问题。已知:N2+ 3H22NH3,且该反应的 v 正=k 正·c(N2)·c3(H2),v 逆=k 逆·c2(NH3),则反应 1 2N2+ 3 2H2NH3 的平衡常数 K=________(用 k 正和 k 逆表示)。 (3)已知合成氨的反应升高温度平衡常数会减小,则该反应的正反应活化能 E1 和逆反应活化能 E2 的相对大小关系为:E1________E2。(填“>”、“<”或“=”)。 (4)从化学反应的角度分析工业合成氨气采取 30 MPa~50 MPa 高压的原因是 __________________________。 (5)500 ℃时,向容积为 2 L 的密闭容器中通入 1 mol N2 和 3 mol H2,模拟合成 氨的反应,容器内的压强随时间的变化如下表所示: 时间/min 0 10 20 30 40 +∞ 压强/MPa 20 17 15 13.2 11 11 ①达到平衡时 N2 的转化率为________。 ②用压强表示该反应的平衡常数 Kp=________(Kp 等于平衡时生成物分压幂 的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量 分数)。 ③随着反应的进行合成氨的正反应速率与 NH3 的体积分数的关系如下图所示, 若升高温度再次达到平衡时,可能的点为________(从点“A、B、C、D”中选择) 解析 (1)根据盖斯定律分析,①N2(g)+O2 (g)===2NO(g) ΔH1=+a kJ/mol; ②4NH3(g) + 3O2(g)===2N2(g) + 6H2O(g) ΔH2 = b kJ/mol ; ③2NO(g) + O2(g)===2NO2(g) ΔH3=c kJ/mol;将方程式进行②+①×2+③×2 计算,得热化 学方程式为 4NH3(g)+7O2(g)===4NO2(g)+6H2O(g) ΔH=(b+2a+2c) kJ/mol;(2) 当正、逆反应速率相等时,反应到平衡,即 v 正=v 逆=k 正·c(N2)·c3(H2)=k 逆·c2(NH3) , 则反应 1 2N2+3 2H2NH3 的平衡常数 K= c2(NH3)/c(N2)·c3(H2)= k正 k逆;(3) 已知合成氨的反应升高温度平衡常数会减小,则说明升温平衡逆向移动,正反应 为放热反应,则该反应的正反应活化能 E1 和逆反应活化能 E2 的相对大小关系为: E1查看更多
相关文章
- 当前文档收益归属上传用户