- 2021-07-05 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习(山东专用)化学能与热能学案
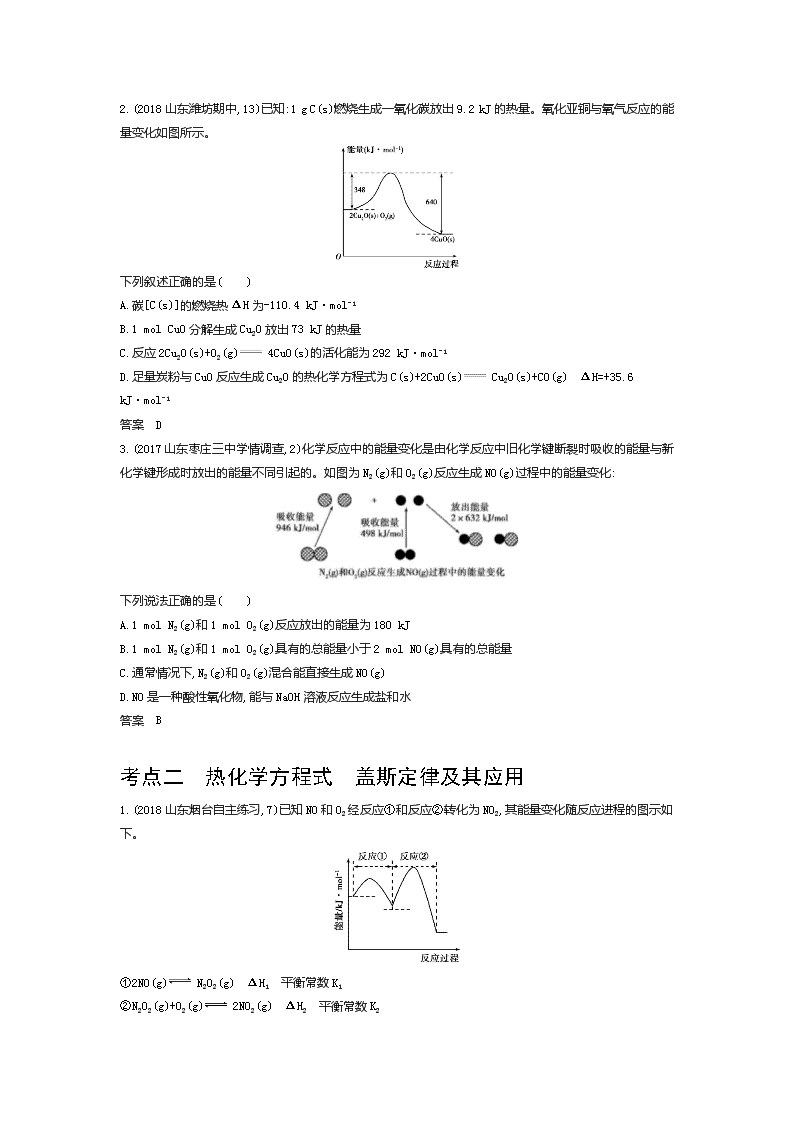
专题五 化学能与热能 挖命题 【考情探究】 考点 内容解读 5年考情 预测热度 考题示例 难度 关联考点 反应热的有关概念 1.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念 2.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用 2018北京理综,7,6分 易 化学平衡 ★☆☆ 热化学方程式 盖斯定律 及其应用 1.了解热化学方程式的含义,能正确书写热化学方程式 2.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算 2018课标Ⅱ,27,14分 2017课标Ⅰ,28,14分 难 化学平衡常数、化学平衡移动原理 ★★★ 分析解读 本专题的主要考点为反应热的有关概念、ΔH的计算、热化学方程式的书写、盖斯定律的应用,其中盖斯定律的应用为高考高频考点。命题形式可以是选择题,也可以是非选择题中的某一设问。随着能源问题的日益突出,高考对本专题的考查仍将维持较高的热度。 【真题典例】 破考点 【考点集训】 考点一 反应热的有关概念 1.(2017山东滕州二中月考,1)下列说法正确的是( ) A.任何化学反应都伴随着能量的变化 B.升高温度或加入催化剂,可以改变化学反应的反应热 C.化学反应中的能量变化都是以热量的形式体现 D.2CO(g)+O2(g) 2CO2(g) ΔH<0,则56 g CO和32 g O2所具有的总能量小于88 g CO2所具有的总能量 答案 A 2.(2018山东潍坊期中,13)已知:1 g C(s)燃烧生成一氧化碳放出9.2 kJ的热量。氧化亚铜与氧气反应的能量变化如图所示。 下列叙述正确的是( ) A.碳[C(s)]的燃烧热ΔH为-110.4 kJ·mol-1 B.1 mol CuO分解生成Cu2O放出73 kJ的热量 C.反应2Cu2O(s)+O2(g) 4CuO(s)的活化能为292 kJ·mol-1 D.足量炭粉与CuO反应生成Cu2O的热化学方程式为C(s)+2CuO(s) Cu2O(s)+CO(g) ΔH=+35.6 kJ·mol-1 答案 D 3.(2017山东枣庄三中学情调查,2)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: 下列说法正确的是( ) A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 C.通常情况下,N2(g)和O2(g)混合能直接生成NO(g) D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 答案 B 考点二 热化学方程式 盖斯定律及其应用 1.(2018山东烟台自主练习,7)已知NO和O2经反应①和反应②转化为NO2,其能量变化随反应进程的图示如下。 ①2NO(g) N2O2(g) ΔH1 平衡常数K1 ②N2O2(g)+O2(g) 2NO2(g) ΔH2 平衡常数K2 下列说法不正确的是( ) A.ΔH1<0,ΔH2<0 B. 2NO(g)+O2(g) 2NO2(g)的平衡常数K=K1/K2 C.表示2NO(g)+O2(g) 2NO2(g)的ΔH=ΔH1+ΔH2 D.反应②的速率大小决定2NO(g)+O2(g) 2NO2(g)的反应速率 答案 B 2.(1)(2018山东烟台自主练习,18)碳及其化合物与人类生产、生活密切相关。请回答下列问题: 羰基硫() 能引起催化剂中毒和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应原理为: ①氢解反应: COS(g)+H2(g) H2S(g)+CO(g) ΔH1 ②水解反应: COS(g)+H2O(g) H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1 已知CO(g)+H2O(g) H2(g)+CO2(g) ΔH3=-42 kJ·mol-1,则ΔH1= 。 (2)(2018山东日照期中,19)氮的化合物在生产、生活中广泛存在。 键能是将1 mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如表所示: 化学键 OO N—N N—H O—H 键能/kJ·mol-1 946 497 193 391 463 写出1 mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式: 。 (3)[2017山东青岛质检一,27(1)]氢气是一种高能燃料,也广泛应用在工业合成中。 标准摩尔生成焓是指在25 ℃和101 kPa时,最稳定的单质生成1 mol化合物的焓变。已知25 ℃和101 kPa时下列反应: ①2C2H6(g)+7O2(g) 4CO2(g)+6H2O(l) ΔH=-3 116 kJ·mol-1 ②C(石墨,s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1 ③2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1 写出乙烷标准摩尔生成焓的热化学方程式: 。 答案 (1) +7 kJ·mol-1 (2)N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-544 kJ·mol-1 (3)2C(石墨,s)+3H2(g) C2H6(g) ΔH=-86.4 kJ·mol-1 炼技法 【方法集训】 方法 利用盖斯定律进行计算的一般步骤 1.(2018山东日照期中,10)已知CaSO4·2H2O脱水过程的热化学方程式如下: CaSO4·2H2O(s) CaSO4·12H2O(s)+32H2O(g) ΔH1=+83.2 kJ·mol-1 CaSO4·12H2O(s) CaSO4(s)+12H2O(g) ΔH2 又知:CaSO4·2H2O(s) CaSO4(s)+2H2O(l) ΔH3=+26 kJ·mol-1 H2O(g) H2O(l) ΔH=-44 kJ·mol-1 则ΔH2为( ) A.+30.8 kJ·mol-1 B.-30.8 kJ·mol-1 C.+61.6 kJ·mol-1 D.-61.6 kJ·mol-1 答案 A 2.(1)(2018山东潍坊期中,18节选)铅及其化合物广泛用于蓄电池、机械制造、电缆防护等行业。 用PbS熔炼铅的过程中会有如下反应发生: 2PbS(s)+3O2(g) 2PbO(s)+2SO2(g) ΔH=a kJ·mol-1 PbS(s)+2O2(g) PbSO4(s) ΔH=b kJ·mol-1 PbS(s)+2PbO(s) 3Pb(s)+SO2(g) ΔH=c kJ·mol-1 写出PbS与PbSO4反应生成Pb和SO2的热化学方程式: 。 (2)(2018山东青岛城阳期中,19节选)已知25 ℃,101 kPa时: 4Fe(s)+3O2(g) 2Fe2O3(s) ΔH=-1 648 kJ·mol-1 C(s)+O2(g) CO2(g) ΔH=-393 kJ·mol-1 4FeCO3(s)+O2(g) 2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1 将铁粉与碳、氧气共同作用可以得到FeCO3,则该反应的热化学方程式为 。 答案 (1)PbS(s)+PbSO4(s) 2Pb(s)+2SO2(g) ΔH= 2(a+c)-3b3 kJ·mol-1 (2)2Fe(s)+3O2(g)+2C(s) 2FeCO3(s) ΔH=-1 480 kJ·mol-1 过专题 【五年高考】 A组 山东省卷、课标卷题组 考点一 反应热的有关概念 考点二 热化学方程式 盖斯定律及其应用 1.(2014课标Ⅱ,13,6分)室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( ) A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3 答案 B 2.(2015课标Ⅱ,27,14分)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g) CH3OH(g) ΔH1 ②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2 ③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3 回答下列问题: (1)已知反应①中相关的化学键键能数据如下: 化学键 H—H C—O CO H—O C—H E/(kJ·mol-1) 436 343 1 076 465 413 由此计算ΔH1= kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3= kJ·mol-1。 (2)反应①的化学平衡常数K表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。 图1 图2 (3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 ;图2中的压强由大到小为 ,其判断理由是 。 答案 (1)-99 +41(每空2分,共4分) (2)K=c(CH3OH)c(CO)·c2(H2)[或Kp=p(CH3OH)p(CO)·p2(H2)](1分) a 反应①为放热反应,平衡常数数值应随温度升高变小(每空1分,共2分) (3)减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;总结果,随温度升高,使CO的转化率降低(1分,2分,共3分) p3>p2>p1 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高(每空2分,共4分) 3.(2017课标Ⅰ,28,14分)近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题: (1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是 (填标号)。 A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B.氢硫酸的导电能力低于相同浓度的亚硫酸 C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1 D.氢硫酸的还原性强于亚硫酸 (2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为 、 ,制得等量H2所需能量较少的是 。 (3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。 ①H2S的平衡转化率α1= %,反应平衡常数K= 。 ②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2 α1,该反应的ΔH 0。(填“>”“<”或“=”) ③向反应器中再分别充入下列气体,能使H2S转化率增大的是 (填标号)。 A.H2S B.CO2 C.COS D.N2 答案 (1)D (2)H2O(l) H2(g)+12O2(g) ΔH=286 kJ·mol-1 H2S(g) H2(g)+S(s) ΔH=20 kJ·mol-1 系统(Ⅱ) (3)①2.5 2.8×10-3 ②> > ③B 4.(2018课标Ⅱ,27,14分)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题: (1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)2CO(g)+2H2(g)。 已知:C(s)+2H2(g) CH4(g) ΔH=-75 kJ·mol-1 C(s)+O2(g) CO2(g) ΔH=-394 kJ·mol-1 C(s)+12O2(g) CO(g) ΔH=-111 kJ·mol-1 该催化重整反应的ΔH= kJ·mol-1。有利于提高CH4平衡转化率的条件是 (填标号)。 A.高温低压 B.低温高压 C.高温高压 D.低温低压 某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为 mol2·L-2。 (2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表: 积碳反应 CH4(g) C(s)+ 2H2(g) 消碳反应 CO2(g)+C(s) 2CO(g) ΔH/(kJ·mol-1) 75 172 活化能/ (kJ·mol-1) 催化剂X 33 91 催化剂Y 43 72 ①由上表判断,催化剂X Y(填“优于”或“劣于”),理由是 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如下图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是 (填标号)。 A.K积、K消均增加 B.v积减小、v消增加 C.K积减小、K消增加 D.v消增加的倍数比v积增加的倍数大 ②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如下图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为 。 答案 (1)247 A 13 (2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD ②pc(CO2)、pb(CO2)、pa(CO2) 5.(2014课标Ⅰ,28,15分)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题: (1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式: 。 (2)已知: 甲醇脱水反应 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1 甲醇制烯烃反应 2CH3OH(g) C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1 乙醇异构化反应 C2H5OH(g) CH3OCH3(g) ΔH3=+50.7 kJ·mol-1 则乙烯气相直接水合反应C2H4(g)+H2O(g) C2H5OH(g)的ΔH= kJ·mol-1。与间接水合法相比,气相直接水合法的优点是 。 (3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中nH2O∶nC2H4=1∶1)。 ①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 ②图中压强(p1、p2、p3、p4)的大小顺序为 ,理由是 。 ③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9MPa, nH2O∶nC2H4=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。 答案 (1)C2H4+H2SO4C2H5OSO3H、 C2H5OSO3H+H2O C2H5OH+H2SO4 (2)-45.5 污染小、腐蚀性小等 (3)①p(C2H5OH)p(C2H4)·p(H2O)=20%np2n-20%n80%np2n-20%n2=20×180802×7.85 MPa=0.07 (MPa)-1 ②p1查看更多