- 2021-07-05 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学一轮复习物质的量 气体摩尔体积作业
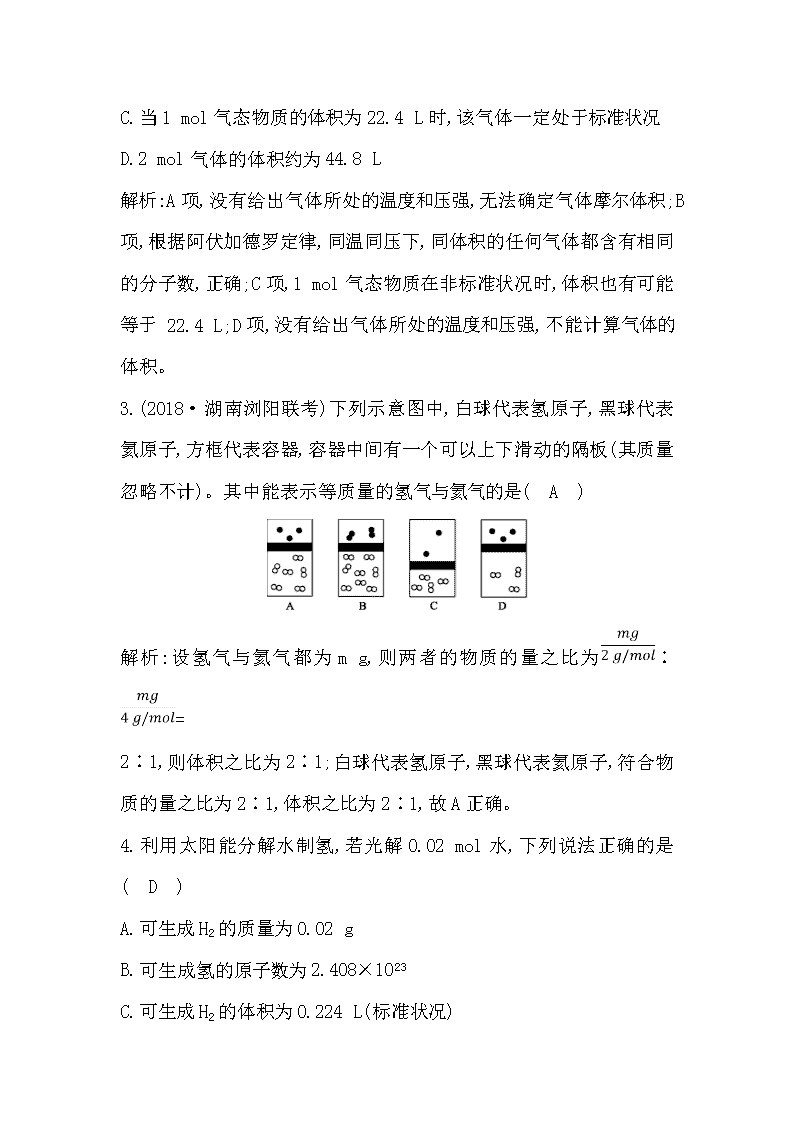
第3讲 物质的量 气体摩尔体积 课时集训 测控导航表 知识点 基础 能力 挑战 物质的量、摩尔质量 1 气体摩尔体积 2 阿伏加德罗定律 3 8 阿伏加德罗常数 7,9 以物质的量为中心的计算 4,5 6,10,11 12,13,14 1.下列几种说法中正确的是( C ) A.摩尔是化学上常用的一个物理量 B.某物质含有6.02×1023个微粒,含有这个数目微粒的物质一定是 1 mol C.1 mol氢气分子可以表示为1 mol H2 D.硫酸的摩尔质量为98 g 解析:摩尔是物质的量的单位,A项错误;6.02×1023个微粒是1 mol,但含有这个数目微粒的物质不一定是1 mol,如含6.02×1023个Na+的Na2CO3为0.5 mol,B项错误;D项单位错误。 2.下列说法正确的是( B ) A.1 mol任何气体的气体摩尔体积都约为22.4 L·mol-1 B.20 ℃、1.01×105 Pa时,同体积的O2与CO2含有相同的分子数 C.当1 mol气态物质的体积为22.4 L时,该气体一定处于标准状况 D.2 mol气体的体积约为44.8 L 解析:A项,没有给出气体所处的温度和压强,无法确定气体摩尔体积;B项,根据阿伏加德罗定律,同温同压下,同体积的任何气体都含有相同的分子数,正确;C项,1 mol气态物质在非标准状况时,体积也有可能等于 22.4 L;D项,没有给出气体所处的温度和压强,不能计算气体的体积。 3.(2018·湖南浏阳联考)下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( A ) 解析:设氢气与氦气都为m g,则两者的物质的量之比为∶= 2∶1,则体积之比为2∶1;白球代表氢原子,黑球代表氦原子,符合物质的量之比为2∶1,体积之比为2∶1,故A正确。 4.利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是( D ) A.可生成H2的质量为0.02 g B.可生成氢的原子数为2.408×1023 C.可生成H2的体积为0.224 L(标准状况) D.生成H2的量理论上等于0.04 mol Na与水反应产生H2的量 解析:根据化学方程式2H2O2H2↑+O2↑,光解0.02 mol水,可产生0.02 mol H2和0.01 mol O2,由此可得生成H2的质量为0.04 g,A错误;可生成氢的原子数为2.408×1022,B错误;可生成标准状况下H2的体积为0.448 L,C错误;0.04 mol Na与水反应产生0.02 mol H2,D正确。 5.在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g),按要求填空。 (1)若所得混合气体对H2的相对密度为d,则混合气体的物质的量为 。NH4HCO3的摩尔质量为 (用含m、d的代数式表示)。 (2)所得混合气体的密度折合成标准状况为ρ g·L-1,则混合气体的平均摩尔质量为 。 (3)在该条件下,所得NH3、CO2、H2O(g)的体积分数分别为a%、b%、c%,则混合气体的平均相对分子质量可表示为 。 解析:(1)混合气体对H2的相对密度为d,则混合气体平均相对分子质量等于2d,混合气体总质量为m g,则混合气体的物质的量为 mol。由分解方程式: NH4HCO3NH3↑+CO2↑+H2O↑ 1 1 1 1 NH4HCO3与生成气体的物质的量之比为1∶3, 则n(NH4HCO3)= mol,M(NH4HCO3)= g·mol-1=6d g·mol-1。 (2)混合气体的平均摩尔质量(混合气体)=== 22.4ρ g·mol-1。 (3)混合气体的平均相对分子质量等于各气体的摩尔质量乘以各成分的体积分数之和,(混合气体)=M(NH3)×a%+M(CO2)×b%+M(H2O)× c%=17a%+44b%+18c%。 答案:(1) mol 6d g·mol-1 (2)22.4ρ g·mol-1 (3)17a%+44b%+18c% 6.(2019·辽宁沈阳模拟)下列叙述中正确的是( B ) A.相同条件下,N2和O3混合气与等体积的N2所含原子数相等 B.等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等 C.常温常压下28 g CO与22.4 L O2所含分子数相等 D.16 g CH4与18 g N所含质子数相等 解析:臭氧由3个氧原子构成,则相同条件下,N2和O3的混合气与等体积的N2所含原子数不相等,A错误;甲基和羟基均含有9个电子,则等物质的量的甲基(—CH3)与羟基(—OH)所含电子数相等,B正确;常温常压下,22.4 L O2的物质的量不是1 mol,与28 g CO即1 mol CO含有的分子数不相等,C错误;16 g CH4与18 g N 所含质子数不相等,分别是10 mol、11 mol,D错误。 7.(2019·辽宁沈阳模拟)NA代表阿伏加德罗常数的值。下列说法正确的是( D ) A.在标准状况下,11.2 L CH2Cl2分子中含氯原子数目为NA B.14 g Li投入100 mL 1 mol·L-1盐酸中转移电子数目为0.1NA C.1 L 0.1 mol·L-1H2S溶液中H+数目为0.2NA D.2.0 g含D2O和H218O的混合物中含中子数目为NA 解析:在标准状况下,CH2Cl2呈液态,不能根据气体摩尔体积计算其物质的量或原子数目,A错误;Li先与HCl反应,后与水反应,故Li能完全反应,转移电子数目为2NA,B错误;H2S部分电离,H+数目远小于0.2NA,C错误;D2O、O的相对分子质量都是20,它们都含10个中子,故2.0 g该混合物的物质的量为0.1 mol,含中子数目为NA,D正确。 8.(2018·河北五校联考)三种气体X、Y、Z的相对分子质量关系为Mr(X)查看更多
相关文章
- 当前文档收益归属上传用户