- 2021-07-05 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习物质的制备学案(全国通用)
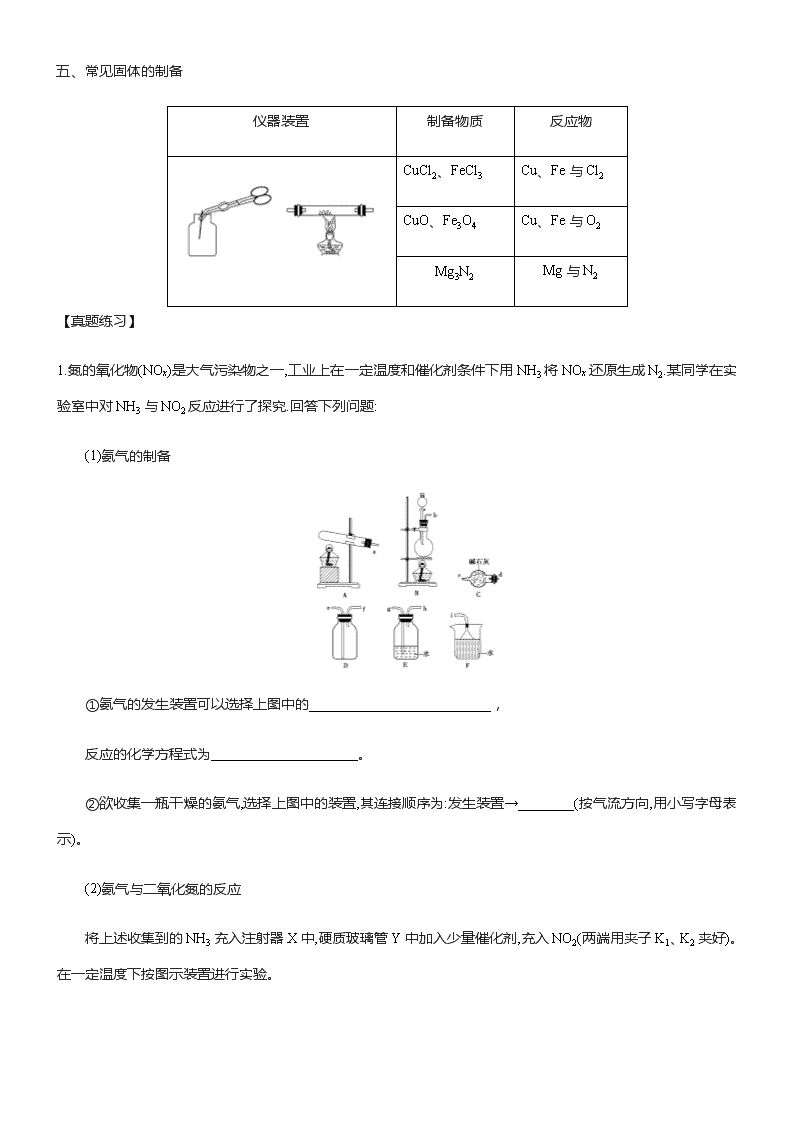
物质的制备 一、题型分析 物质制备型实验题主要考查常见气体(Cl2、NH3、H2、CO2、SO2、NO、NO2等)和一些简单化合物的制备原理.装置和操作方法、除杂、分离和提纯的方法,有向绿色化、综合化、探究化等方向发展. 二、题型解答原则 1.实验室制备气体时试剂的选择原则①方便、经济、安全原则,尽量做到减少废气的排放②反应速率要易于控制,便于气体的收集和检验③试剂发生反应制得的气体要唯一. 2.仪器的连接顺序①装置顺序:制气装置→净化装置→干燥装置→反应或收集装置→除尾气装置②组装顺序:由下向上,由左及右,先塞后定③操作顺序:装配仪器→检查气密性→加入药品(先固后液). 三、常见气体的制备 1.制备气体的流程 2.制备气体的装置 (1)常见的气体发生装置 固+固气体 固(液)+液气体 固+液―→气体 A B C A装置用于制备:O2(KClO3、KMnO4分解)、NH3(NH4Cl和Ca(OH)2反应)等. B装置用于制备:SO2(Cu和浓H2SO4反应)、Cl2、HCl等. C装置用于制备:H2、CO2、NO、NO2、O2(H2O2和MnO2反应)、NH3(CaO和浓氨水反应)、SO2(Na2SO3和浓H2SO4反应)、Cl2(KMnO4和浓盐酸反应)等。 (2)常见的净化装置——用于除去气体中的杂质气体 (3)常见的气体收集装置 (4)常见的量气装置——通过排液法测量气体的体积 (5)有毒气体的处理装置 四、常见有机物的制备 仪器装置 制备物质 反应物 溴苯 苯与液溴(FeBr3为催化剂) 乙酸乙酯 乙醇、乙酸、浓硫酸 五、常见固体的制备 仪器装置 制备物质 反应物 CuCl2、FeCl3 Cu、Fe与Cl2 CuO、Fe3O4 Cu、Fe与O2 Mg3N2 Mg与N2 【真题练习】 1.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2.某同学在实验室中对NH3与NO2反应进行了探究.回答下列问题: (1)氨气的制备 ①氨气的发生装置可以选择上图中的__________________________, 反应的化学方程式为_____________________。 ②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。 (2)氨气与二氧化氮的反应 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。 操作步骤 实验现象 解释原因 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 ①Y管中________ ②反应的化学方程式 ________________________________________________________ 将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝聚 打开K2 ③__________________________________________________________ ④_______________________________________________________________ 2.过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题: (一)碳酸钙的制备 (1)步骤①加入氨水的目的是______________________________________。 小火煮沸的作用是使沉淀颗粒长大,有利于________。 (2)如图是某学生的过滤操作示意图,其操作不规范的是________(填标号)。 a.漏斗末端颈尖未紧靠烧杯壁 b.玻璃棒用作引流 c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗 e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度 (二)过氧化钙的制备 CaCO3滤液 白色结晶 (3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈________性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是_________________________。 (4)步骤③中反应的化学方程式为__________________________________, 该反应需要在冰浴下进行,原因是_______________________________。 (5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_________________。 (6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是_______________,产品的缺点是________。 3.三氯化铁是一种高效、廉价的净水剂,为红棕色固体,易潮解生成FeCl3·nH2O。实验室用如下装置(部分加热、夹持等装置已略去)制备无水氯化铁固体。 (1)按气流方向仪器接口的连接顺序为a→___→___→___→___→b→c→___→____. (2)实验前检查装置气密性的方法是_____________________________. (3)装置D的作用是____________________________;装置E中的试剂X是________,其作用是_________________. (4)用无水氯化铁固体配制氯化铁溶液的操作是_____________________. 4.制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为Sn+2Cl2SnCl4.Sn也可与HCl反应生成SnCl2.已知: 物质 摩尔质量/(g·mol-1) 熔点/℃ 沸点/℃ Sn 119 232 2 260 SnCl2 190 246.8 623 SnCl4 261 -30.2 114.1 MnO2 87 535(分解) - 某同学设计的相关实验装置如图所示: (1)A中浓盐酸与B中物质进行反应,化学方程式为__________________. (2)D中的试剂为________,目的是________. (3)G中冷却水的进水位置为________(填字母). (4)为避免E中副反应的发生,对装置需要改进的措施是________________. (5)K中固体物质的作用为____________________. (6)当要结束实验时,不能首先进行的操作是________(填序号). ①关闭A的活塞 ②停止F的加热 ③停止G的通水 (7)若将B中的固体换成________,并将除A和B以外的器皿去掉,反应可制备SnCl2。 (8)实验结束后,若得到的SnCl4为13.05 g,至少消耗________ g MnO2.为了避免尾气污染, 需要改进的措施是_________________________. 5.如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液. 已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2. (1)①实验中控制氯气与空气的体积比的方法是____________________. ②为使反应充分进行,实验中采取的措施有________________________. (2)①装置B中产生Cl2O的化学方程式为___________________________. ②若B无冷却装置,进入C中的Cl2O会大量减少。其原因是_____________. (3)装置C中采用棕色圆底烧瓶是因为__________________. (4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案:用________量取20.00 mL次氯酸溶液,________. (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱) 6.氢化钙(CaH2)固体是登山运动员常用的能源提供剂.氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气.氢化钙通常用氢气与金属钙加热制取.图甲是模拟制取装置. 甲 乙 回答下列问题: (1)利用图甲实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,________(请按正确的顺序填入下列步骤的序号)。 ①加热反应一段时间 ②收集气体并检验其纯度 ③关闭分液漏斗活塞 ④停止加热,充分冷却 (2)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是________;装置D的作用是___________________________. (3)某同学利用图乙装置测定上述实验中得到的氢化钙的含量。他称取m g所制得的氢化钙样品,实验前后量气管中液面读数分别为V1 mL、V2 mL。(上述气体体积均换算为标准状况下) ①装置中导管a的作用是_______________________________________. ②如何判断样品与水完全反应:_________________________. ③产生的氢气体积为________mL;若未冷却至室温即读数,则氢化钙含量________(填“偏高”“偏低”或“无影响”). (4) 请你再设计一种氢化钙纯度的测定方法:_________________________. [答案] 1.(1)①A 2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O(或B NH3·H2ONH3↑+H2O) ②dcfei (2)①红棕色气体慢慢变浅②8NH3+6NO27N2+12H2O ③Z中NaOH溶液产生倒吸现象 ④反应后气体分子数减少,Y管中压强小于外压 2.(1)调节溶液pH使Fe(OH)3沉淀 过滤分离(2)ade (3)酸 除去溶液中的CO2 (4)CaCl2+2NH3·H2O+H2O2+6H2O===CaO2·8H2O↓+2NH4Cl或CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2O 温度过高时双氧水易分解 (5)去除结晶表面水分 (6)工艺简单、操作方便 纯度较低 3.(1)h i d e f g(2)打开a处止水夹,用酒精灯微热圆底烧瓶,装置E和C中有气泡产生;移开酒精灯后,C、E装置的导管内液面上升形成一段水柱(3)吸收未反应的Cl2,同时防止空气中的水蒸气进入装置B 饱和食盐水 吸收Cl2中的HCl气体(4)将无水氯化铁固体溶解在滴有少量稀盐酸的蒸馏水中 4.(1)4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O(2)浓硫酸 除去水蒸气(3)b(4)BD间增加盛有饱和食盐水的洗气瓶(5)防止空气中水分进入集气瓶中(6)③(7)Sn(8)8.70 在K后面加尾气吸收装置 5.(1)①通过观察A中产生气泡的速率调节流速②搅拌、使用多孔球泡(2)①2Cl2+Na2CO3===Cl2O+2NaCl+CO2 ②该反应放热,温度升高Cl2O会分解(3)HClO见光易分解(4)酸式滴定管 加入足量的H2O2溶液,再加入足量的硝酸银溶液,过滤,洗涤,在真空干燥箱中干燥,用电子天平称量沉淀质量 6.(1)②①④③(2)无水硫酸铜 防止空气中的水蒸气进入C装置(其他合理答案均可)(3)①平衡分液漏斗与锥形瓶内气体压强,使分液漏斗中的水能顺利滴下;同时使滴入锥形瓶内水的体积等于进入分液漏斗内的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差②量气管中液面不再变化(其他合理答案均可)③V1-V2 偏高(4)称取一定量的样品(m1 g),加入盐酸溶液至不再冒气泡(反应完全),然后将溶液蒸发得到氯化钙固体(m2 g),根据m1、m2即可得到氢化钙的纯度(其他合理答l案均可) 查看更多