- 2021-07-05 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习核心素养测评三十六物质的分离提纯和检验含解析新人教版
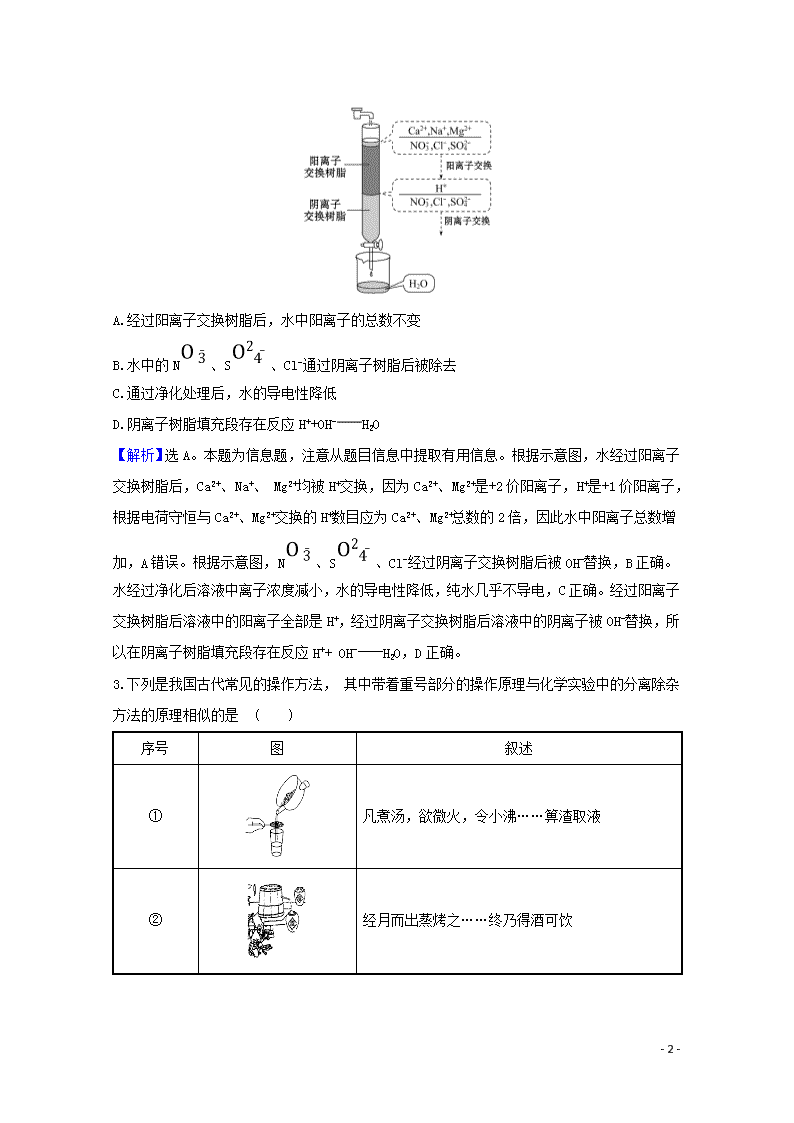
物质的分离、提纯和检验 一、选择题(本题包括3小题,每题8分,共24分) 1.(2020·济南模拟)《炼丹秘诀》中的“抽汞法”有如下叙述:“朱砂不计多少。入沙锅中以炭屑填平锅口,剪蛎壳板如锅大密钻小窍盖之,却将空沙锅一个与前锅二口相合,铁丝固济(包括有用铁丝缠和用盐泥固济二法),地下掘一穴安埋空锅,锻炼之后候冷取出,大概银朱一两只有真汞三钱。”文中涉及的操作方法是 ( ) A.蒸馏 B.升华 C.干馏 D.萃取 【解析】选A。意思为“向一沙锅中放入一定量的朱砂,用炭屑填平锅口,剪与锅一般大蛎壳板,在上面钻许多小孔,盖在锅上,再将一空沙锅与该锅的口密合,再用铁丝等固定密封,在地上挖一洞,将空锅放在洞口上,加热煅烧,冷却后可以得到汞”。即通过加热反应产生的汞蒸气冷却后得纯净汞。 【加固训练】 (2020·张家口模拟)用分液漏斗可以分离的一组混合物是 ( ) A.碘和CCl4 B.甲醛和水 C.乙酸乙酯和饱和碳酸钠溶液 D.苯和溴苯 【解析】选C。A、B、D中混合物均互溶,应蒸馏分离,只有C中混合物分层,可选分液漏斗分离,故选C。 2.(2019·全国卷Ⅲ)离子交换法净化水过程如图所示。下列说法中错误的 是 ( ) - 10 - A.经过阳离子交换树脂后,水中阳离子的总数不变 B.水中的N、S、Cl-通过阴离子树脂后被除去 C.通过净化处理后,水的导电性降低 D.阴离子树脂填充段存在反应H++OH-H2O 【解析】选A。本题为信息题,注意从题目信息中提取有用信息。根据示意图,水经过阳离子交换树脂后,Ca2+、Na+、 Mg2+均被H+交换,因为Ca2+、Mg2+是+2价阳离子,H+是+1价阳离子,根据电荷守恒与Ca2+、Mg2+交换的H+数目应为Ca2+、Mg2+总数的2倍,因此水中阳离子总数增加,A错误。根据示意图,N、S、Cl-经过阴离子交换树脂后被OH-替换,B正确。水经过净化后溶液中离子浓度减小,水的导电性降低,纯水几乎不导电,C正确。经过阳离子交换树脂后溶液中的阳离子全部是H+,经过阴离子交换树脂后溶液中的阴离子被OH-替换,所以在阴离子树脂填充段存在反应H++ OH-H2O,D正确。 3.下列是我国古代常见的操作方法, 其中带着重号部分的操作原理与化学实验中的分离除杂方法的原理相似的是 ( ) 序号 图 叙述 ① 凡煮汤,欲微火,令小沸……箅渣取液 ② 经月而出蒸烤之……终乃得酒可饮 - 10 - ③ 凡渍药酒,皆须细切……便可漉出 ④ 海陆取卤,日晒火煎,煮海熬波,卤水成盐 A.过滤、蒸馏、萃取、蒸发 B.过滤、蒸发、萃取、蒸馏 C.蒸发、萃取、蒸馏、过滤 D.萃取、蒸馏、萃取、蒸发 【解析】选A。①中的箅渣取液,是用细网将固液混合物中的固体和液体分开,其原理与过滤的原理相似;②中通过蒸烤造酒,是通过加热的方法将酒精等物质从混合液中分离出来,其原理与蒸馏的原理相似;③中通过浸泡,使草药中的有效成分溶于酒中,其原理与萃取的原理相似;④中的日晒火煎,卤水成盐,是通过日晒的方法,将水分蒸发得到食盐,其原理与蒸发的原理相似。 【加固训练】 1.(2020·杭州模拟)下列除去杂质的方法中正确的是 ( ) A.除去N2中的少量O2,通过灼热的焦炭,收集气体 B.除去CO2中的少量CO,用酒精灯加热 C.除去FeSO4溶液中的少量CuSO4,加入足量铁屑,充分反应后过滤 D.除去KCl溶液中的少量MgCl2,加入适量NaOH溶液,过滤 【解析】选C。可生成CO等杂质气体,应通过灼热的铜网除杂,故A错误;CO少量,且二氧化碳不支持燃烧,难以除去杂质,可用灼热的CuO来除杂,故B错误;铁可置换出铜,可除杂,故C正确;加入氢氧化钠,生成NaCl杂质,应用KOH除杂,故D错误。 2.(双选)通过实验得出的结论正确的是 ( ) A.将某固体试样完全溶于盐酸,再滴加BaCl2溶液,出现白色沉淀,该固体试样中不一定存在S B.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现红色,则该固体试样中不存在Fe3+ C.在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在N - 10 - D. 在某固体试样加水后的上层清液中,滴加盐酸出现白色沉淀,再加NaOH溶液沉淀溶解,则该固体试样中存在Si 【解析】选A、C。将某固体试样完全溶于盐酸,再滴加BaCl2溶液,出现白色沉淀,则该固体试样中不一定存在S,A正确;若固体试样是铁和少量氯化铁的混合物,完全溶于盐酸,再滴加KSCN溶液,也没有出现红色,B错误;在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在N,C正确;固体试样中若含有Al,滴加盐酸出现白色沉淀,再加NaOH溶液沉淀溶解,D错误。 二、非选择题(本题包括2小题,共26分) 4.(10分)柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足的盐矿资源。盐体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、S、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程: 请根据以上流程,回答相关问题: (1)操作①是________;操作②是________;操作③是 ______;操作④所需要的玻璃仪器有___________。 (2)参照如图所示溶解度曲线,欲得到较纯净的氯化钾晶体需用少量的________(填“热水”或“冷水”)洗涤固体________(填“A”或“B”)。 【解析】(1)最开始加的氧化剂将Br-氧化成Br2,由加入CCl4 可知,使用萃取剂萃取Br2,所以操作①是萃取;将 CCl4 层和水层分开的过程叫分液;利用蒸馏操作③从溴的 CCl4 - 10 - 溶液中分离 CCl4 和液溴。由溶解度图象知,将得到的溶液进行蒸发浓缩90 ℃后进行结晶,在将固液不相溶的物质进行分离的操作叫过滤,此时所用的玻璃仪器有玻璃棒、烧杯、漏斗; (2)在90 ℃时得到固体A为MgSO4,而30 ℃时得到的固体B为KCl,所以应用冷水洗涤固体B,才可以得到较纯净的氯化钾。 答案:(1)萃取 分液 蒸馏 玻璃棒、漏斗、烧杯 (2)冷水 B 5.(16分)实验法是学习化学的重要方法。 Ⅰ.海带中含有丰富的碘元素,以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2I-+Cl22Cl-+I2,碘与溴一样易溶于有机溶剂) (1)实验操作①的名称:________。 (2)实验步骤②中加适量Cl2的目的是 __。 (3)实验步骤③提取碘的过程中,不能选用的溶剂是______。 A.苯 B.酒精 C.四氯化碳 (4)从海藻开始经过5步操作到含碘的有机溶液的实验过程中,要用到多种实验仪器。已知实验室里有坩埚、坩埚钳、烧杯、玻璃棒、酒精灯、石棉网、以及必要的夹持仪器等物品,尚缺少的玻璃仪器是________、________。 (5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图所示实验装置中的错误之处:________________、________________、__________________。 - 10 - Ⅱ.某学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物: 回答下列问题 (1)写出生成B物质的化学方程式 ______________________。 (2)滤液中的溶质有________________(写化学式),若要制得纯净的NaCl,应向滤液中加入适量的某种试剂,该试剂的名称是________。 (3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是________。 【解析】Ⅰ.(1)实验操作①是分离固体和液体的操作,名称为过滤;(2)实验步骤②中加适量Cl2的目的是将I-转化为I2;(3)提取碘的过程为萃取,萃取剂选择原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂,苯与水互不相溶,碘在苯中溶解度远远大于水中,故A可以;酒精与水互溶,不能萃取碘水中的碘,故B不可以;四氯化碳与水互不相溶,碘在四氯化碳中溶解度远远大于水中,故C可以;(4)为使上述流程中含碘离子溶液转化为碘的有机溶液,应进行萃取分液操作,分液操作用到的仪器:分液漏斗、玻璃棒、烧杯、铁架台(带铁夹),过滤时需要漏斗,所以还缺少的玻璃仪器为分液漏斗、漏斗;(5)烧杯受热要垫石棉网,增大受热面积;冷凝水应是下进上出,冷凝水的方向错误,应为下进上出;温度计水银球的位置错误,温度计水银球应与烧瓶支管口相平。 Ⅱ.(1)生成B物质的化学方程式为CaCl2+Na2CO3CaCO3↓+2NaCl; (2)滤液中的溶质有NaCl、Na2CO3,要制得纯净的NaCl,应向滤液中加入适量的某种试剂,该试剂的名称是盐酸; (3)测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是混合物A,由原子守恒可计算氯化钙的质量,然后计算质量比。 答案:Ⅰ.(1)过滤 (2)将I-转化为I2 (3)B (4)分液漏斗 漏斗 (5)加热时没有垫石棉网 温度计水银球的位置未在支管口处 冷凝水进出口方向错误 Ⅱ.(1)CaCl2+Na2CO3CaCO3↓+2NaCl (2)NaCl、Na2CO3 盐酸 (3)混合物A - 10 - 一、选择题(本题包括3小题,每题6分,共18分) 1.(2020·烟台模拟)清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。”文中“盖泥法”的原理与下列相同的是 ( ) A.活性炭净水 B.用漂白粉漂白织物 C.除去KNO3中的NaCl D.除去河水中的泥沙 【解析】选A。文中“去土而糖白”是指固体土吸附糖色,所以文中“盖泥法”的原理与活性炭净水相同。 2.(2020·厦门模拟)2019年6月17日,屠呦呦团队宣布青蒿素应用取得科研新进展。已知:青蒿素难溶于水、易溶于乙醚。实验室模拟从青蒿中提取青蒿素流程如图,该提取过程不需要用到的仪器或装置是 ( ) 【解析】选B。研磨需要A,过滤需要D,蒸馏需要C,则该过程不需要装置B。 3.(双选)(2020·长沙模拟改编)镍常用作有机合成的催化剂和用于制造硬币。以废镍料(含少量铁)为原料回收镍的一种流程如图: 下列说法错误的是 ( ) A.“酸浸”中为提高反应速率,最好用浓硫酸代替稀硫酸 - 10 - B.滤渣A可以用于制造铁红,从滤液A中可提取Na2SO4 C.“电解”时在阳极上析出镍,废液可以作“酸浸”液循环利用 D.“氧化”过程中使用双氧水的好处是反应过程中不产生有害物质及杂质离子 【解析】选A、C。浓硫酸具有强氧化性,可使铁发生钝化,不能除去,故A错误;A为氢氧化铁沉淀,可用于制造铁红,滤液A含有硫酸钠,故B正确;电解时,镍离子在阴极得电子生成镍,电解液含有硫酸,可循环使用,故C错误;加入过氧化氢氧化亚铁离子,为绿色氧化剂,不产生有害物质及杂质离子,故D正确。 二、非选择题(本题包括2小题,共32分) 4.(14分)某透明的X溶液中可能含有下列离子中的几种,100 mL溶液中的每种阴离子的物质的量均为0.2 mol,每种阳离子的物质的量均为0.1 mol。取100 mL该溶液进行如下连续实验,操作①反应中消耗 N为0.1 mol。 阴离子 Mn、Si、C、I-、ClO-、Cl-、S 阳离子 Fe2+、Fe3+、N、Ag+、Al3+ 根据以上信息,回答下列问题: (1)沉淀C、G的化学式分别为________、__________; (2)X溶液中肯定含有的离子是__________; (3)写出操作①中产生气体A的离子方程式: ________________; (4)写出操作②发生的离子方程式: ______________。 【解析】取100 mL该溶液进行如下连续实验,操作①反应中消耗 N为0.1 mol,说明含有还原性离子,流程分析溶液B中加入四氯化碳下层呈紫红色证明一定含有I-,一定不含Mn、ClO-、Fe3+,Ag+,上层清液中加入过量的氢氧化钠溶液,生成气体F为NH3,说明原溶液中含N,溶液H中通入过量二氧化碳生成沉淀I说明原溶液中含有Al3+,在过量氢氧化钠溶液中生成的偏铝酸钠溶液,偏铝酸钠溶液和二氧化碳反应生成氢氧化铝沉淀I - 10 - 和碳酸氢钠溶液J,生成沉淀G只有氢氧化铁沉淀,证明原溶液中含有Fe2+,判断一定不含有Si、C,X溶液中加入过量硝酸钡和盐酸反应生成沉淀C,判断为BaSO4,综上所述原溶液中一定含有I-、Fe2+、N、Al3+、S; (1)上述分析可知,C为BaSO4,G为Fe(OH)3;(2)X溶液中肯定含有的离子是I-、Fe2+、N、Al3+、S; (3)操作①中产生气体A为NO,是稀硝酸和碘离子、亚铁离子发生氧化还原反应生成,反应的离子方程式6I-+2N+8H+3I2+2NO↑+4H2O,3Fe2++N+4H+3Fe3++NO↑+2H2O; (4)操作②发生偏铝酸钠溶液中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,发生的离子方程式为Al+CO2+2H2OAl(OH)3↓+HC。 答案:(1)BaSO4 Fe(OH)3 (2)I-、Fe2+、N、Al3+、S (3)6I-+2N+8H+3I2+2NO↑+4H2O,3Fe2++N+4H+3Fe3++NO↑+2H2O (4)Al+CO2+2H2OAl(OH)3↓+HC 5.(18分)(2020·衡水模拟)氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如图所示(其中夹持仪器及加热装置略去)。 仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。 (1)仪器b外侧玻璃导管的作用是 __。 (2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器e进入仪器d中。 ①仪器e的名称是__________,其盛装的试剂名称是 __。 ②仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是____________加热,其优点是_______________。 (3)仪器c的作用是 ____________________________。 - 10 - (4)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表: 有机物 苯 氯苯 邻二氯苯 间二氯苯 对二氯苯 沸点/℃ 80 132.2 180.4 173.0 174.1 从该有机混合物中提取氯苯时,采用蒸馏的方法,收集________℃左右的馏分。 (5)实际工业生产中,苯的流失如下表: 流失项目 蒸气挥发 二氯苯 其他 合计 苯流失量(kg/t) 28.8 14.5 56.7 100 某一次投产加入13 t苯,则制得氯苯________t(保留一位小数)。 【解析】仪器a利用高锰酸钾的强氧化性,能把Cl-氧化成Cl2,发生反应:2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O。 (1)仪器b外侧玻璃导管的作用是平衡压强,使盐酸顺利滴下。 (2)①仪器e为洗气瓶,仪器a产生的氯气中含有水蒸气,需要除去,因此洗气瓶中盛放的试剂是浓硫酸。 ②保持温度在40~60 ℃,需要的加热方法是水浴加热;优点:受热均匀,易于控制温度。 (3)仪器c是球形冷凝管,作用是冷凝、回流。 (4)实验室制备氯苯,根据混合物沸点数据,因此收集的是132.2 ℃的馏分。 (5)1 t苯中损失苯100 kg,则13 t苯中损失苯13 ×100×10-3t=1.3 t,有(13-1.3)t苯生成氯苯,因此氯苯的质量为(13-1.3)t×≈16.9 t。 答案:(1)使浓盐酸能顺利滴下(或答“平衡仪器a、b内的气压”) (2)①洗气瓶 浓硫酸 ②水浴 受热均匀,易于控制温度 (3)冷凝、回流 (4)132.2 (5)16.9 - 10 -查看更多