- 2021-07-05 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届山东省济南一中高二上学期期中考试(2017
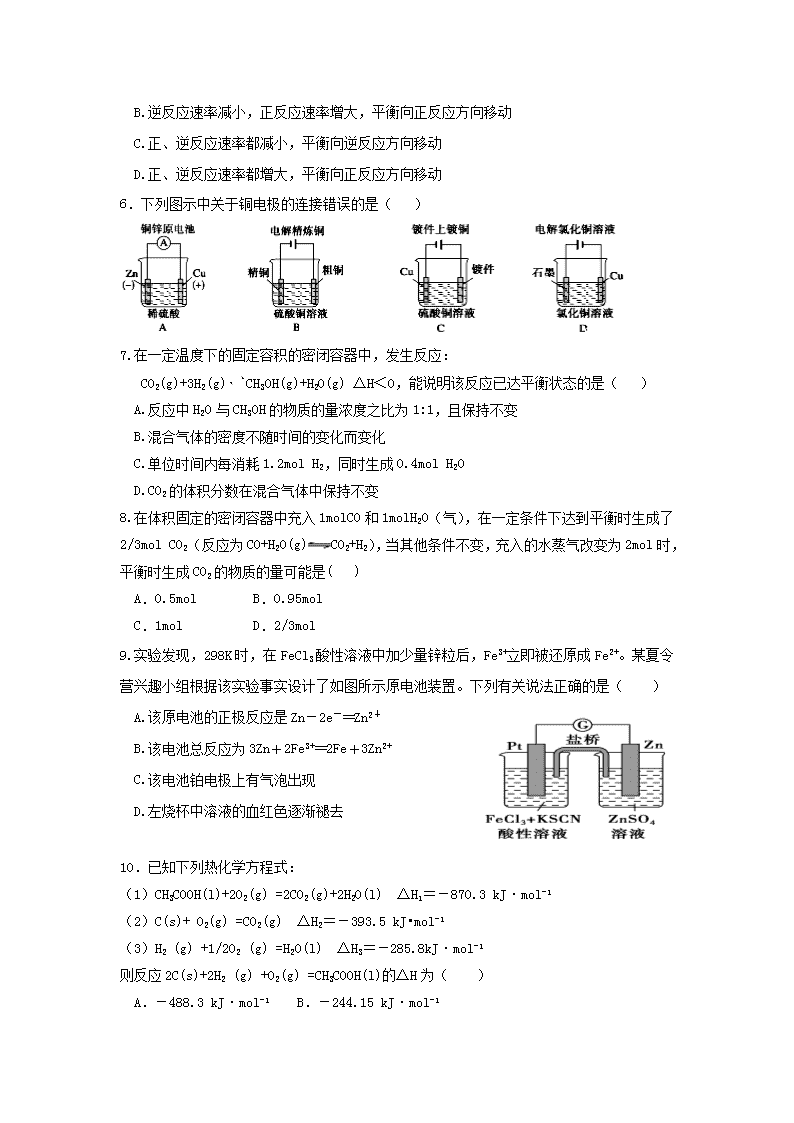
济南一中2017—2018学年度第一学期期中考试 高二化学试题(理科) 本试卷分第I卷(选择题)和第II卷(非选择题)两部分,满分100分.考试时间90分钟. 注意事项: 1.答第I卷前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上.【来源:全,品…中&高*考+网】 2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案,不能答在试卷上. 可能用到的相对原子质量 H 1 C 12 O 16 Cu 64 Zn 65 Ag 108 Fe 56 第I卷 选择题 一.选择题(每题只有1个正确答案。1到15每题2分,16到25每题3分,共60分) 1.下列有关能量转换的说法不正确的是( ) A.煤燃烧是化学能转化为热能的过程 B.太阳能热水器是太阳能转化为热能 C.可充电电池在充电时是将电能转化为化学能,而放电时是化学能转化电能 D.酸碱中和反应放出的能量可设计为原电池转化为电能 2.下列事实不用原电池原理解释的是( ) A.轮船水线以下的船壳上装一定数量的锌块 B.铁被钝化处理后不易腐蚀 C.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快 D.烧过菜的铁锅加入清水放置,出现红棕色的锈斑 3.下列措施或事实不能用勒沙特列原理解释的是( ) A.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 B.H2、I2、HI平衡混合气加压后颜色变深 C.实验室中常用排饱和食盐水的方法收集氯气 D.开启啤酒瓶后,瓶中马上泛起大量泡沫 4.反应A(g)+B(g)===C(g) ΔH,分两步进行: ①A(g)+B(g)===X(g) ΔH1 ②X(g)===C(g) ΔH2 反应过程中能量变化如上图所示,E1表示A+B===X的活化能,下列说法正确的是( ) A.ΔH1=ΔH-ΔH2>0 B.X是反应A(g)+B(g)==C(g)的催化剂 C.E2是反应②的反应热 D.ΔH=E1-E2 5.对已达化学平衡的下列反应:2X(g)+Y(g) 2Z(g)减小压强时,对反应产生的影响是( ) A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C.正、逆反应速率都减小,平衡向逆反应方向移动【来源:全,品…中&高*考+网】 D.正、逆反应速率都增大,平衡向正反应方向移动 6.下列图示中关于铜电极的连接错误的是( ) 7.在一定温度下的固定容积的密闭容器中,发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H<0,能说明该反应已达平衡状态的是( ) A.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变 B.混合气体的密度不随时间的变化而变化 C.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O【来源:全,品…中&高*考+网】 D.CO2的体积分数在混合气体中保持不变 8.在体积固定的密闭容器中充入1molCO和1molH2O(气),在一定条件下达到平衡时生成了2/3mol CO2(反应为CO+H2O(g)CO2+H2),当其他条件不变,充入的水蒸气改变为2mol时,平衡时生成CO2的物质的量可能是( ) A.0.5mol B.0.95mol C.1mol D.2/3mol 9.实验发现,298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是( ) A.该原电池的正极反应是Zn-2e-==Zn2+ B.该电池总反应为3Zn+2Fe3+==2Fe+3Zn2+ C.该电池铂电极上有气泡出现 D.左烧杯中溶液的血红色逐渐褪去 10.已知下列热化学方程式: (1)CH3COOH(l)+2O2(g) =2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1 (2)C(s)+ O2(g) =CO2(g) △H2=-393.5 kJ•mol-1 (3)H2 (g) +1/2O2 (g) =H2O(l) △H3=-285.8kJ·mol-1 则反应2C(s)+2H2 (g) +O2(g) =CH3COOH(l)的△H为( ) A.-488.3 kJ·mol-1 B.-244.15 kJ·mol-1 C.+488.3 kJ·mol-1 D.+244.15 kJ·mol-1 11. 某温度下,反应2SO3(g) 2SO2(g) + O2(g)的平衡常数K1=4×10-4,在同一温度下,反应SO2(g)+ 1/2O2(g) SO3 (g)的平衡常数K2的值为( ) A. 250 B. 200 C. 50 D. 2×10-2 12.将一直流电源的正、负极,分别接在一张用食盐水、碘化钾淀粉溶液和酚酞试液浸湿的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是( ) A B C D 阳极 白 红 蓝 蓝 阴极 蓝 蓝 红 蓝 13.一定条件下,反应2NO2(g)N2O4(g) ΔH<0在密闭容器中达到平衡。在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是( ) A.温度130℃、压强3.03×105Pa B.温度25℃、压强1.01×105Pa C.温度130℃、压强5.05×104Pa D.温度0℃、压强5.05×104Pa 14.一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)⇌pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是( ) A.m+n>p B.C的体积分数增加 C.平衡向正反应方向移动 D.A的转化率降低【来源:全,品…中&高*考+网】 15.一定温度下,向容积为2 L的密闭容器中仅仅通入了两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( ) A.反应进行到6s时,各物质的反应速率相等 B.反应进行到1s时,v (A)=v(C) C.反应进行到6s时,B的平均反应速率为0.1 mol/(L·s) D.该反应的化学方程式为3B+4 C6A+2D 16.如图装置中发生反应的离子方程式:Cu+2H+=Cu2++H2↑,下列说法正确的是( ) A.a、b不可能是同种材料的电极 B.该装置可能是原电池,电解质溶液为稀盐酸 C.该装置可能是a、b未形成闭合回路,电解质溶液是稀硝酸 D.该装置可能是电解池,电解质溶液为稀盐酸 17. 利用合成气(主要成分为CO、CO2和H2)通过下列反应合成甲醇。下列说法正确的是( ) 反应①:CO2(g)+H2(g)CO(g)+H2O(g) △H1=41kJ·mol–1 反应②:CO(g)+2H2(g)CH3OH (g) △H2=–99kJ·mol–1 反应③:CO2(g)+3H2(g)CH3OH(g) + H2O(l) △H3 A.反应①为放热反应 B.增大反应①的压强,H2转化率提高 C.△H3=-58kJ·mol–1 D.反应②使用催化剂,△H2不变 18.某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应: 3A(g)+2B(g)4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( ) A. 前2min,D的平均反应速率为0.2mol/(L·min) B. 此时,B的平衡转化率是40% C. 增加B,平衡向右移动,B的平衡转化率增大 D. 增大该体系的压强,平衡不移动 19.将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应: NH4Br(s) NH3(g)+HBr(g) 2HBr(g)Br2(g)+H2(g) 2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用(NH3)表示,下列反应速率正确的是( ) A.0.5mol/(L·min) B.2.5 mol/(L·min) C.2 mol/(L·min) D.5 mol/(L·min) 20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,t表示温度,n表示物质的量): 根据以上规律判断,下列结论正确的是( ) A.反应Ⅰ△H> 0,P2>P1 B.反应Ⅱ△H>0,T1>T2 C.反应Ⅲ△H>0,T2>T1;或△H<0,T2查看更多