- 2021-07-05 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习物质结构与性质作业1
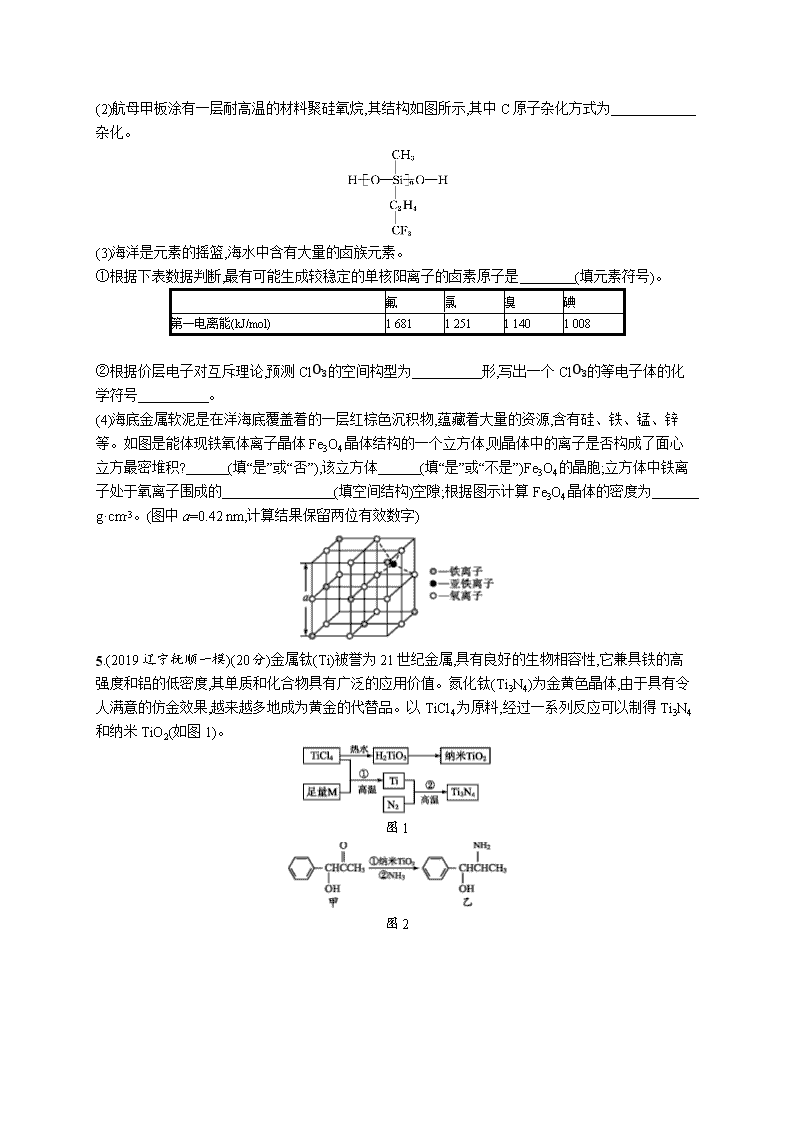
专题突破练16 物质结构与性质(选考) 非选择题(本题包括5个小题,共100分) 1.(2019江苏常州模拟)(20分)盐酸氯丙嗪是一种多巴胺受体的阻断剂,临床有多种用途。化合物Ⅲ是盐酸氯丙嗪制备的原料,可由化合物Ⅰ和Ⅱ在铜作催化剂条件下反应制得。 + Ⅰ Ⅱ Ⅲ (1)Cu原子基态核外电子排布式为 。 (2)1 mol化合物Ⅰ分子中含有σ键的物质的量为 。 (3)一个化合物Ⅲ分子中sp3方式杂化的原子数目是 。 (4)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该白色沉淀中Cu、S、N的物质的量之比为1∶1∶1,沉淀中有一种三角锥形的阴离子和一种正四面体形的阳离子。 ①[Cu(NH3)4]SO4中存在的化学键类型有 (填字母)。 A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力 ②上述白色沉淀的化学式为 。 (5)铜的氢化物的晶体结构如图所示,写出此氢化物在氯气中燃烧的化学方程式: 。 2.(2019湖南、湖北八市十二校二模)(20分)铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题: (1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: [Cu(NH3)4]SO4水溶液NH4CuSO3白色沉淀超细铜粉 ①NH4CuSO3中金属阳离子的核外电子排布式为 。N、O、S三种元素的第一电离能大小顺序为 (填元素符号)。 ②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是 。 A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故 B.NH3和H2O分子空间构型不同,氨气分子的键角小于水分子的键角 C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体 D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+34O2(g)12N2(g)+32H2O(g) ΔH=-5a kJ· mol-1 (2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子原理,O3分子的空间构型为 。 (3)氯与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为 。 (4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca—D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n= (填数值);氢在合金中的密度为 (保留两位有效数字)。 3.(2019江西九校联考)(20分)蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题: (1)碳、氮、氧三元素的第一电离能由小到大的顺序为 (用元素符号表示)。 (2)N3-的立体构型是 形,与N3-互为等电子体的一种分子是 (填分子式)。 (3)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为 。SO42-中的硫原子杂化方式为 。用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是 。 (4)碲化锌晶体有两种结构,其中一种晶胞结构如下图。晶胞中与Zn原子距离最近的Te原子围成 。与Te原子距离最近的Te原子有 个。若Zn与距离最近的Te原子间距为a pm,则晶体密度为 g·cm-3。(已知相对原子质量:Zn—65、Te—128) 4.(2019吉林长春联考)(20分)中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料,航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。 (1)镍铬钢抗腐蚀性能强,基态Ni2+的核外电子排布式为 ,铬元素在周期表中 区。 (2)航母甲板涂有一层耐高温的材料聚硅氧烷,其结构如图所示,其中C原子杂化方式为 杂化。 (3)海洋是元素的摇篮,海水中含有大量的卤族元素。 ①根据下表数据判断,最有可能生成较稳定的单核阳离子的卤素原子是 (填元素符号)。 氟 氯 溴 碘 第一电离能(kJ/mol) 1 681 1 251 1 140 1 008 ②根据价层电子对互斥理论,预测ClO3-的空间构型为 形,写出一个ClO3-的等电子体的化学符号 。 (4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如图是能体现铁氧体离子晶体Fe3O4晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积? (填“是”或“否”),该立方体 (填“是”或“不是”)Fe3O4的晶胞;立方体中铁离子处于氧离子围成的 (填空间结构)空隙;根据图示计算Fe3O4晶体的密度为 g·cm-3。(图中a=0.42 nm,计算结果保留两位有效数字) 5.(2019辽宁抚顺一模)(20分)金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度,其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。 图1 图2 图3 图中的M是短周期金属元素,M的部分电离能如下表: I1 I2 I3 I4 I5 电离能/kJ· mol-1 738 1 451 7 733 10 540 13 630 请回答下列问题: (1)Ti的基态原子外围电子排布式为 。 (2)M是 (填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为 。 (3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为 。 (4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为 g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与N原子距离相等且最近的N原子有 个。 (5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且已知三种离子晶体的晶格能数据如下: 离子晶体 NaCl KCl CaO 晶格能/kJ· mol-1 786 715 3 401 KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为 。 参考答案 专题突破练16 物质结构与性质(选考) 1.答案 (1)1s22s22p63s23p63d104s1或[Ar]3d104s1 (2)14 mol (3)2 (4)①ACD ②NH4CuSO3 (5)2CuH+3Cl22CuCl2+2HCl 解析 (1)Cu原子基态核外电子排布符合洪特规则特例,其基态核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。 (2)苯环上的碳碳键、碳氢键及N—H键都是σ键,1 mol化合物Ⅰ分子中含有σ键的物质的量为14 mol。 (3)化合物Ⅲ分子中,氮原子和羧基中羟基氧的价层电子对都是4对,它们都采用sp3杂化方式成键。 (4)①[Cu(NH3)4]SO4中,[Cu(NH3)4]2+、SO42-之间存在离子键,NH3、SO42-内部都存在共价键,Cu2+与NH3以配位键结合,故选ACD。②三角锥形的阴离子为SO32-,正四面体形的阳离子为NH4+,结合有关物质的组成可知,白色沉淀的化学式为NH4CuSO3。 (5)铜的氢化物的晶胞中Cu和H原子各有4个,其化学式为CuH,它在氯气中燃烧的化学方程式2CuH+3Cl22CuCl2+2HCl。 2.答案 (1)①1s22s22p63s23p63d10(或[Ar]3d10) N>O>S ②AC (2)V形 (3)sp3杂化 (4)5 0.083 g·cm-3 解析 (1)①NH4CuSO3中金属阳离子为Cu+,铜是29号元素,根据能量最低原理其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,该原子失去一个电子生成亚铜离子,失去的电子是最外层电子,所以亚铜离子的基态电子排布式为1s22s22p63s23p63d10或[Ar]3d10。N原子2p轨道为半充满结构,第一电离能大于O原子,同一主族元素的第一电离能随着原子序数的增大而减小,所以第一电离能大小顺序为N>O>S。②氨气分子与水分子之间存在氢键,氢键的存在使物质的溶解性显著增大,故A正确;氨气分子中N原子和水分子O原子均为sp3杂化,氨分子中N原子只有一对孤电子对,水分子中O原子有两对孤电子对,根据价层电子对互斥理论可知,氨分子的键角大于水分子的键角,故B错误;根据相似相溶原理可知,乙醇分子极性弱于水的极性,[Cu(NH3)4]SO4在乙醇中溶解度降低,则[Cu(NH3)4]SO4溶液中加入乙醇会析出深蓝色的晶体,故C正确;表示燃烧热的热化学方程式中,产物H2O应为液态,故D错误。 (2)O3分子与SO2互为等电子体,SO2分子中S原子价层电子对数为3,孤电子对数为1,空间构型为V形,等电子体具有相同的空间构型,则O3分子空间构型为V形。 (3)a位置上的Cl原子形成了2条单键,还有2对孤电子对,故为sp3杂化。 (4)镧镍合金、Ca—D合金都具有相同类型的晶胞结构XYn,由图可知,在晶胞上、下两个面上共有4个D原子,在前、后、左、右四个面上共有4个D原子,在晶胞的中心还有一个D原子,故Ca与D的个数比为(8×18)∶(8×12+1)=1∶5,故n=5。晶胞体积为9.0×10-23cm3,LaNinH4.5合金中H的质量为4.56.02×1023 mol×1 g·mol-1=4.56.02×1023 g,氢在合金中的密度为4.56.02×1023g9.0×10-23cm3≈0.083 g·cm-3。 3.答案 (1)C查看更多