- 2021-07-05 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省2020高考化学二轮复习专题题型十九物质结构与性质鸭训练含解析
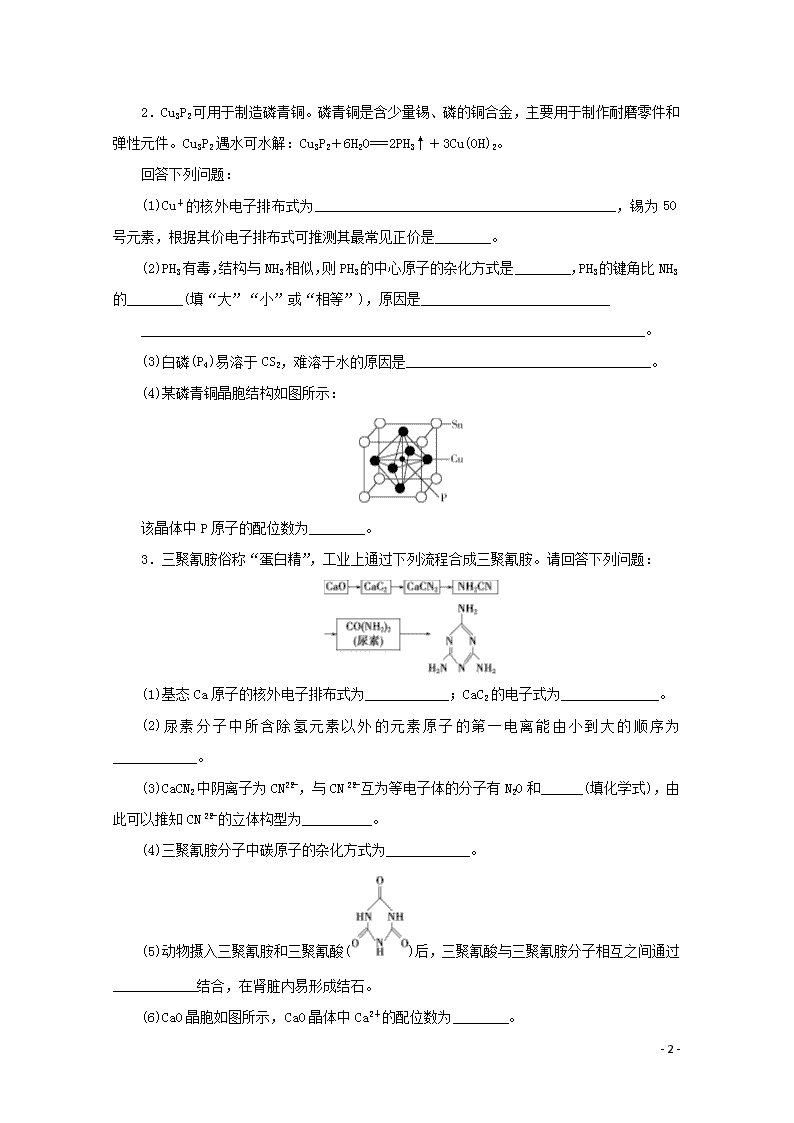
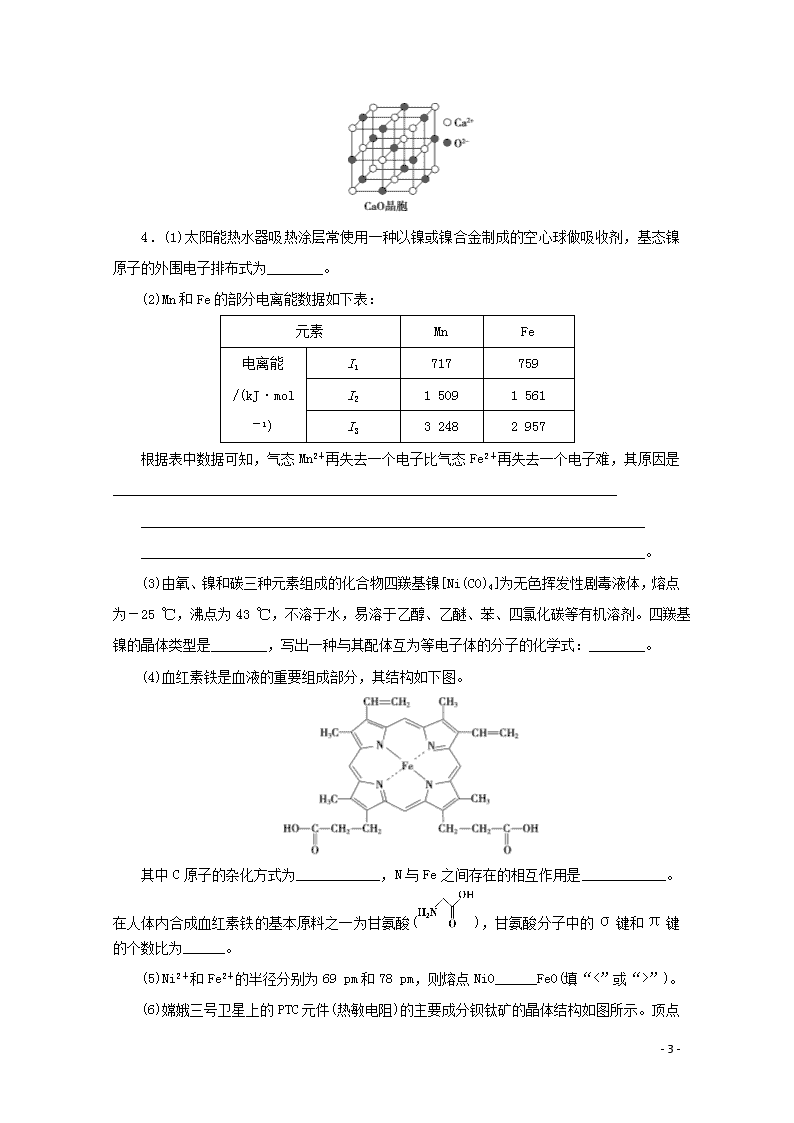
题型十九 物质结构与性质(选考) (建议用时:40分钟) 1.B、C、N、Si是常见的几种重要非金属元素,其形成的各种化合物在自然界中广泛存在。 (1)基态硅原子的核外电子排布式为____________。B、C、N元素原子的第一电离能由大到小的顺序为________________。 (2)BF3与一定量的水可形成如图甲所示晶体R。 ①晶体R中各种微粒间的作用力涉及________(填字母)。 a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力 ②晶体R中阴离子的立体构型为____________。 (3)乙二胺(H2NCH2CH2NH2)与CuCl2溶液可形成配离子(结构如图乙所示),乙二胺分子中氮原子的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是___________________________________________________________。 (4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可做高温润滑剂。它的晶体结构如图丙所示。六方相氮化硼________(填“含”或“不含”)π键,其质地软的原因是________________。 - 7 - 2.Cu3P2可用于制造磷青铜。磷青铜是含少量锡、磷的铜合金,主要用于制作耐磨零件和弹性元件。Cu3P2遇水可水解:Cu3P2+6H2O===2PH3↑+3Cu(OH)2。 回答下列问题: (1)Cu+的核外电子排布式为___________________________________________,锡为50号元素,根据其价电子排布式可推测其最常见正价是________。 (2)PH3有毒,结构与NH3相似,则PH3的中心原子的杂化方式是________,PH3的键角比NH3的________(填“大”“小”或“相等”),原因是___________________________ ________________________________________________________________________。 (3)白磷(P4)易溶于CS2,难溶于水的原因是___________________________________。 (4)某磷青铜晶胞结构如图所示: 该晶体中P原子的配位数为________。 3.三聚氰胺俗称“蛋白精”,工业上通过下列流程合成三聚氰胺。请回答下列问题: (1)基态Ca原子的核外电子排布式为____________;CaC2的电子式为______________。 (2)尿素分子中所含除氢元素以外的元素原子的第一电离能由小到大的顺序为____________。 (3)CaCN2中阴离子为CN,与CN互为等电子体的分子有N2O和______(填化学式),由此可以推知CN的立体构型为__________。 (4)三聚氰胺分子中碳原子的杂化方式为____________。 (5)动物摄入三聚氰胺和三聚氰酸()后,三聚氰酸与三聚氰胺分子相互之间通过____________结合,在肾脏内易形成结石。 (6)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________。 - 7 - 4.(1)太阳能热水器吸热涂层常使用一种以镍或镍合金制成的空心球做吸收剂,基态镍原子的外围电子排布式为________。 (2)Mn和Fe的部分电离能数据如下表: 元素 Mn Fe 电离能/(kJ·mol-1) I1 717 759 I2 1 509 1 561 I3 3 248 2 957 根据表中数据可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。 (3)由氧、镍和碳三种元素组成的化合物四羰基镍[Ni(CO)4]为无色挥发性剧毒液体,熔点为-25 ℃,沸点为43 ℃,不溶于水,易溶于乙醇、乙醚、苯、四氯化碳等有机溶剂。四羰基镍的晶体类型是________,写出一种与其配体互为等电子体的分子的化学式:________。 (4)血红素铁是血液的重要组成部分,其结构如下图。 其中C原子的杂化方式为____________,N与Fe之间存在的相互作用是____________。在人体内合成血红素铁的基本原料之一为甘氨酸(),甘氨酸分子中的σ键和π键的个数比为______。 (5)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO______FeO(填“<”或“>”)。 - 7 - (6)嫦娥三号卫星上的PTC元件(热敏电阻)的主要成分钡钛矿的晶体结构如图所示。顶点位置被Ti4+所占据,体心位置被Ba2+所占据,所以棱心位置被O2-所占据。 ①O元素与H元素形成的简单化合物的立体构型为__________。 ②写出该晶体的化学式:______________。 5.超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。 (1)Mo处于第五周期ⅥB族,核外电子排布与Cr相似,它的基态价电子排布式是__________________;核外未成对电子数是________。 (2)该超分子中存在的化学键类型有__________。 A.σ键 B.π键 C.离子键 D.氢键 (3)该超分子中配体CO提供孤电子对的原子是________(填元素符号),p甲酸丁酯吡啶配体中C原子的杂化方式有__________。 (4)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因:_________________ ________________________________________________________________________。 (5)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是____________________________________________________________________ ________________________________________________________________________。 (6)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子, 其中Mo原子坐标是(0,0,0)及(,,)。根据以上信息, - 7 - 推断该晶体的原子堆积方式是________。 参考答案与解析 1.解析:(1)同周期元素的第一电离能从左向右呈增大趋势,且第ⅡA、ⅤA族元素因原子轨道处于全空、半满状态,导致其第一电离能大于其同周期相邻元素,故第一电离能:N>C>B。 (2)①根据结构可知,该晶体为离子晶体,含有离子键、共价键、配位键(HO→B)。②晶体R中阴离子的中心原子B形成3个σ键(B—F键)和1个配位键(HO→B),配位键也属于σ键,其立体构型为四面体形。 (3)根据配离子的结构图可知,N原子形成3个σ键和1个配位键,采取sp3杂化;乙二胺含有氨基,分子之间可以形成氢键,三甲胺分子之间不能形成氢键,故乙二胺比三甲胺的沸点高得多。 (4)B原子最外层有3个电子,由图丙所示晶体结构中每个B原子形成3个单键可知,六方相氮化硼不含π键;六方相氮化硼与石墨相似,具有层状结构,层间作用力弱,故质地软。 答案:(1)1s22s22p63s23p2 N>C>B (2)①abc ②四面体形 (3)sp3 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键 (4)不含 层间作用力弱 2.解析:(1)铜为29号元素,Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,Sn的核电荷数为50,为第ⅣA族元素,价电子排布式为5s25p2,易失去2个p轨道电子,化合价为+2,失去价电子层的4个电子,化合价为+4。(2)PH3分子中P的价层电子对数为3+=4,故P原子采用sp3杂化;N的电负性比P强,成键电子对更靠近N,导致成键电子对距离近,排斥力大,故键角大。(3)白磷(P4)为正四面体结构,为非极性分子,CS2为直线形结构,为非极性分子,H2O为V形结构,为极性分子,根据相似相溶原理,白磷易溶于CS2,难溶于水。(4)根据晶胞结构可知,该晶体中八面体顶点的6个Cu跟P等距离且最近,故P的配位数为6。 答案:(1)1s22s22p63s23p63d10(或[Ar]3d10) +2、+4 (2)sp3 小 N的电负性比P强,成键电子对更靠近N,导致成键电子对距离近,排斥力大,故键角大 (3)P4和CS2均为非极性分子,H2O为极性分子,根据相似相溶原理,白磷易溶于CS2, - 7 - 难溶于水 (4)6 3.解析:(1)Ca的原子序数为20,核外电子排布式为1s22s22p63s23p64s2或[Ar]4s2;CaC2中阳离子与阴离子个数比为1∶1。(3)原子数相等、价电子总数相等的微粒互为等电子体。互为等电子体的微粒结构相似,CO2为直线形分子,故CN的立体构型为直线形。(4)三聚氰胺分子中碳原子的杂化方式为sp2。(6)CaO晶胞中,与一个Ca2+距离最近且相等的O2-有6个,故Ca2+的配位数为6。 答案:(1)1s22s22p63s23p64s2或([Ar]4s2) Ca2+[C⋮⋮C]2- (2)C查看更多