2010-2019十年高考化学真题分类汇编专题13盐类的水解及沉淀的溶解平衡含解斩
专题13盐类的水解及沉淀的溶解平衡
1.(2019·浙江4月选考·24)聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确的是
A. KClO3作氧化剂,每生成1 mol[Fe(OH)SO4]n消耗6/nmol KClO3
B.生成聚合硫酸铁后,水溶液的pH增大
C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水
D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强
【答案】A
【解析】本题以聚合硫酸铁的制备和性质为背景考查氧化还原反应,盐类水解的原理、应用以及胶体的性质。FeSO4和KClO3反应生成[Fe(OH)SO4]n的化学方程式为6nFeSO4+nKClO3+3nH2O6[Fe(OH)SO4]n+nKCl,根据化学方程式可知,KClO3作氧化剂,每生成1 mol[Fe(OH)SO4]n消耗n/6 mol KClO3,A项错误;[Fe(OH)]2+的水解能力小于Fe2+,导致生成聚合硫酸铁后,溶液碱性增强,B项正确;[Fe(OH)] 2+可在水中水解生成Fe(OH)3胶体而净水,C项正确;比较Fe3+和[Fe(OH)]2+的水解能力,可以从二者所带电荷的多少来分析,所带正电荷越多,结合OH-的能力就越强,水解能力就越强,D项正确,故选A。
【技高一筹】利用氧化还原反应中得失电子守恒,可以快速求算消耗KClO3的物质的量:每生成1 mol [Fe(OH)SO4]n转移的电子为n mol,而1 mol KClO3参与反应时转移的电子为6 mol,故每生成1 mol[Fe(OH)SO4]n消耗KClO3的物质的量为n/6 mol,A项错误。
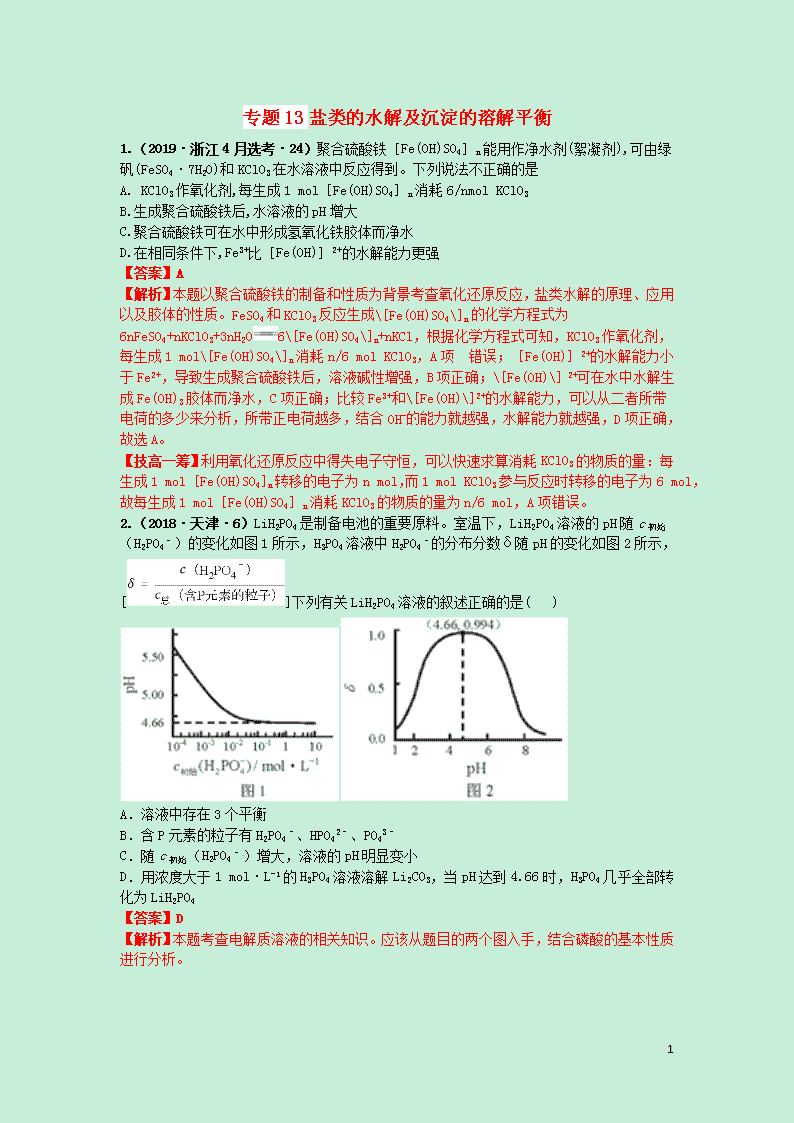
2.(2018·天津·6)LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[]下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO4–、HPO42–、PO43–
C.随c初始(H2PO4–)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
【答案】D
【解析】本题考查电解质溶液的相关知识。应该从题目的两个图入手,结合磷酸的基本性质进行分析。
25
D.由图2得到,pH=4.66的时候,δ=0.994,即溶液中所有含P的成分中H2PO4–占99.4%,所以此时H3PO4几乎全部转化为LiH2PO4。选项D正确。
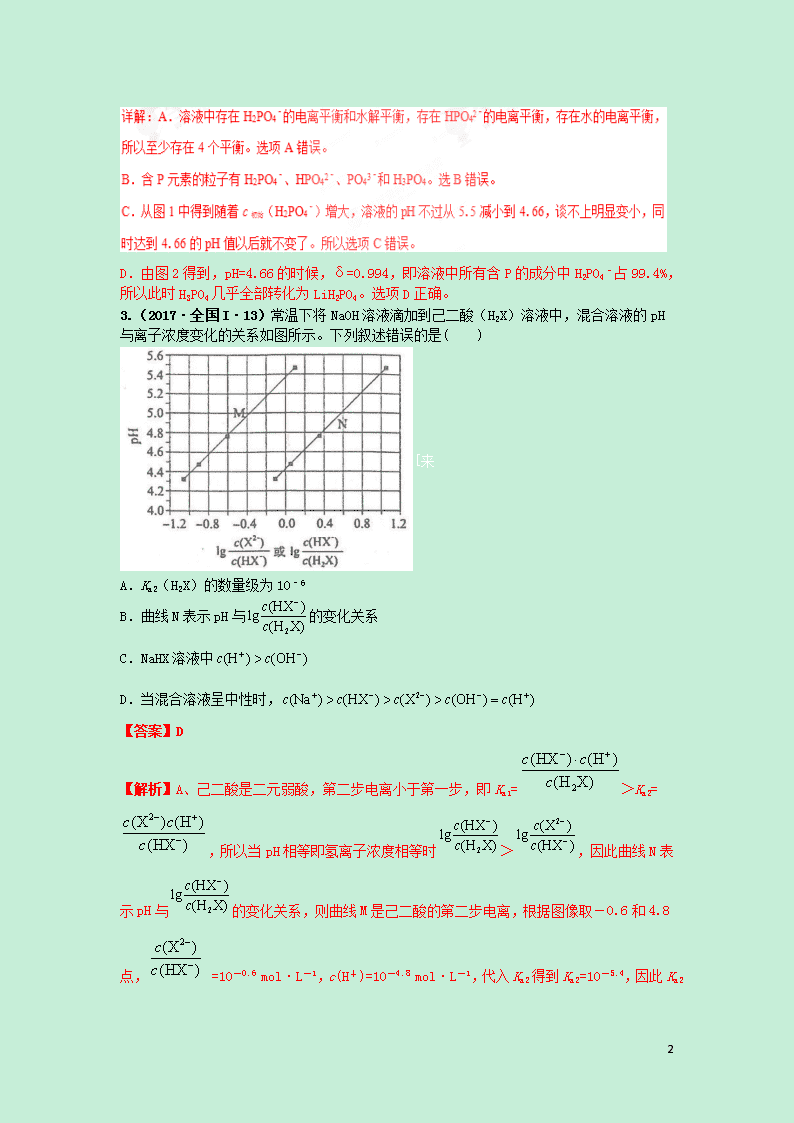
3.(2017·全国I·13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
[来
A.Ka2(H2X)的数量级为10–6
B.曲线N表示pH与的变化关系
C.NaHX溶液中
D.当混合溶液呈中性时,
【答案】D
【解析】A、己二酸是二元弱酸,第二步电离小于第一步,即Ka1=>Ka2=,所以当pH相等即氢离子浓度相等时>,因此曲线N表示pH与的变化关系,则曲线M是己二酸的第二步电离,根据图像取-0.6和4.8点, =10-0.6 mol·L-1,c(H+)=10-4.8 mol·L-1,代入Ka2得到Ka2=10-5.4,因此Ka2
25
(H2X)的数量级为10–6,A正确;B.根据以上分析可知曲线N表示pH与的关系,B正确;C. 曲线N是己二酸的第一步电离,根据图像取0.6和5.0点, =100.6 mol·L-1,c(H+)=10-5.0 mol·L-1,代入Ka1得到Ka1=10-4.4,因此HX-的水解常数是=10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-),C正确;D.根据图像可知当=0时溶液显酸性,因此当混合溶液呈中性时,>0,即c(X2–)>c(HX–),D错误;答案选D。
4.(2016·北京·11)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
【答案】C
【解析】
5.(2016·江苏·7)下列说法正确的是( )
25
A.氢氧燃料电池工作时,H2在负极上失去电子
B.0.1 mol/L Na2CO3溶液加热后,溶液的pH减小
C.常温常压下,22.4 L Cl2中含有的分子数为6.02×1023个
D.室温下,稀释0.1 mol/L CH3COOH溶液,溶液的导电能力增强
【答案】A
【解析】A、氢氧燃料电池工作时,H2发生氧化反应,在负极上失去电子,A正确;B、升高温度,促进碳酸钠的水解,溶液的pH增大,B错误;C、常温常压下,气体的摩尔体积大于22.4 L/mol,22.4 L Cl2中的物质的量小于1 mol,含有的分子数小于6.02×1023个,C错误;D、室温下,稀释稀醋酸,虽然电离平衡正向移动,自由移动离子的数目增加,但溶液体积的增大起主导作用,自由移动离子的浓度减小,溶液的导电能力减弱,D错误。答案选A。
6.(2015·天津·5)室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是( )
加入的物质
结论
A
50mL 1 mol·L-1H2SO4
反应结束后,c(Na+)=c(SO42-)
B
0.05molCaO
溶液中 增大
C
50mL H2O
由水电离出的c(H+)·c(OH—)不变
D
0.1molNaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
【答案】B
【解析】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,溶液中存在CO32—+H2O HCO3—+OH—溶液呈碱性;A项加入50mL 1 mol·L-1H2SO4,H2SO4与Na2CO3恰好反应,则反应后的溶液溶质为Na2SO4,故根据物料守恒反应结束后c(Na+)=2c(SO42-),故A项错误;向溶液中加入0.05molCaO,则CaO+ H2O=Ca(OH)2,则c(OH—)增大,且Ca2++CO32—=CaCO3↓,使CO32—+H2O HCO3—+OH—平衡左移,c(HCO3—)减小,故增大,故B项正确;C项加入50mL H2O,溶液体积变大,CO32—+H2O HCO3—+OH—平衡右移,但c(OH—)减小,Na2CO3溶液中H+、OH—均由水电离,故由水电离出的c(H+)·c(OH—)减小,故C项错误;D项加入0.1molNaHSO4固体,NaHSO4为强酸酸式盐电离出H+与CO32—反应,则反应后溶液为Na2SO4溶液,溶液呈中性,故溶液pH减小,引入了Na+,故c(Na+)增大,D项错误;本题选B。
7.(2014·福建·10)下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3===Na++H++CO
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO)+c(CO)
D. 温度升高,c(HCO)增大
【答案】B
【解析】NaHCO3的正确电离方程式为NaHCO3===Na++HCO,A项错误;根据KW=c(H+)·c(OH-)可得KW·V2=n(H+)·n(OH-),温度一定时,则KW不变,B项正确;C项电荷不守恒,错误;温度升高,HCO的水解和电离程度都增大,则c(HCO)减小,D项错误。
8.(2014·重庆·3)下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
25
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
【答案】D
【解析】浓氨水中滴加氯化铁饱和溶液产生氢氧化铁沉淀,A项错误;醋酸钠溶液中滴加浓盐酸后促使醋酸根离子的水解平衡向右移动,使醋酸根离子浓度减小,B项错误;碳酸氢钙与过量的氢氧化钠反应生成碳酸钙、水、碳酸钠,得不到氢氧化钙,C项错误;Cu(NO3)2溶液中的Cu2+能抑制Cu(OH)2的溶解,D项正确。
9.(2013·安徽·12)我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42- 最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
【答案】D
【解析】A、除去硫酸根的同时,引入了新的杂质硝酸根,错误;B、要得到钠和氯气需要电解熔融的NaCl,错误;C、增加氯离子的量,AgCl的沉淀溶解平衡向逆向移动,溶解度减小,错误;D、氯化钠溶液显中性,纯碱水呈碱性,正确。
10.(2011·广东·11)对于0.1mol•L-1Na2SO3溶液,正确的是
A、升高温度,溶液的pH降低
B、c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
C、c(Na+)+c(H+)=2 c(SO32―)+ 2c(HSO3―)+ c(OH―)
D、加入少量NaOH固体,c(SO32―)与c(Na+)均增大
【答案】D
【解析】本题考察盐类水解及外界条件对水解平衡的影响和溶液中离子浓度大小判断。Na2SO3属于强碱弱酸盐,水解显碱性,方程式为SO32-+H2OHSO3-+OH-、HSO3-+H2OH2SO3+OH-,因为水解是吸热的,所以升高温度,有利于水解,碱性会增强,A不正确;加入少量NaOH固体,c(OH―)增大,抑制水解,所以c(SO32―)增大,D是正确的;由物料守恒知钠原子个数是硫原子的2倍,因此有c(Na+)=2c(SO32―)+2 c(HSO3―)+ 2c(H2SO3),所以B不正确,有电荷守恒知c(Na+)+c(H+)=2 c(SO32―)+ c(HSO3―)+ c(OH―),因此C也不正确。
11.(2011·天津·8)下列说法正确的是
A.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-
C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
【答案】C
【解析】在稀溶液中水的离子积常数KW=c(H+)·c(OH-),KW只与温度有关而与溶液的酸碱性无关,由于水的电离是吸热的,因此温度升高时会促进水的电离,即KW会增大,例如25℃时KW=1×10-14,而在100℃时KW=1×10-12,所以选项A不正确;碘水具有氧化性,可以将二氧化硫氧化成硫酸,而单质碘被还原成碘离子,方程式为SO2+I2+2H2O=SO42-+2I-+4H+,选项B不正确;能和铝粉反应产生氢气的溶液既可以显酸性也可以显碱性,这四种离子:Na+、Ba2+、AlO2-、NO3-虽然在酸性溶液中不能大量共存(AlO2-会结合H+,生成氢氧化铝沉淀或生成Al3+),但可以在碱性溶液中大量共存,因此选项C正确;100℃时,KW=1×10-12,此时pH=2的盐酸其浓度为10-2
25
mol/L,但pH=12的NaOH溶液其其浓度为1mol/L,所以当二者等体积混合时NaOH过量,溶液显碱性,D不正确。
12.(2011·重庆·9)对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热 B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体 D.小苏打溶液中加入少量NaCl固体
【答案】B
【解析】本题考察外界条件对盐类水解及电离平衡的影响。盐类水解是吸热的,因此加热有利于水解反应向正方应方向移动,明矾中的Al3+水解,方程式为Al3++3H2OAl(OH)3+3H+,加热时酸性会增强,A不正确;CH3COONa水解显碱性,方程式为CH3COO-+H2OCH3COOH+OH-,加热时碱性会增强,所以溶液颜色会变深,B正确;氨水显碱性,溶液中存在下列电离平衡NH3·H2ONH4++OH-,加入少量NH4Cl固体,会增大NH4+的浓度,抑制氨水的电离,从而降低碱性,颜色会变浅,C不正确;NaHCO3属于强电解质,电离方程式为NaHCO3=Na++HCO3-,HCO3-同时电离和水解平衡,方程式为HCO3-H++CO32-,HCO3-+H2OH2CO3+OH-。由于水解程度大于电离程度,所以NaHCO3溶液显弱碱性,但加入少量NaCl固体时,对两个平衡不会产生影响,即颜色不发生变化,D不正确。
13.(2010·上海·14)下列判断正确的是
A.测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值
B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C.0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH
D.1L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1L mol·L-1硫化钠溶液吸收SO2的量
【答案】C
【解析】此题考查了实验操作、化学反应中的能量变化、溶液的pH、元素化合物等知识。测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,说明部分硫酸铜分解生成了氧化铜,测定值大于理论值,A错;氢原子转化为氢分子,形成化学键放出能量,说明2mol氢原子的能量大于1molH2,B错;碳酸的酸性弱于醋酸,故此相同浓度的碳酸钠溶液的pH大于醋酸钠溶液,C对;1L 1mol.L-1的溶液中含有溶质1mol,前者发生:Na2CO3+SO2+H2O=2NaHSO3+CO2↑;后者发生:2Na2S+5SO2+2H2O=4NaHSO3+3S↓;分析可知,很明显后者大于前者,D错。
【易错警示】此题解答是的易错点有二:一是对化学键的形成断开和吸热放热的关系不清,要能够准确理解断键吸热成键放热;二是忽视亚硫酸的酸性强于氢硫酸,不能准确判断硫化钠中通入二氧化硫时要生成氢硫酸,造成氢硫酸和亚硫酸能发生氧化还原反应生成单质硫。
14.(2010·四川·10)有关①100ml 0.1 mol/L 、②100ml 0.1 mol/L 两种溶液的叙述不正确的是
A.溶液中水电离出的个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中: D.②溶液中:
【答案】C
【解析】本题考查盐类水解知识;盐类水解促进水的电离,且Na2CO3的水解程度更大,碱性更强,故水中电离出的H+个数更多,A项正确;B②钠离子的物质的量浓度为0.2 mol/L而①钠离子的物质的量浓度为0.1 mol/L根据物料守恒及电荷守恒可知溶液中阴离子的物质的量浓度之和:②>①,B项正确;C项水解程度大于电离所以C(H2CO3)>C(CO32-)D项 C032-
25
分步水解第一步水解占主要地位且水解大于电离。判断D正确。C、D两项只要写出它们的水解及电离方程式即可判断。
题型二:溶液中微粒浓度大小关系的判
15.(2019·江苏·14)室温下,反应HCO3-+H2OH2CO3+OH-的平衡常数K=2.2×10-8。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A. 0.2 mol·L-1氨水:c(NH3·H2O)>c (NH4+)>c (OH-)>c (H+)
B.0.2 mol·L-1NH4HCO3溶液(pH>7):c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3·H2O)
C.0.2 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(NH4+)+c(NH3·H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.0.6 mol·L-1氨水和0.2 mol·L-1 NH4HCO3溶液等体积混合: c(NH3·H2O)+c(CO32-)+c(OH-)=0.3 mol·L-1+c(H2CO3)+c(H+)
【答案】BD
【解析】本题考查溶液中粒子浓度关系,考查的核心素养是变化观念与平衡思想。A项,氨水中存在NH3·H2ONH4++OH-,H2OH++OH-,氨水中NH3·H2O部分电离,所以主要以NH3·H2O分子形式存在,两个电离方程式均电离出OH-,所以c(OH-)>c(NH4+),错误;B项,NH4HCO3溶液显碱性,说明HCO3-的水解程度大于NH4+的水解程度,所以c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3·H2O),正确;C项,由物料守恒可,n(N)∶n(C)=2∶1,则有c(NH4+)+c(NH3·H2O)=2 [c(H2CO3)+c(HCO3-)+ c(CO32-)],错误;D项,由物料守恒可知,n(N)∶n(C)=4∶1,则有c(NH4+)+c(NH3·H2O)=4[c(H2CO3)+c(HCO3-)+ c(CO32-)]①,电荷守恒式为c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)②,结合①②消去c(NH4+),得:c(NH3·H2O)+c(OH-)=c(H+)+4c(H2CO3)+3c(HCO3-)+2c(CO32-)③,0.2 mol·L-1NH4HCO3溶液与0.6 mol·L-1氨水等体积混合后,c(NH4HCO3)=0.1 mol·L-1,由碳元素守恒可知, c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol·L-1④,将③等式两边各加一个c(CO32-),则有c(NH3·H2O)+ c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+3c(H2CO3)+ 3c(HCO3-)+3c(CO32-)⑤,将④代入⑤中得,c(NH3·H2O)+c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.3 mol·L-1,正确。
16.(2019·浙江4月选考·21)室温下,取20 mL 0.1 mol·L-1某二元酸H2A,滴加0.2 mol·L-1 NaOH溶液。
已知:H2AH++HA-,HA-H++A2-。下列说法不正确的是
A. 0.1 mol·L-1 H2A溶液中有c(H+ )-c(OH- )-c(A2-)=0.1 mol·L-1
B.当滴加至中性时,溶液中c(Na+)= c(HA-)+2 c(A2-),用去NaOH溶液的体积小于10 mL
C.当用去NaOH溶液体积10 mL时,溶液的pH<7 ,此时溶液中有c(A2-)=c(H+ )-c(OH-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2 c(HA-)+2 c(A2-)
【答案】B
【解析】本题以二元酸H2A与NaOH溶液反应为背景考查电解质溶液的相关知识。对于0.1 mol·L-1 H2A溶液而言,根据电荷守恒可知c(H+ )=c(OH- )+ c(HA-)+2c(A2-),根据物料守恒可知c(H2A)+ c(HA-)+ (A2-)=0.1 mol·L-1,又H2A第一步完全电离,故c(H2A)=0,将c(HA-)+ c(A2-)=0.1 mol·L-1代入c(H+ )=c(OH- )+ c(HA-)+2 c(A2-)可得c(H+ )=c(OH-)+ c(A2-)+0.1 mol·L-1,故c(H+ )- c(OH- )- c(A2-)=0.1 mol·L-1,A项正确;当溶液呈中性时c(H+ )=c(OH- ),由电荷守恒可得c(Na+)=c(HA-)+2 c(A2-),若用去的NaOH溶液体积为10 mL,此时溶液的溶质为NaHA,由于HA-只电离,不水解,故此时溶液呈酸性,要使溶液呈中性,则NaOH溶液的体积必须大于10 mL,B项错误;当用去NaOH溶液体积10
25
mL时,溶液中的溶质为NaHA,HA-只电离,不水解,此时溶液呈酸性,pH<7,由HA-H++ A2-,H2OH++OH-,根据质子守恒得c(H+ )=c(OH- )+c(A2-),故c(A2-)=c(H+ )- c(OH- ),C项正确;当用去NaOH溶液体积20 mL时,根据物料守恒可知c(Na+)=2 c(HA-)+2 c(A2-),D项正确,故选B。
【教你解题】解答本题的关键是审清已知中二元酸H2A第一步是完全电离的,这就导致HA-只电离不水解,且溶液中不存在H2A分子。
17.(2018·江苏·14)H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2,Ka2 (H2C2O4 ) =5.4×10−5,设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L−1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.1000 mol·L−1 H2C2O4溶液:c(H+ ) =0.1000 mol·L−1+c(C2O42− )+c(OH−)−c(H2C2O4 )
B.c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42− ) >c(H+ )
C.pH = 7的溶液:c(Na+ ) =0.1000 mol·L−1+ c(C2O42−) −c(H2C2O4)
D.c(Na+ ) =2c(总)的溶液:c(OH−) −c(H+) = 2c(H2C2O4) +c(HC2O4−)
【答案】AD
【解析】A项,H2C2O4溶液中的电荷守恒为c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),0.1000 mol·L−1H2C2O4溶液中0.1000mol/L=c(H2C2O4) + c(HC2O4-)+ c(C2O42-),两式整理得c(H+)=0.1000mol/L-c(H2C2O4)+c(C2O42-)+c(OH-),A项正确;B项,c(Na+)=c(总)时溶液中溶质为NaHC2O4,HC2O4-既存在电离平衡又存在水解平衡,HC2O4-水解的离子方程式为HC2O4-+H2OH2C2O4+OH-,HC2O4-水解常数Kh=====1.8510-13Ka2(H2C2O4),HC2O4-的电离程度大于水解程度,则c(C2O42-)c(H2C2O4),B项错误;C项,滴入NaOH溶液后,溶液中的电荷守恒为c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),室温pH=7即c(H+)=c(OH-),则c(Na+)=c(HC2O4-)+2c(C2O42-)=c(总)+c(C2O42-)-c(H2C2O4),由于溶液体积变大,c(总)0.1000mol/L,c(Na+)0.1000mol/L +c(C2O42-)-c(H2C2O4),C项错误;D项,c(Na+)=2c(总)时溶液中溶质为Na2C2O4,溶液中的电荷守恒为c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),物料守恒为c(Na+)=2[c(H2C2O4) + c(HC2O4-)+ c(C2O42-)],两式整理得c(OH-)-c(H+)=2c(H2C2O4)+c(HC2O4-),D项正确;答案选AD。
18.(2016·江苏·14)H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
25
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)>2c(C2O42–)
【答案】BD
【解析】A.根据图像知pH=2.5的溶液中,c(H2C2O4)+ c(C2O42-)< c(HC2O4-),错误;B.根据物料守恒和电荷守恒分析,c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-),正确;C.根据图像可知c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)<0.100 mol·L-1+ c(HC2O4-),错误;D.由图像知pH=7的溶液为草酸钠溶液,草酸根水解,c(Na+)>2 c(C2O42-),正确。
19.(2016·四川·7)向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 mol
c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C
0.015
c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D
0.03
c(Na+)> c(HCO3-)> c(OH-)>c(H+)
【答案】D
【解析】向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入二氧化碳,首先进行的反应为氢氧化钠和二氧化碳反应生成碳酸钠和水,0.02mol氢氧化钠消耗0.01 mol二氧化碳,生成0.01 mol碳酸钠;然后偏铝酸钠和二氧化碳反应生成氢氧化铝和碳酸钠,0.01 mol偏铝酸钠消耗0.005 mol二氧化碳,生成0.005 mol碳酸钠;再通入二氧化碳,二氧化碳和碳酸钠反应生成碳酸氢钠,消耗0.015 mol二氧化碳,生成0.03 mol碳酸氢钠。A、未通入二氧化碳时,根据溶液中的电荷守恒有c(Na+)+c(H+)=c(AlO2-)+c(OH-),c(Na+)<c(AlO2-)+c(OH-),错误;B、当通入的二氧化碳为0.01 mol时,则溶液为含有0.01 mol碳酸钠和0.01 mol偏铝酸钠的混合液,氢氧根离子浓度小于碳酸根离子浓度,错误;C、当通入的二氧化碳为0.015 mol时溶液中含有0.015 mol碳酸钠,离子浓度的关系为c(Na+)> c(CO32-) > c(OH-) >c(HCO3-),故错误;D、当通入二氧化碳的量为0.03 mol时,溶液为碳酸氢钠溶液,溶液显碱性,离子浓度关系为c(Na+)> c(HCO3-)> c(OH-)>c(H+),故正确。
20.(2015·安徽·13)25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
【答案】B
【解析】A项,浓度相同但是NaOH完全电离,NH3·H2O部分电离,故c(Na+) >c(NH3·H2O),错误;B项,加入10mL盐酸时,溶液中c(Cl-) = c(Na+),根据电荷守恒c(Na+) +c(NH4+) +c(H+) =c(Cl-) + c(OH-),正确;C项,加入盐酸至溶液pH=7时,溶液中溶质为氯化钠、氯化铵和氨水,故c(Cl-) > c(Na+),错误;D项,加入20mL盐酸时,溶质为氯化钠和氯化铵,铵根离子水解使溶液显酸性,故根据电荷守恒,c(Cl-) >c(NH4+) +c(Na+),错误。
21.(2015·浙江·12)40℃时,在氨-水体系中不断通入CO2
25
,各种离子的变化趋势如下图所示。下列说法不正确的是( )
A.在pH=9.0时,c(NH4+)>c(HCO)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
【答案】C
【解析】
22.(2015·四川·6)常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A.<1.0×10-7mol/L
B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
【答案】C
【解析】
25
23.(2015·四川·8)下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LNaHCO 3 溶液中:c(Na + )>c(OH - )>c(HCO3 - )>c(H + )
B.25℃时,pH=2的盐酸与pH=12的氨水等体积混合后,混合液中:c(H + )=c(OH - )
C.0.1mol/LNa 2 S溶液中:c(HS - )+c(H 2 S)+c(H + )=c(OH - )
D. 醋酸溶液与氢氧化钠溶液混合后溶液呈酸性,混合液中:c(CH 3COO - )>c(Na + )
【答案】D
【解析】A.NaHCO 3 溶液呈碱性,HCO 3 - 水解程度一般较小,应为c(Na + )>c(HCO 3 - )>c(OH -)>c(H + ),故A错误;B.pH=2的盐酸与pH=12的氨水等体积混合后,一水合氨为弱电解质,氨水过量,溶液呈碱性,故B错误;C.从质子守恒的角度分析,应存在:c(HS - )+2c(H 2 S)+c(H + )=c(OH - ),故C错误;D.醋酸溶液与氢氧化钠溶液混合后溶液中存在c(CH 3 COO - )+c(OH - )=c(Na + )+c(H +),溶液呈酸性,c(H + )>c(OH - ),则c(CH 3 COO - )>c(Na + ),故D正确.故选D.
24.(2015·江苏·14)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
【答案】D
【解析】A项,根据电荷守恒可知:c(NH4+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),溶液呈中性,则c(H+)=c(OH-),故c(NH4+)=c(HCO3-)+2c(CO32-),错误;B项,根据电荷守恒可知:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),根据物料守恒可知:c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),溶液呈中性,则c(H+)=c(OH-),三式联立可得:c(HSO3-)+c(NH4+)=c(SO32-),则c(NH4+)c(CH3COOH), 根据混合溶液的电荷守恒有:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),溶液呈中性,则c(H+)=c(OH-),由此可知c(Na+)=c(Cl-)+c(CH3COO-),进而可知c(CH3COOH)=c(Cl-),故c(Na+)>c(CH3COOH)=c(Cl-),正确。
25.(2014·天津·5)下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(SO)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO)=2c(CO)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O)+c(C2O)+c(H2C2O4)]
【答案】C
25
【解析】由溶液中的电荷守恒得:c(Na+)+c(H+)=2c(SO)+c(OH-),又因NaHSO4溶液中c(Na+)=c(SO),所以c(H+)=c(SO)+c(OH-),A项正确;因Ksp(AgCl)>Ksp(AgI),所以含有AgCl和AgI固体的悬浊液中c(Cl-)>c(I-),B项错误;CO2的水溶液中存在电离平衡:H2CO3H++HCO、HCOH++CO,因第一步电离的程度远大于第二步电离的程度,故溶液中c(HCO)远大于2c(CO),C项错误;根据物料守恒得:2c(Na+)=3[c(HC2O)+c(C2O)+c(H2C2O4)],故D项错误。
26.(2014·浙江·12)下列说法正确的是( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
【答案】B
【解析】金属汞洒落后,对于无法收集的应加硫黄粉使其转化为极难溶于水的HgS,A项错误;乙酸乙酯是非电解质,它不能导电,它的水解产物乙酸是电解质(弱酸),溶液能导电,B项正确;当称量的邻苯二甲酸氢钾的读数比实际质量偏大时,造成所配制的邻苯二甲酸氢钾溶液的浓度偏小,则所消耗的邻苯二甲酸氢钾溶液的体积偏大,则测得的NaOH溶液浓度比实际浓度偏大,C项错误;许多氨基酸也能与茚三酮发生反应生成蓝色沉淀,D项错误。
27.(2014·山东·13)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH)=c(CH3COO-)
【答案】D
【解析】水的电离程度先增大,当反应完全后,随氨水的加入,水的电离程度减小,A项错误;溶液中=,滴定过程中Kb(NH3·H2O)不变,溶液中c(OH-)一直增大,一直减小,B项错误;利用原子守恒知溶液中n(CH3COOH)与n(CH3COO-)之和不变,滴定过程中溶液体积不断增大,c(CH3COOH)与c(CH3COO-)之和不断减小,C项错误;由CH3COOH与NH3·H2O的电离程度相等可知CH3COONH4溶液呈中性,当加入等体积氨水时,溶液恰好为CH3COONH4溶液,利用电荷守恒知溶液中c(NH)=c(CH3COO-),D项正确。
28.(2014·全国II·12)一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】H2S中存在两步可逆电离,c(H+)=1×10-5 mol·L-1>c(HS-),A项错误;一水合氨是弱电解质,加水稀释时促进其电离平衡向正向移动,c(H+)减小程度小于10倍,即a<
25
b+1,B项错误;混合溶液中存在电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(HC2O)+2c(C2O),C项错误;组成盐的酸根对应的酸越弱,该盐的水解程度越大,等pH时其浓度越小,HCO对应的弱酸是H2CO3,D项正确。
29.(2014·安徽·12)室温下,下列溶液中粒子浓度关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
【答案】B
【解析】在Na2S溶液中存在H2OOH-+H+以及S2-+H2OHS-+OH-、HS-+H2OH2S+OH-,溶液中粒子浓度关系为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S)>c(H+),A项错误;利用质子守恒知Na2C2O4溶液中存在c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4),B项正确;利用电荷守恒知Na2CO3溶液中,c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),C项错误;利用原子守恒可知CH3COONa和CaCl2的混合液中c(Na+)+c(Ca2+)=c(CH3COOH)+c(CH3COO-)+c(Cl-),D项错误。
30.(2014·江苏·14)25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合:
c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):
c(NH3·H2O)>c(NH)>c(Cl-)>c(OH-)
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:
c(Na+)=c(CO)+c(HCO)+c(H2CO3)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O)+c(HC2O)+c(OH-)=c(Na+)+c(H+)
【答案】AC
【解析】两溶液混合时生成等量的CH3COOH和NaCl,由于CH3COOH能微弱电离,故c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),A项正确;B项混合液显碱性,说明NH3·H2O的电离程度大于NH4Cl中NH的水解程度,故溶液中c(NH)>c(Cl-)>c(NH3·H2O)>c(OH-),B项错误;C项,由于c(Na)∶c(C)=3∶2,根据物料守恒可知C项正确;D项溶液中的电荷守恒式为2c(C2O)+c(HC2O)+c(OH-)+c(Cl-)=c(Na+)+c(H+),D项错误。
31.(2014·四川·12)下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:
c(Na+)>c(CO)>c(HCO)>c(OH-)
B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH)+c(OH-)
D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:
c(OH-)>c(H+)+c(CH3COOH)
【答案】B
【解析】两者等体积混合得到碳酸钠溶液,存在二级水解,则氢氧根离子浓度大于碳酸氢根离子浓度, A项错误;混合后得到等物质的量浓度的CH3COOH 、CH3COONa、
25
NaCl的混合溶液,根据混合后呈酸性,则CH3COOH的电离程度大于CH3COONa的水解程度,c(CH3COO-)>c(CH3COOH)>c(H+), B项正确;根据电荷守恒:c(H+)+c(NH)=c(OH-)+c(Cl-),混合后溶液呈碱性,c(H+)c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO)=2c(CO)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O)+c(C2O)+c(H2C2O4)]
【答案】A
【解析】由溶液中的电荷守恒得:c(Na+)+c(H+)=2c(SO)+c(OH-),又因NaHSO4溶液中c(Na+)=c(SO),所以c(H+)=c(SO)+c(OH-),A项正确;因Ksp(AgCl)>Ksp(AgI),所以含有AgCl和AgI固体的悬浊液中c(Cl-)>c(I-),B项错误;CO2的水溶液中存在电离平衡:H2CO3H++HCO、HCOH++CO,因第一步电离的程度远大于第二步电离的程度,故溶液中c(HCO)远大于2c(CO),C项错误;根据物料守恒得:2c(Na+)=3[c(HC2O)+c(C2O)+c(H2C2O4)],故D项错误。
33.(2013·广东·12)50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0mol·L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1
【答案】C
【解析】50℃时,水的离子积常数大于1×10—14。pH=4的醋酸中,c(H+)=1×10—4 mol/L,A错误;饱和小苏打溶液中,HCO3—会发生水解反应导致浓度减小,c(Na+)>c(HCO3—),B错误;饱和食盐水中,c(Na+)+c(H+)=c(OH—)+c(Cl—)符合电荷守恒的关系,C正确;pH=12的碳酸钠溶液中, c(OH—)=KW/1×10—12>1×10—2 mol/L,D错误。
34.(2012·江苏·15)25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关离子浓度关系叙述正确的是
A.pH=5.5溶液中:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点表示溶液中:
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.pH=3.5溶液中:
c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1
D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):
c(H+)=c(CH3COOH)+c(OH-)
【答案】BC
【解析】本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,高三复习中要反复加强训练。
A.pH=5.5比4.75大,从曲线来看CH3COOH的电离在增大,CH3COO-
25
的水解在减小,不可能出c(CH3COOH)>c(CH3COO-)。BC.W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)是完全正确的,其实这关系在溶液中始终存在。pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol·L-1代入即可。D.向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡。溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒关系为:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.1mol·L-1 ,不可能得出上述结论。
35.(2012·四川·10)常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+) >c(OH-)=c(H+)
D.0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合:
2c(H+)-2c(OH-)=C(CH3COO-)-C(CH3COOH)
【答案】D
【解析】本题考查溶液中离子浓度的大小比较。A项不符合电荷守恒,错;pH=8.3的NaHCO3的溶液中,则HCO3—的水解大于电离,故CO32—的浓度小于H2CO3,B错;pH=11的氨水与pH=3的盐酸等体积混合,氨水过量,溶液显碱性,C项错误;根据物料守恒,的项正确。
36.(2012·天津·5)下列电解质溶液的有关叙述正确的是 ()
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)=c(HCO)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
【答案】D
【解析】该题考察电解质溶液中的离子浓度大小问题、酸碱混合后的PH只大小、难溶电解质的溶解平衡等化学理论基础知识。A.同浓度、同体积的强酸和强碱混合后,PH值的大小取决于是否恰好反应,是酸过量还是碱过量。如HCl+NaOH、H2SO4+NaOH、HCl+Ba(OH)2,选项错误。B.含BaSO4的溶液中存在平衡BaSO4(s)Ba2+(aq)+SO42-(aq),加硫酸钠固体,溶液中c(SO42-)增大,溶解平衡向左移动,c(Ba2+)减小,选项错误。C.1molKOH与1molCO2反应恰好生成1molKHCO3,HCO3-即电离又水解,c(K+)>c(HCO3-),选项错误。D.CH3COONa溶液显碱性,加适量CH3COOH可使溶液显中性,c(H+)=c(OH-),由电荷守恒知c(Na+)=c(CH3COO-).
37.(2012·北京·25)直接排放含So2,的烟气会形成胶雨,危害环境。利用钠碱循环法可脱除烟气中的So2,.
(1)用化学方程式表示So2:形成硫酸型胶雨的反应:
(2)在钠碱循环法中,Na₂SO₃,溶液作为吸收液,可由NaOH溶液吸收SO₂:制得,该反应的离子方程式是
(3)吸收液吸收SO₂的过程中,pH随n(SO₃ ²﹣):,n(HSO₃﹣)变化关系如下表:
n(SO₃ ²﹣):,n(HSO₃﹣)
91:9
1:1
1:91
PH
8.2
7.2
6.2
①上表判断Na₂SO₃溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
25
【答案】⑴SO2+H2OH2SO3,2H2SO3+O22H2SO4(2分)
⑵SO2+2OH—=SO32—(2分)
⑶①酸性(1分) HSO3—中存在:HSO3—H++SO32—和HSO3—+H2OH2SO3+OH—,HSO3—电离程度大于其水解程度(2分)
②a b(2分)
【解析】(1)酸雨形成的原因是二氧化硫与水反应生成亚硫酸,亚硫酸被空气中的氧气氧化为硫酸。(2)二氧化硫与过量的NaOH溶液反应生成亚硫酸钠溶液。(3)由表给数据n(SO32—):n(HSO3—)=9:91时,溶液PH=6.2,所以亚硫酸钠溶液显酸性。亚硫酸钠溶液中存在两种趋势,电离趋势使溶液显酸性,水解趋势使溶液显碱性,溶液显酸性显而易见是电离趋势大于水解趋势的结果;由表给数据n(SO32—):n(HSO3—)=1:1时,溶液PH=7.2,可知吸收液显中性必然是亚硫酸钠和亚硫酸钠的混合液,溶液中电荷守恒的关系为:c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—),由此可判断a正确,c不正确。
38.(2011·江苏·14)下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:
c(CO32-)> c(HCO3-)> c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1]:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
【答案】B
【解析】本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,高三复习中要反复加强训练。
A.在0.1 mol·L-1NaHCO3溶液中,HCO3-在溶液中存在水解与电离两个过程,而溶液呈碱性,说明水解过程大于电离过程,c(H2CO3)>c(CO32-)
B.c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)中把c(H+)移项到等式另一边,即是质子守恒关系式。
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液后,相当于0.05 mol·L-1的Na2CO3溶液和NaHCO3溶液的混合液,由于Na2CO3的水解程度大于NaHCO3的水解程度,因此正确的关系是:c(HCO3-)>c(CO32-)> c(OH-)>c(H+)。
D.常温下,CH3COONa和CH3COOH混合溶液,包括CH3COO-水解和CH3COOH电离两个过程,既然pH=7, 根据电荷守恒式,不难得出c(Na+)=c(CH3COO-) =0.1 mol· L-1,c(H+)=c(OH-)=1×10-7 mol·L-1。水解是有限的,c(CH3COOH)>c(CH3COO-)。
39.(2011·天津·13)25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)
B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-)
C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)
D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+)
【答案】D
25
【解析】pH>7时,c(H+)不可能大于c(OH-)的,所以选项A明显不正确;由溶液中的电荷守恒定律知:c(K+)+c(H+)=c(C6H5O-)+c(OH-),所以不可能满足c(K+)>c(C6H5O-)>c(H+)>c(OH-),即选项B不正确;中苯酚是一种极弱的酸,所以当KOH溶液和苯酚恰好反应,产物苯酚钾会发生水解反应而显碱性。由题中数据不难计算出,当二者恰好反应时消耗苯酚的体积是10ml,此时溶液中粒子的浓度大小关系为:
c(K+)>c(C6H5O-)>c(OH-)>c(H+),所以选项C是不正确的;当加入苯酚的体积是20ml时,苯酚过量,溶液是由等物质的量浓度的苯酚和苯酚钾组成,所以根据物料守恒可知c(C6H5O-)+c(C6H5OH)=2c(K+)一定成立,因此选项D是正确的。
40.(2010·广东·12)HA为酸性略强与醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+ c(OH-)= c(A-)+ c(H+)
D.c(Na+)+ c(H+) = c(A-)+ c(OH-)
【答案】D
【解析】A明显错误,因为阳离子浓度都大于阴离子浓度,电荷不守恒;D是电荷守恒,明显正确。NaA的水解是微弱的,故c(A-)>c(OH-),B错;C的等式不符合任何一个守恒关系,是错误的.
41.(2010·上海·16)下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+]
B.pH=2的一元酸和pH=12的一元强碱等体积混合: [OH-]= [H+]
C.0.1 mol·L-1的硫酸铵溶液中:[NH4+]>[SO42-]>[H+]
D.0.1 mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]
【答案】C
【解析】此题考查了溶液中的微粒浓度的大小比较。氨水和氯化铵混合溶液的pH=7时,溶液中[H+]=[OH-],则[Cl-]=[NH4+],A错;由于pH=2的酸的强弱未知,当其是强酸正确,当其是弱酸时,酸过量则溶液中[H+]>[OH-],B错;1mol.L-1的硫酸铵溶液中,铵根离子部分水解,根据物质的组成,可知:[NH4+]>[SO42-]>[H+],C对;1mol.L-1的硫化钠溶液中,根据物料守恒,可知[OH-]=[H+]+[HS-]+2[H2S],D错。
【技巧点拨】在解答溶液中微粒浓度的大小比较类的题目时,核心是抓住守恒,其包括:电荷守恒、物料守恒和质子(氢离子)守恒。其中电荷守恒是指溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数;物料守恒是指原子个数守恒或质量守恒;质子守恒:是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。
题型三:沉淀溶解平衡
42.(2019·全国II·12)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
25
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)O,反应中钠熔化为小球,说明反应放出大量的热,即△H<0,则△G=△H-T△S<0,故该反应自发进行,故A正确;B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,饱和Na2SO4溶液降低蛋白质溶解度,为盐析现象,为可逆过程,再加入水可以溶解,硝酸具有强氧化性,使蛋白质变性,过程不可能,二者原理不同,故B正确;C.FeCl3和MnO2对H2O2分解催化效果不相同,同等条件下H2O2分解速率的改变不相同,故C错误;D.NH4Cl溶液中铵根离子水解呈酸性,消耗Mg(OH)2(s)溶解平衡中的氢氧根离子,使Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq)平衡右移,故Mg(OH)2可溶于NH4Cl溶液,故D正确。
47.(2014·重庆·3)下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
【答案】D
【解析】浓氨水中滴加氯化铁饱和溶液产生氢氧化铁沉淀,A项错误;醋酸钠溶液中滴加浓盐酸后促使醋酸根离子的水解平衡向右移动,使醋酸根离子浓度减小,B项错误;碳酸氢钙与过量的氢氧化钠反应生成碳酸钙、水、碳酸钠,得不到氢氧化钙,C项错误;Cu(NO3)2溶液中的Cu2+能抑制Cu(OH)2的溶解,D项正确。
48.(2014·全国I·11)溴酸银(AgBrO3)溶解度随温度变化的曲线如图所示,下列说法错误的是( )
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速率加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
【答案】A
25
【解析】由图像可知随着温度的升高,AgBrO3的溶解度逐渐增大,即AgBrO3的溶解是吸热过程,A项错误;温度升高,其溶解速率加快,B项正确;60 ℃时c(AgBrO3)==2.5×10-3mol/L,其Ksp=c (Ag+)·c (BrO)≈6×10-4,C项正确;AgBrO3的溶解度较小,若KNO3中混有AgBrO3,可采用降温重结晶的方法提纯,D项正确。
49.(2014·安徽·12)中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
选项
规律
结论
A
较强酸可以制取较弱酸
次氯酸溶液无法制取盐酸
B
反应物浓度越大,反应速率越快
常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完
C
结构和组成相似的物质,沸点随相对分子质量增大而升高
NH3的沸点低于PH3
D
溶解度小的沉淀易向溶解度更小的沉淀转化
ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
【答案】D
【解析】次氯酸分解生成盐酸和氧气,A项错误;常温下,铝遇浓硝酸发生“钝化”,铝片不能溶解,B项错误;NH3分子间存在氢键,沸点高于PH3,C项错误;CuS比ZnS更难溶,因此向ZnS沉淀中滴加CuSO4溶液可实现沉淀转化,生成CuS沉淀,D项正确。
50.(2014·天津·5)下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(SO)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO)=2c(CO)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O)+c(C2O)+c(H2C2O4)]
【答案】A
【解析】由溶液中的电荷守恒得:c(Na+)+c(H+)=2c(SO)+c(OH-),又因NaHSO4溶液中c(Na+)=c(SO),所以c(H+)=c(SO)+c(OH-),A项正确;因Ksp(AgCl)>Ksp(AgI),所以含有AgCl和AgI固体的悬浊液中c(Cl-)>c(I-),B项错误;CO2的水溶液中存在电离平衡:H2CO3H++HCO、HCOH++CO,因第一步电离的程度远大于第二步电离的程度,故溶液中c(HCO)远大于2c(CO),C项错误;根据物料守恒得:2c(Na+)=3[c(HC2O)+c(C2O)+c(H2C2O4)],故D项错误。
51.(2013·江苏·14)一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),
pc(CO32-)=-lgc(CO32-)。下列说法正确的是
A.MgCO3、CaCO3、MnCO3 的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D.c点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-)
【答案】BD
【解析】本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。图线变化隐含pH的实质。
A.pM 、pc(CO32-)与pH一样,图线中数值越大,实际浓度越小。因此,MgCO3、CaCO3、MnCO3 的Ksp依次减小。B.a点在曲线上,可表示MnCO3的饱和溶液,又在中点,故c(Mn2+)=
25
c(CO32-)。C.b点可表示CaCO3的饱和溶液,但图线中数值越大,实际浓度越小,故c(Ca2+)>c(CO32-)。D.c点在曲线上方,可表示MgCO3 的不饱和溶液,且图线中数值越大,实际浓度越小,故c(Mg2+)<c(CO32-)。
52.(2013·北京·10)实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCI溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;
③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
浊液a中存在沉淀溶解平衡:
滤液b中不含有Ag+
③中颜色变化说明AgCI 转化为AgI
实验可以证明AgI比AgCI更难溶
【答案】B
【解析】A、绝对不溶的物质没有,难溶物质在溶液中存在沉淀溶解平衡,故正确;B、溶液中存在沉淀溶解平衡,滤液中含有Ag+,故错误;C、D选项沉淀由白色变为黄色,说明生成AgI,反应向更难溶的方向进行,故正确。
53.(2013·全国I·11)已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A、Cl-、Br-、CrO42- B、CrO42-、Br、Cl-
C、Br-、Cl-、CrO42- D、Br、CrO42-、Cl-
【答案】C
【解析】设Cl-、Br-、CrO42- 刚开始沉淀时,银离子的浓度分别为x mol、y mol、z mol,则根据Ksp可得: 0.01x=1.56×10-10 ,0.01y=7.7×10-13 ,0.01z2=9×10-11 。
可分别解出x≈1.56×10-8 y≈7.7×10-13 z≈3××10-4.5
可知y
查看更多