- 2021-07-05 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版化学实验基础作业
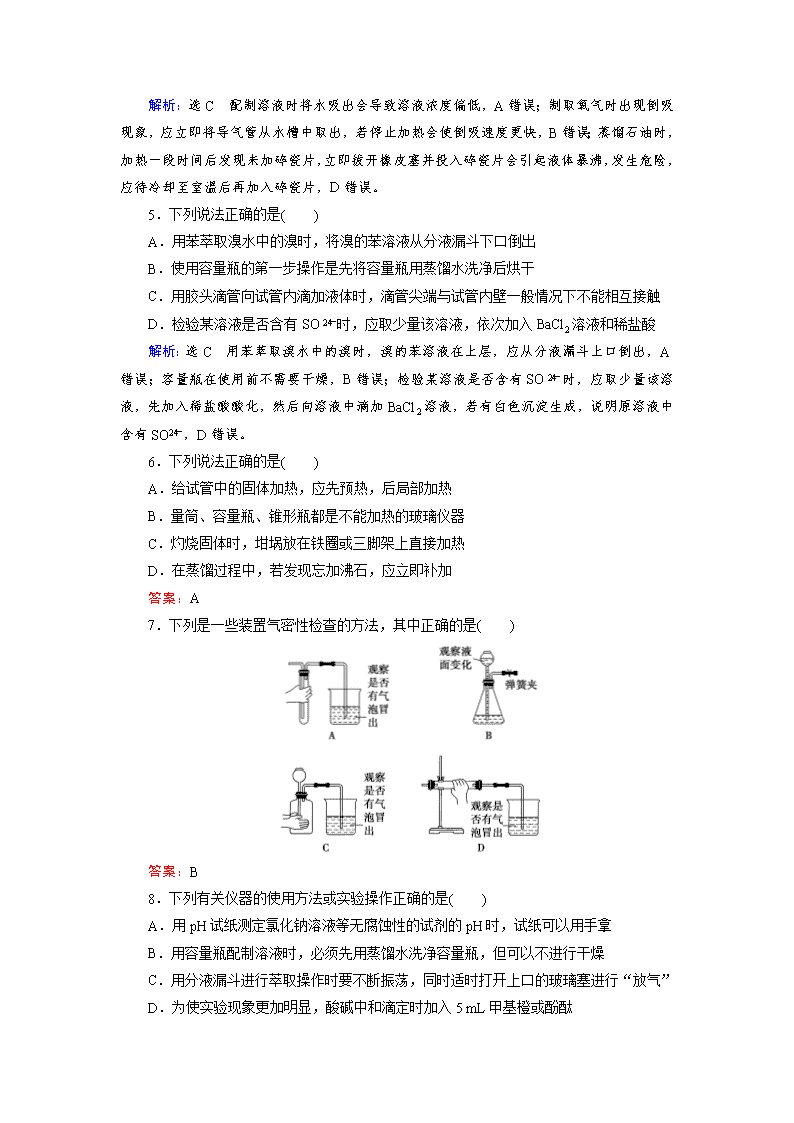
化学实验基础 1.下列药品的保存方法正确的是( ) A.短期保存Br2:盛于磨口的细口瓶中,并用水封,瓶盖严密 B.锂、钠、钾都保存在煤油中,密封 C.氨水、浓盐酸易挥发,必须保存在棕色磨口细口瓶中 D.红磷无需密封保存 解析:选A 液溴易挥发,短期保存液溴,可盛于磨口的细口瓶中,并水封,瓶盖严密,A正确;钠、钾可以保存在煤油中,但锂的密度小于煤油的密度,应密封在石蜡中,B错误;氨水、浓盐酸易挥发,密封保存在磨口细口瓶中即可,不需要棕色瓶,C错误;红磷易被氧化,需要密封保存,D错误。 2下列有关仪器使用方法或实验操作正确的是( ) A.做焰色反应实验时,铂丝可用玻璃棒、铁丝等代替 B.蒸发皿、坩埚、燃烧匙、烧瓶等仪器可直接加热 C.可以用酸式滴定管量取20.00 mL双氧水 D.分离水和汽油两层液体时,先打开活塞使水流出,再将汽油从下口放出 解析:选C 玻璃中含有硅酸钠,焰色反应呈黄色,对焰色反应的观察产生干扰,A错误;烧瓶不能直接加热,B错误;分离水和汽油两层液体时,先打开活塞使水流出,再关闭活塞,将汽油从分液漏斗的上口倒出,D错误。 3.下列实验装置(部分夹持装置略)或操作设计正确且能达到实验目的的是( ) 解析:选C 容量瓶只能用于配制溶液,不能在容量瓶中稀释浓硫酸,A错误;向沸水中滴加饱和氯化铁溶液,继续加热至红褐色透明状,即可得到氢氧化铁胶体,不能用玻璃棒搅拌,B错误;碱式滴定管带有橡皮管,该图装置正确,C正确;称量NaOH固体应用小烧杯或表面皿,用托盘天平称量时应遵循“左物右码”的原则,D错误。 4.下列实验操作或对事故的处理方法正确的是( ) A.配制0.1 mol·L-1 NaCl溶液,定容时不小心加水超过刻度线,立即将水吸出 B.实验室制取氧气并用排水法收集,出现倒吸现象,立即停止加热 C.少量浓硫酸沾在皮肤上,立即用大量水冲洗,并涂上稀NaHCO3溶液 D.蒸馏石油时,加热一段时间后发现未加碎瓷片,立即拔开橡皮塞并投入碎瓷片 解析:选C 配制溶液时将水吸出会导致溶液浓度偏低,A错误;制取氧气时出现倒吸现象,应立即将导气管从水槽中取出,若停止加热会使倒吸速度更快,B错误;蒸馏石油时,加热一段时间后发现未加碎瓷片,立即拔开橡皮塞并投入碎瓷片会引起液体暴沸,发生危险,应待冷却至室温后再加入碎瓷片,D错误。 5.下列说法正确的是( ) A.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 B.使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗净后烘干 C.用胶头滴管向试管内滴加液体时,滴管尖端与试管内壁一般情况下不能相互接触 D.检验某溶液是否含有SO时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 解析:选C 用苯萃取溴水中的溴时,溴的苯溶液在上层,应从分液漏斗上口倒出,A错误;容量瓶在使用前不需要干燥,B错误;检验某溶液是否含有SO时,应取少量该溶液,先加入稀盐酸酸化,然后向溶液中滴加BaCl2溶液,若有白色沉淀生成,说明原溶液中含有SO,D错误。 6.下列说法正确的是( ) A.给试管中的固体加热,应先预热,后局部加热 B.量筒、容量瓶、锥形瓶都是不能加热的玻璃仪器 C.灼烧固体时,坩埚放在铁圈或三脚架上直接加热 D.在蒸馏过程中,若发现忘加沸石,应立即补加 答案:A 7.下列是一些装置气密性检查的方法,其中正确的是( ) 答案:B 8.下列有关仪器的使用方法或实验操作正确的是( ) A.用pH试纸测定氯化钠溶液等无腐蚀性的试剂的pH时,试纸可以用手拿 B.用容量瓶配制溶液时,必须先用蒸馏水洗净容量瓶,但可以不进行干燥 C.用分液漏斗进行萃取操作时要不断振荡,同时适时打开上口的玻璃塞进行“放气” D.为使实验现象更加明显,酸碱中和滴定时加入5 mL甲基橙或酚酞 解析:选B pH试纸不能用手拿,应该放在干净的表面皿或玻璃片上,A错误;用分液漏斗进行萃取操作时要不断振荡,同时适时打开活塞进行“放气”,C错误;酸碱指示剂本身就是弱酸或弱碱,加入过多会使中和滴定结果产生较大误差,D错误。 9.下列叙述正确的是( ) A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏大 B.蒸馏时应将温度计的水银球放在蒸馏烧瓶的支管口处 C.盛放NaOH溶液时,可以使用带玻璃瓶塞的磨口瓶 D.用广泛pH试纸测得0.10 mol·L-1 NH4Cl溶液的pH为5.2 解析:选B pH试纸先用水润湿会使溶液变稀,对于酸性溶液来说,测得的pH比实际的pH偏大,对于碱性溶液来说,测得的pH比实际的pH偏小,对于中性溶液来说,其pH不变,A错误;蒸馏时,应将温度计的水银球放在蒸馏烧瓶的支管口处,B正确;玻璃中含有二氧化硅,氢氧化钠溶液与二氧化硅会反应,生成的硅酸钠将试剂瓶塞和瓶口黏在一起,不易打开,C项错误;pH试纸只能读出整数,所以用广泛pH试纸测得的pH不可能是5.2,D错误。 10.下列实验操作正确的是( ) A.滴定硫酸亚铁溶液 B.吸收氯化氢气体并防倒吸 C.收集NO:先用瓶集满CO2,再从a口通入NO D.证明碳的非金属性比硅强 解析:选D 不能用碱式滴定管盛放酸性高锰酸钾溶液,A错误;B装置将导管口插入水中,不能起到防倒吸的作用,B错误;NO的密度小于二氧化碳,应该从b口通入,C错误。 11.茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( ) A.将茶叶灼烧灰化,选用①、②和⑨ B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ C.过滤得到滤液,选用④、⑤和⑦ D.检验滤液中的Fe3+,选用③、⑧和⑩ 解析:选B A项,灼烧在坩埚内进行,另外能用到酒精灯和泥三角,正确;B项,溶解、稀释用到烧杯和玻璃棒,错误;C项,过滤使用漏斗、烧杯、玻璃棒,正确;D项,检验Fe3+应选用KSCN溶液,用胶头滴管取用试剂,在试管内进行反应,检验,正确。 12.仅用下表提供的玻璃仪器(非玻璃仪器任选)就能达到相应目的的是( ) 选项 实验目的 实验仪器 A 除去KCl中的少量二氧化锰 烧杯、玻璃棒、分液漏斗 B 用10 mol·L-1盐酸配制100 mL 0.5 mol·L-1盐酸 100 mL容量瓶、玻璃棒、烧杯、胶头滴管 C 用碳酸钠溶液制备碳酸钠晶体 蒸发皿、酒精灯、玻璃棒 D 分离乙醇汽油中的乙醇和汽油 分液漏斗、烧杯 解析:选C A项缺少漏斗,用不到分液漏斗;B项缺少量筒;D项,汽油和乙醇互溶,必须用蒸馏操作及相关仪器。 13.根据常见仪器的特点及使用注意事项回答下列问题: (1)现有如图所示A、B、C、D四种仪器,写出名称: A.____________,B.____________,C.____________,D.____________。 (2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管 ②分液漏斗 ③细口试剂瓶 ④广口试剂瓶 ⑤集气瓶 ⑥滴瓶 ⑦酸式滴定管 ⑧碱式滴定管,肯定用不到“磨砂”处理的有________(填编号)。 (3)以下是中学化学实验中常见的定量仪器: a.量筒 B.容量瓶 C.滴定管 D.托盘天平 ①其中标有仪器使用温度的是________(填编号)。 ②实验时用来精确量取液体的是________(填编号)。 ③使用前要检查仪器是否漏液的是________(填编号)。 答案:(1)圆底烧瓶 分液漏斗 锥形瓶 酸式滴定管 (2)①⑧ (3)①abc ②c ③bc 14.某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。 实验步骤: ①组装仪器,检查装置气密性; ②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化; ③将铜丝上提离开液面,停止加热。 (1)检查虚线框内装置气密性的方法是____________________________________。 (2)仪器A的名称是________,装置B的作用是_________________________,装置D中所盛药品是________。 (3)装置A中发生反应的化学方程式为___________________________________。 (4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________________。 (5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是_____________________________________________________, 用所得溶液做焰色反应实验时,观察到的火焰颜色为________;不可直接向装置A中加水的原因是____________________________________________________。 解析:实验装置中三颈烧瓶是Cu与浓硫酸的反应装置,导出的气体主要是SO2,装置B是为了防止装置C中品红溶液倒吸进入装置A产生危险,装置C中品红溶液可以检验SO2,装置D吸收尾气中的SO2,防止污染环境,考虑到使用的仪器是干燥管,所以必须选用碱性固体试剂,可以选用NaOH或碱石灰等碱性固体与SO2反应,达到吸收SO2的效果。 (1)检查装置气密性必须使装置只有一个气体出口,所以活塞E必须关闭,在装置C中加入适量的水,加热排出一部分气体后进行检验。 (2)仪器A的名称是三颈烧瓶或三口烧瓶,装置B的作用是防倒吸,装置D中所盛药品是碱石灰或NaOH等碱性固体试剂。 (3)装置A中发生浓硫酸与铜的反应,化学方程式为2H2SO4(浓)+CuCuSO4+SO2↑+2H2O。 (4)实验后,整个装置中充满了SO2气体,拆除装置前,应将SO2充分排出并且吸收,故应打开旋塞E,向装置中鼓入大量空气。 (5)实验后装置A中生成的白色固体是CuSO4,由于同时存在浓硫酸,所以该CuSO4并没有与水结合,所以呈现白色,CuSO4溶于水后,溶液会变为蓝色,做焰色反应时会产生铜元素特征的黄绿色火焰,浓硫酸稀释时应当是“酸入水” ,防止水加入浓硫酸中产生大量热,引起液体飞溅。 答案:(1)关闭旋塞E,装置C中加水至没过长导管口,给装置A微热,装置C中长导管口有气泡冒出,撤去热源后,装置C中长导管内有液柱形成,且高度保持不变 (2)三颈烧瓶(或三口烧瓶) 防倒吸 碱石灰(或NaOH固体等合理答案) (3)2H2SO4(浓)+CuCuSO4+SO2↑+2H2O (4)打开旋塞E,向装置中鼓入大量空气 (5)白色固体溶解,溶液变蓝色 黄绿色 水加入浓硫酸中放出大量热,易使液体飞溅查看更多