- 2021-07-05 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省哈尔滨市第三中学2020届高三下学期第一次模拟考试(5月)化学试题
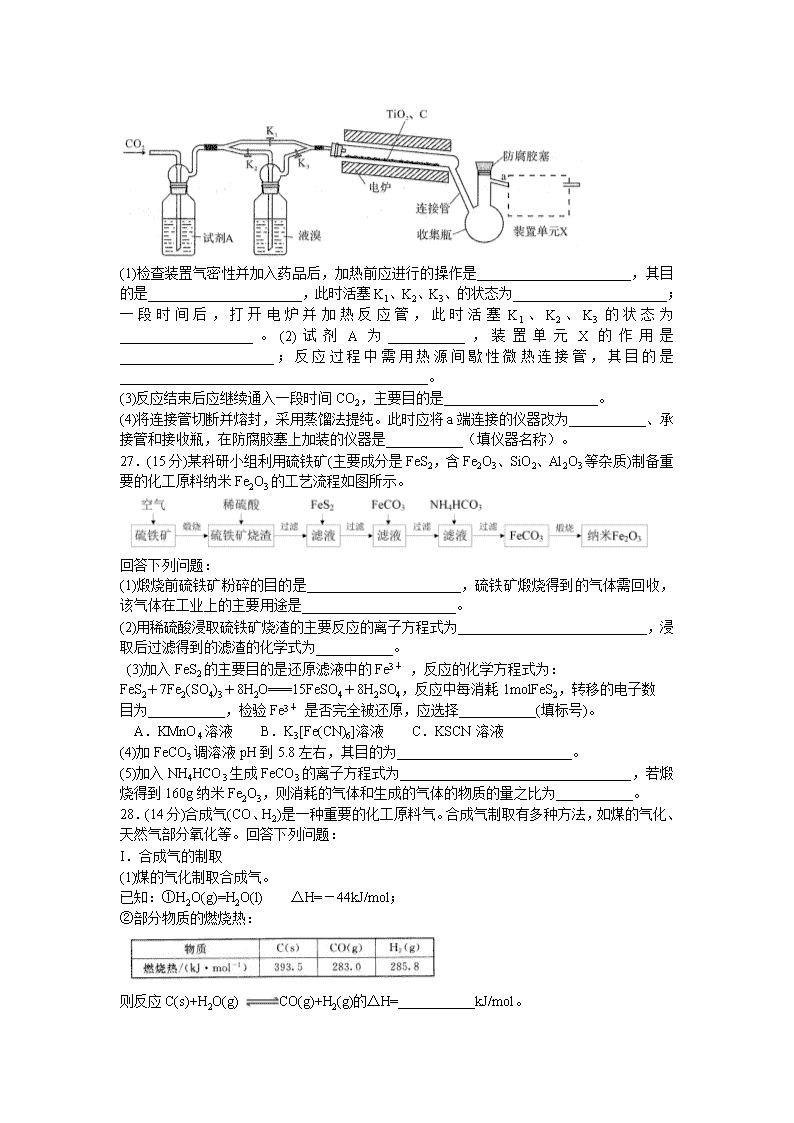
2020年哈三中高三学年第一次模拟考试 理科综合化学 试卷 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 Pd-106 一、选择题:本题共7个小题,每小题6分,共42分。在每小题给出的四个选项中, 只有一项是符合题目要求的。 7.“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。下列说法正确的是 A.古代中国出产的丝绸的主要成分是纤维素 B.中国从中亚进口的天然气的主要成分是乙烯 C.中国承建巴基斯坦的水电站实现了水能直接转化为电能 D.服务一带一路的北斗卫星上的太阳能电池板与地壳含量第二的元素有关 8.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下: 下列说法错误的是 A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1 B.若反应①通过原电池来实现,则ClO2是正极产物 C.反应②中的H2O2可用NaClO4代替 D.反应②条件下,ClO2的氧化性大于H2O2 9.下列实验中,所采取的分离方法与对应原理都正确的是 10.二羟基甲戊酸的结构简式为 ,下列有关二羟基甲戊酸的说法正确的是 A.二羟基甲戊酸的分子式为C5H10O4 B.二羟基甲戊酸不能使酸性KMnO4溶液褪色 C.等量的二羟基甲戊酸消耗Na和NaHCO3的物质的量之比为3∶1 D.二羟基甲戊酸与乳酸()互为同系物 11.X、Y、Z、W为原子序数依次增大的短周期元素,其中W原子的质子数是其M层电子数的三倍,Z与W、X与Y相邻,X与W同主族。下列说法不正确的是A.原子半径:W>Z>Y>X B.最高价氧化物对应水化物的酸性:X>W>Z C.最简单气态氢化物的热稳定性:Y>X>W>Z D.元素X、Z、W的最高化合价分别与其主族序数相等 12.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图 所示。H+、O2、NO3- 等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是 A.反应①②③④均在正极发生 B.单位时间内,三氯乙烯脱去amolCl时ne=amol C.④的电极反应式为 D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大 13.25℃时,HCN溶液中CN-和HCN浓度所占分数(α)随pH变化的关系如图所示,下列表述正确的是 A.Ka(HCN)的数量级为10-9 B.0.1mol/LHCN溶液使甲基橙试液显红色 C.1L物质的量都是0.1mol的HCN和NaCN混合溶液中c(HCN)>c(CN-) D.0.1mol/LNaCN溶液的pH=9.2 26.(14分)四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,易潮解易水解。实验室利用反应制备TiBr4 的装置如下图所示。回答下列问题: (1)检查装置气密性并加入药品后,加热前应进行的操作是______________________,其目的是______________________,此时活塞K1、K2、K3、的状态为______________________;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为___________________。(2)试剂A为___________,装置单元X的作用是______________________;反应过程中需用热源间歇性微热连接管,其目的是____________________________________________。 (3)反应结束后应继续通入一段时间CO2,主要目的是______________________。 (4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端连接的仪器改为___________、承接管和接收瓶,在防腐胶塞上加装的仪器是___________(填仪器名称)。 27.(15分)某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。 回答下列问题: (1)煅烧前硫铁矿粉碎的目的是______________________,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是______________________。 (2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为___________________________,浸取后过滤得到的滤渣的化学式为___________。 (3)加入FeS2的主要目的是还原滤液中的Fe3+ ,反应的化学方程式为: FeS2+7Fe2(SO4)3+8H2O===15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数 目为___________,检验Fe3+ 是否完全被还原,应选择___________(填标号)。 A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液 (4)加FeCO3调溶液pH到5.8左右,其目的为_________________________。 (5)加入NH4HCO3生成FeCO3的离子方程式为_________________________________,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为___________。 28.(14分)合成气(CO、H2)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列问题: I.合成气的制取 (1)煤的气化制取合成气。 已知:①H2O(g)=H2O(l) △H=-44kJ/mol; ②部分物质的燃烧热: 则反应C(s)+H2O(g) CO(g)+H2(g)的△H=___________kJ/mol。 (2)天然气部分氧化制取合成气。 如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中CO和H2的物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为___________。 Ⅱ.利用合成气合成乙醇 在一定条件下,向容积为2L的恒容密闭容器中投入2molCO和4molH2,发生反应:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)。 (1)写出该反应的平衡常数表达式_______________________。 (2)下列情况能作为判断反应体系达到平衡的标志是___________(填序号)。 A.压强不再变化 B.平均摩尔质量不再变化 C.密度不再变化 (3)反应起始压强记为p1、平衡后记为p2,平衡时H2的转化率为___________。(用含p1、p2的代数式表示) Ⅲ.合成乙醇的条件选择 为探究合成气制取乙醇的适宜条件,某科研团队对不同温度、不同Rh质量分数的催化剂对CO的吸附强度进行了研究,实验数据如图。CO的非离解吸附是指CO尚未乙醇化,离解吸附是指CO已经乙醇化。 (1)结合图像从低温区、高温区分析温度对CO吸附强度的影响______________________;以及催化剂对CO吸附强度的影响______________________。 (2)用Rh作催化剂,合成气制取乙醇的适宜温度是___________。 35.[化学——选修3:物质结构与性质](15分) 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。 (1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是___________,基态镍原子的价电子的电子排布图为___________。 (2)C、N、O的第一电离能由大到小的顺序为___________。 (3)SO2分子的VSEPR构型为___________;SO3分子中心原子的杂化形式为___________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为___________,分子中的σ键和π键数目之比是___________。 (4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键 ___________(填“是”或“不是”)大π键;一氧化氮可与Fe2+ 生成棕色离子,为检验亚铁离子的反应之一,离子中配位体是___________。 (5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5, Fe(CO)5分子中铁元素的化合价为___________,属于___________晶体。 (6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为___________g/cm3 (列出计算式)。 36.[化学——选修5:有机化学基础](15分) 我国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的一种化学合成方法的部分工艺流程如图所示: 己知:①C6H5-表示苯基; ② (1)化合物E中含有的含氧官能团有_____________、________________和羰基(写名称)。(2)合成路线中设计E→F、G→H的目的是____________。 (3)B→C实际上是分两步反应进行的,先进行加成反应,再进行___________反应。 (4)A在Sn-p沸石作用下,可生成同分异构体异蒲勒醇,己知异蒲勒醇分子中有3个手性碳原子(连有四个不同基团的碳原子称为手性碳原子),异蒲勒醇分子内脱水后再与H21:1发生1,4-加成可生成 则异蒲勒醇的结构简式为:_________。 (5)A的同分异构体Y含有醛基和六元碳环,且环上只有一个支链,满足上述条件的Y有______种,其中核磁共振氢谱峰数最少的物质的结构简式为_________。 (6)下图是以乙烯为原料制备苄基乙醛 的合成路线流程图。 请填写下列空白(有机物写结构简式): 物质1为________;物质2为_________;试剂X为___________;条件3为_____________。 答案查看更多