2020年高考化学二轮复习第二部分考前仿真模拟六习题含解析
考前仿真模拟(六)
时间:50分钟 满分:100分
可能用到的相对原子质量 C:12 O:16 Ni:59
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括7个小题,每小题6分,共42分。每小题仅有一个选项符合题意)
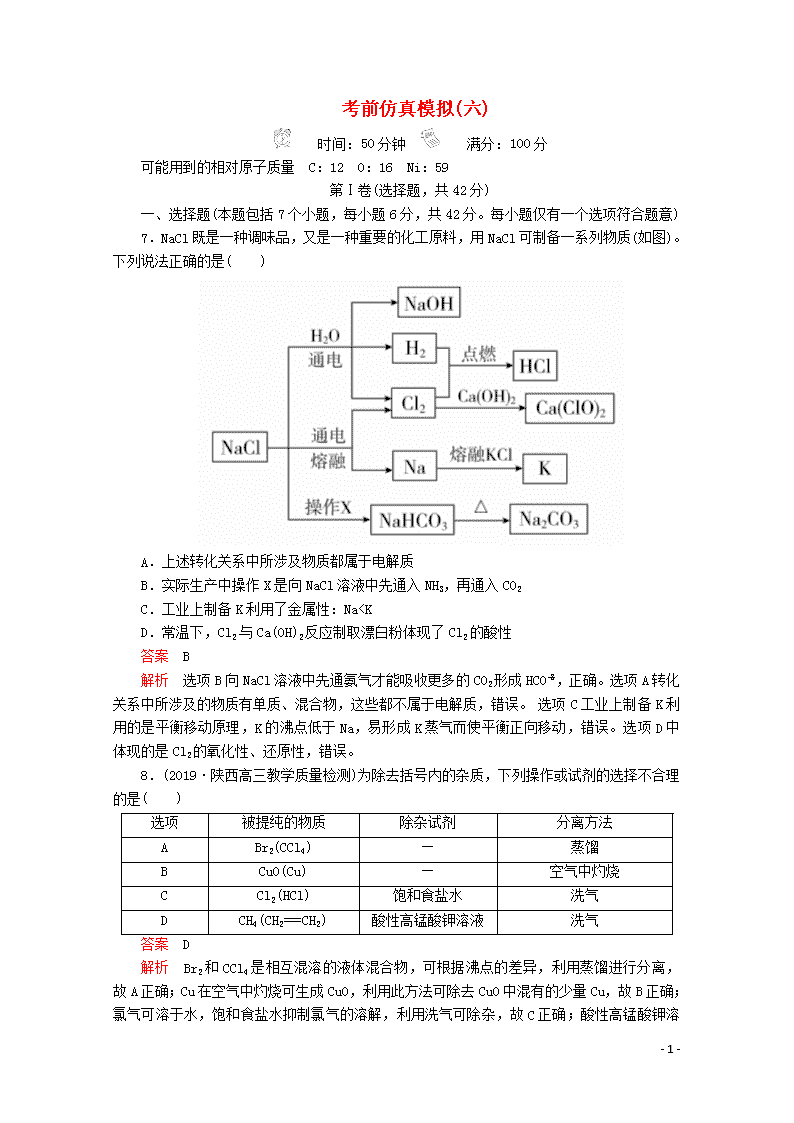
7.NaCl既是一种调味品,又是一种重要的化工原料,用NaCl可制备一系列物质(如图)。下列说法正确的是( )
A.上述转化关系中所涉及物质都属于电解质
B.实际生产中操作X是向NaCl溶液中先通入NH3,再通入CO2
C.工业上制备K利用了金属性:Na
H2S>AsH3,B错误;常温下,Mg与H2O的反应非常缓慢,C错误;丁的最高价氧化物是SiO2,是制造光导纤维的主要材料,D正确。
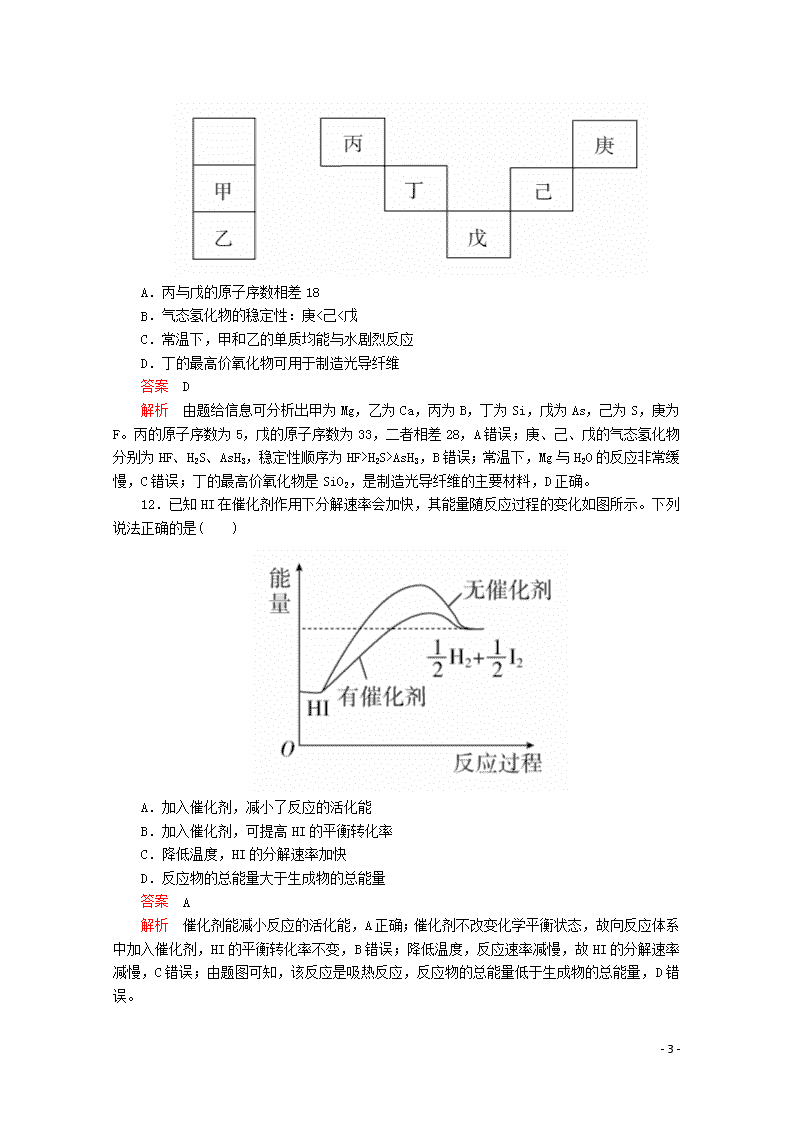
12.已知HI在催化剂作用下分解速率会加快,其能量随反应过程的变化如图所示。下列说法正确的是( )
A.加入催化剂,减小了反应的活化能
B.加入催化剂,可提高HI的平衡转化率
C.降低温度,HI的分解速率加快
D.反应物的总能量大于生成物的总能量
答案 A
解析 催化剂能减小反应的活化能,A正确;催化剂不改变化学平衡状态,故向反应体系中加入催化剂,HI的平衡转化率不变,B错误;降低温度,反应速率减慢,故HI的分解速率减慢,C错误;由题图可知,该反应是吸热反应,反应物的总能量低于生成物的总能量,D错误。
- 13 -
13.我国对“可呼吸”的钠-二氧化碳电池的研究取得突破性进展。该电池的总反应式为4Na+3CO22Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体储存于碳纳米管中)。下列说法不正确的是( )
A.放电时,钠金属片作负极,碳纳米管作正极
B.充电时,阳极反应为2Na2CO3+C-4e-===3CO2↑+4Na+
C.放电时,Na+从负极区向正极区移动
D.该电池的电解质溶液也可使用NaClO4的水溶液
答案 D
解析 由放电发生的反应可知放电时钠失去电子发生氧化反应,生成Na2CO3,所以钠金属片作负极、碳纳米管作正极,A正确;充电时,阳极发生的是C失去电子生成CO2的氧化反应:2Na2CO3+C-4e-===3CO2↑+4Na+,B正确;放电时,阳离子(Na+)流向正极,C正确;若使用NaClO4的水溶液,则钠能与溶液中的水反应,D错误。
第Ⅱ卷(非选择题,共58分)
二、必考题(本题包括3个小题,共43分)
26.(14分)二氧化氯是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11 ℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。
请回答下列问题:
(1)ClO2的制备(已知:SO2+2NaClO3+H2SO4===2ClO2+2NaHSO4)
- 13 -
①装置A中反应的化学方程式为____________________________。
②欲收集一定量的ClO2,选择图中的装置,其连接顺序为a→_________。(按气流方向,用小写字母表示)
③装置D的作用为______________________________。
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,装置Ⅰ中得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。
操作步骤
实验现象
结论
取少量Ⅰ中溶液于试管甲中,滴加品红溶液和盐酸
品红溶液
不褪色
①无_____
生成
另取少量Ⅰ中溶液于试管乙中,加入Ba(OH)2溶液,振荡
②______
______
有SO
生成
若在试管乙中继续滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,③_______________
有白色沉
淀生成
有Cl-
生成
④ClO2与Na2S反应的离子方程式为__________________。相对于用Cl2处理含硫废水,ClO2的优点是________________(至少写两条)。
答案 (1)①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
②g→h→b→c→e→f→d(或h→g→b→c→e→f→d)
③冷凝收集二氧化氯
(2)①SO2(写H2SO3、SO或HSO也可)
②生成白色沉淀(或白色浑浊)(没有“白色”不给分)
③加入足量硝酸酸化后,再滴加硝酸银溶液(或滴入足量硝酸酸化的硝酸银溶液)
④8ClO2+5S2-+4H2O===8Cl-+5SO+8H+
ClO2除硫效果彻底、等物质的量的ClO2的除硫能力是氯气的2.5倍(或ClO2在反应中被还原为Cl-,剩余的ClO2在水中的溶解度很大,不会产生二次污染)
解析 (1)①装置A中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水,化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2
- 13 -
O。②装置A中产生二氧化硫,二氧化硫进入装置B中发生已知反应,为防止倒吸,在反应装置前应装有安全瓶(装置E),二氧化氯沸点较低,故在装置D中利用冰水浴收集,最后用氢氧化钠溶液吸收未反应完的二氧化硫,防止污染空气。③装置D用冰水浴冷凝收集二氧化氯。
(2)将适量的稀释后的ClO2通入题图所示装置中充分反应,得到无色澄清溶液;①滴加品红溶液和盐酸,品红溶液不褪色,说明溶液中无SO2(HSO、SO或H2SO3)生成;②结论为有SO生成,则现象为有白色沉淀生成;③结论为有Cl-生成,现象为有白色沉淀生成,因为氯化银为不溶于硝酸的白色沉淀,故检验氯离子的操作为继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,加入足量稀硝酸酸化的硝酸银溶液;④由上述分析可知,ClO2与Na2S反应有Cl-、SO生成。
27.(14分)高铁酸钾(K2FeO4)是新型多功能水处理剂。其生产工艺如图1所示:
回答下列问题:
(1)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,写出温度较高时反应的离子方程式:_______。
(2)在溶液Ⅰ中加入NaOH固体的目的是________(填字母)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使NaClO3转化为NaClO
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图2为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图3为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO质量浓度对K2FeO4的生成率的影响。
- 13 -
工业生产中最佳温度为________,Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比为________。
(4)反应③的离子方程式为______________;
往溶液Ⅱ中加入饱和KOH溶液得到湿产品的原因是______________。
(5)高铁酸钾作为水处理剂是能与水反应的,其离子反应是:4FeO+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-
则其作为水处理剂的原理是:①______________;②__________。
答案 (1)6OH-+3Cl2===ClO+5Cl-+3H2O
(2)AC
(3)26 ℃ 6∶5(或1.2∶1)
(4)2Fe3++3ClO-+10OH-===2FeO+3Cl-+5H2O 高铁酸钾的溶解度比高铁酸钠的小
(5)①高铁酸钾中的铁为+6价,具有强氧化性,能杀菌消毒
②还原产物Fe3+水解产生的氢氧化铁胶体具有吸附作用
解析 (1)温度较高时,NaOH与Cl2发生歧化反应,生成NaClO3、NaCl,根据得失电子守恒、电荷守恒、原子守恒配平离子方程式:3Cl2+6OH-===5Cl-+ClO+3H2O。
(2)NaOH和Cl2反应生成NaClO,可除去溶液Ⅰ中未反应的Cl2,且只有在碱性条件下,Fe3+才能和ClO-发生氧化还原反应生成FeO。
(3)根据图2和图3知,工业生产中最佳温度为26 ℃,Fe(NO3)3、NaClO的最佳质量浓度分别为330 g·L-1、275 g·L-1,故Fe(NO3)3、NaClO两种溶液的最佳质量浓度之比为330∶275=6∶5。
(4)反应③为Fe3+在碱性条件下被ClO-氧化为FeO,ClO-被Fe3+还原为Cl-
- 13 -
,配平离子方程式为:2Fe3++3ClO-+10OH-===2FeO+3Cl-+5H2O。溶液Ⅱ中含有Na2FeO4,往溶液Ⅱ中加入饱和KOH溶液,得到K2FeO4,发生反应:Na2FeO4+2KOH===K2FeO4↓+2NaOH,故得到湿产品的原因是高铁酸钾的溶解度比高铁酸钠的溶解度小。
(5)高铁酸钾能作为水处理剂,是因为K2FeO4中铁元素为+6价,具有强氧化性,能起到杀菌消毒的作用,其对应还原产物为Fe3+,Fe3+水解生成的氢氧化铁胶体具有吸附性,可除去水中的悬浮物质,从而起到净化水的作用。
28.(15分)磷及其化合物在科研及生产中均有着重要的应用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下:
2P(s)+3Cl2(g)2PCl3(g)ΔH=-612 kJ·mol-1
2P(s)+5Cl2(g)2PCl5(g)ΔH=-798 kJ·mol-1
则气态PCl5生成气态PCl3和Cl2的热化学方程式为___________________。
(2)可逆反应PCl3(g)+Cl2(g)PCl5(g)、2E(g)F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
①达到平衡Ⅰ时,右侧反应室中体系压强与反应开始时体系压强之比为________。
②平衡Ⅰ到平衡Ⅱ的条件a是________(填“升温”或“降温”)。
(3)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚磷酸,装置如图所示。
- 13 -
阴极的电极反应式为________________________________;产品室中反应的离子方程式为__________________________________。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成____________沉淀(填化学式);当测得溶液中的一种金属阳离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c=__________mol·L-1。
答案 (1)PCl5(g)PCl3(g)+Cl2(g)ΔH=+93 kJ·mol-1
(2)①20∶23 ②降温
(3)2H2O+2e-===2OH-+H2↑ HPO+2H+===H3PO3
(4)Mg3(PO4)2 10-4
解析 (1)将题给热化学方程式依次编号为①、②,根据盖斯定律,由(①-②)×得:PCl5(g)PCl3(g)+Cl2(g)
ΔH==+93 kJ·mol-1。
(2)②从平衡Ⅰ到平衡Ⅱ,隔板向左移动,说明左边气体的物质的量减少,则PCl3(g)+Cl2(g)PCl5(g)向右移动,根据(1)知,该反应的正反应是放热反应,故条件a是降温。
(3)分析题图知,阴极的电极反应式为2H2O+2e-===2OH-+H2↑。阳极室中的H+进入产品室,与原料室中进入产品室的HPO结合形成H3PO3:2H++HPO===H3PO3。
(4)由溶度积知,Mg3(PO4)2的溶解度较小,故先生成Mg3(PO4)2。当c(Mg2+)=10-5 mol·L-1时,c2(PO)==6.0×10-14 mol2·L-2,此时溶液中c(Ca2+)== mol·L-1=10-4 mol·L-1。
三、选考题(两个题中任选一题作答,共15分)
35.[化学——选修3:物质结构与性质](15分)
镍(28Ni)及其化合物在工业生产领域有广泛的应用。
- 13 -
(1)Ni在元素周期表中的位置是________________;前四周期元素中,基态原子核外电子排布中单电子数最多的元素的价层电子排布式为________。
(2)Ni(CO)4中镍的化合价为________,写出与CO互为等电子体的非极性分子的化学式________,其分子中σ键和π键的个数比为________。
(3)Co能形成配离子Co(H2O)、Co(NH3)等。
①第一电离能:N________(填“>”或“<”)O。
②H2O的VSEPR模型为________。
(4) 如图所示为NaCl的晶胞结构,NiO(氧化镍)的晶胞结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8 cm,阿伏加德罗常数的值为NA,NiO晶体的密度是____________。(已知NiO的摩尔质量为74.7 g·mol-1)
(5)天然的晶体和绝大部分人工制备的晶体都存在各种缺陷。例如,在某种氧化镍晶体中就存在如图所示的缺陷,一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其晶体仍呈电中性,但化合物中Ni和O的个数比却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的个数之比为________。
答案 (1)第四周期第Ⅷ族 3d54s1
(2)0 N2 1∶2
(3)①> ②四面体形
(4) g·cm-3或( g·cm-3)
(5)6∶91
解析 (1)前四周期元素中,基态原子核外电子排布中单电子数最多的元素为Cr,其价层电子排布式为3d54s1。
(2)CO为分子,所以Ni(CO)4
- 13 -
中镍的化合价为0;CO中含有2个原子、14个电子,所以与CO互为等电子体的非极性分子为N2。
(3)①同周期主族元素随原子序数的增大,第一电离能呈增大趋势,但氮原子的2p能级为半充满状态,其第一电离能大于O。
(4)NiO的晶胞结构与NaCl的晶胞结构相同,可将NiO晶胞分割成八个等同的小立方体,以一个小立方体为例,小立方体的边长等于Ni2+与最邻近O2-的核间距离,为a×10-8 cm,在这个小立方体中含0.5个Ni2+,0.5个O2-,则(a×10-8)3 cm3×ρ= mol×74.7 g·mol-1,ρ= g·cm-3。
(5)设1 mol Ni0.97O中含Ni3+的物质的量为x mol,则含Ni2+的物质的量为(0.97-x) mol,根据晶体呈电中性,则有3x+2×(0.97-x)=2×1,解得x=0.06,Ni2+的物质的量为(0.97-x) mol=0.91 mol。Ni3+、Ni2+个数之比N(Ni3+)∶N(Ni2+)=n(Ni3+)∶n(Ni2+)=0.06∶0.91=6∶91。
36.(2019·广东清远高三期末)[化学——选修5:有机化学基础](15分)
某种药物在临床上有许多的应用,具有去热、镇痛等疗效,以下是该药物的合成路线。
已知:CH2===CH—CH===CH2+CH2===CH2
(1)化合物C的分子式为________,B中含氧官能团的名称为________。
(2)F→G的反应类型为________。
(3)写出D→F的化学方程式______________________________。
(4)F的同分异构体有多种,符合以下条件的同分异构体有________种,写出其中一种同分异构体的结构简式____________________________。
①属于芳香族化合物,苯环上只有两个支链,苯环上的一氯代物只有两种。
②能与FeCl3溶液发生显色反应。
③能与碳酸氢钠反应产生气体。
(5)写出由2溴丁烷、丙烯酸和乙醇为原料合成
- 13 -
的合成路线(其他试剂任选)。
答案 (1)C5H4O2 羟基、醛基
(2)加成反应
(3)
(4)2
(5)
解析 (3)与发生加成反应生成
- 13 -
。
(4)F的分子式为C9H10O3,其同分异构体中,符合①属于芳香族化合物,苯环上只有两个支链,苯环上的一氯代物只有两种,说明苯环上有两个处于对位的取代基;②能与FeCl3溶液发生显色反应,说明其中一个取代基为酚羟基;③能与碳酸氢钠反应产生气体,说明分子中含有羧基,则可能结构有、。
- 13 -