2020届高三模拟考试试卷南京化学(一)
2020届高三模拟考试试卷(一)
化 学
2020.1
本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Fe—56 Ba—137
第Ⅰ卷(选择题 共40分)
单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. 我国太阳能开发利用位于世界前列。下列采用“光—热—电”能量转换形式的是( )
2. 2019年8月《Green Chemistry》报道了我国学者发明的低压高效电催化还原CO2的新方法,其总反应为NaCl+CO2CO+NaClO。下列有关化学用语表示错误的是( )
A. 中子数为12的钠原子:Na B. Cl-的结构示意图:
C. CO2的结构式:O==C==O D. NaClO的电子式:NaC
3. 下列有关物质的性质与用途具有对应关系的是( )
A. Mg(OH)2具有碱性,可用于制胃酸中和剂 B. H2O2是无色液体,可用作消毒剂
C. FeCl3具有氧化性,可用作净水剂 D. 液NH3具有碱性,可用作制冷剂
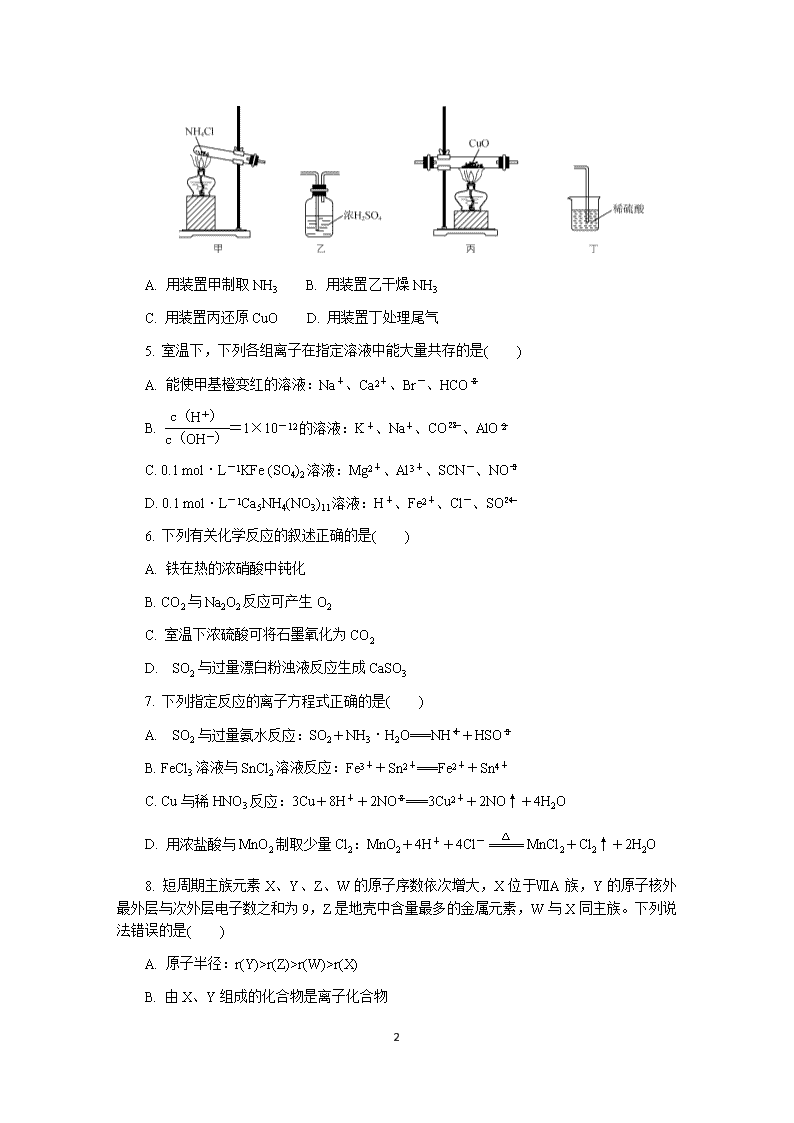
4. 用下列装置制取NH3,并还原CuO,其原理和装置均正确的是( )
14
A. 用装置甲制取NH3 B. 用装置乙干燥NH3
C. 用装置丙还原CuO D. 用装置丁处理尾气
5. 室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 能使甲基橙变红的溶液:Na+、Ca2+、Br-、HCO
B. =1×10-12的溶液:K+、Na+、CO、AlO
C. 0.1 mol·L-1KFe (SO4)2溶液:Mg2+、Al3+、SCN-、NO
D. 0.1 mol·L-1Ca5NH4(NO3)11溶液:H+、Fe2+、Cl-、SO
6. 下列有关化学反应的叙述正确的是( )
A. 铁在热的浓硝酸中钝化
B. CO2与Na2O2反应可产生O2
C. 室温下浓硫酸可将石墨氧化为CO2
D. SO2与过量漂白粉浊液反应生成CaSO3
7. 下列指定反应的离子方程式正确的是( )
A. SO2与过量氨水反应:SO2+NH3·H2O===NH+HSO
B. FeCl3溶液与SnCl2溶液反应:Fe3++Sn2+===Fe2++Sn4+
C. Cu与稀HNO3反应:3Cu+8H++2NO===3Cu2++2NO↑+4H2O
D. 用浓盐酸与MnO2制取少量Cl2:MnO2+4H++4Cl-MnCl2+Cl2↑+2H2O
8. 短周期主族元素X、Y、Z、W的原子序数依次增大,X位于ⅦA族,Y的原子核外最外层与次外层电子数之和为9,Z是地壳中含量最多的金属元素,W与X同主族。下列说法错误的是( )
A. 原子半径:r(Y)>r(Z)>r(W)>r(X)
B. 由X、Y组成的化合物是离子化合物
14
C. X的简单气态氢化物的热稳定性比W的强
D. Y的最高价氧化物对应水化物的碱性比Z的弱
9. 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. Al2O3(熔融)Al(s)AlCl3(s)
B. FeS2(s)SO2(g)H2SO4(aq)
C. NH3(g)NO(g)NaNO3(aq)
D. SiO2(s)H4SiO4(s)Na2SiO3(aq)
10. 2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如右图所示(已知:H2O2H++HO,Ka=2.4×10-12)。下列说法错误的是( )
A. X膜为选择性阳离子交换膜
B. 催化剂可促进反应中电子的转移
C. 每生成1 mol H2O2电极上流过4 mol e-
D. b极上的电极反应为O2+H2O+2e-===HO +OH-
不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. 下列说法正确的是( )
A. 碳素钢在海水中发生的腐蚀主要是析氢腐蚀
B. 反应Si(s)+2Cl2 (g)===SiCl4(l)在室温下能自发进行,则该反应的ΔH>0,ΔS>0
C. 室温时,CaCO3在0.1 mol·L-1 NH4Cl溶液中的溶解度比在纯水中的大
D. 2 mol SO2和1 mol O2在密闭容器中混合充分反应,转移电子的数目为4×6.02×1023
14
12. 铁杉脂素是重要的木脂素类化合物,其结构简式如右图所示。下列有关铁杉脂素的说法错误的是( )
A. 分子中两个苯环处于同一平面
B. 分子中有3个手性碳原子
C. 能与浓溴水发生取代反应
D. 1 mol铁杉脂素与NaOH溶液反应最多消耗3 mol NaOH
13. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向苯酚浊液中滴入Na2S溶液,浊液变清
C6H5O-结合H+的能力比S2-的弱
B
将X溶液滴在KI淀粉试纸上,试纸变蓝色
X溶液中一定含有I2
C
向FeCl2和KSCN的混合溶液中滴入酸化的AgNO3溶液,溶液变红
Ag+的氧化性一定比Fe3+的强
D
向2支均盛有2 mL相同浓度Na3[Ag(S2O3)2]溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀
Ksp(AgI)
c(NH3·H2O)>c(H+)>c(OH-)
B. 0.1 mol·L-1H3PO3溶液用NaOH溶液滴定至pH=6.60:c(H2PO)=c(HPO)
C. 0.1 mol·L-1H3PO3溶液用氨水滴定至pH=7.0:c(NH)=c(H2PO)+c(HPO)
D. 0.4 mol·L-1氨水与0.2 mol·L-1NaH2PO3等体积混合(体积变化可忽略):
c(NH3·H2O) v(逆)
第Ⅱ卷(非选择题 共80分)
16. (12分)利用铝热炼镁还原渣[Al、Ca (AlO2)2、Al2O3、MgO及少量不能被碱液溶出的尖晶石型铝的化合物等]制取Al(OH)3的工艺流程如下:
(1) “滤渣”成分包括:水合铝酸钙、尖晶石型铝的化合物、不含铝的化合物________(写两种物质的化学式)。
(2) “溶出”时,在适当条件下,铝及其大部分含铝化合物以NaAlO2溶出。
① 金属Al与NaOH溶液反应的化学方程式为________。
14
② 其他条件相同时,Na2CO3、NaOH溶液的浓度对铝的溶出率的影响如右图所示:
NaOH溶液浓度一定时,130 g·L-1的Na2CO3溶液对铝的溶出率比100 g·L-1的大,这是因为______________(从平衡移动角度分析);Na2CO3溶液浓度一定时,当NaOH溶液浓度大于80 g·L-1,铝的溶出率随NaOH溶液浓度增大而减小,可能原因是________。
(3) “碳分”时,溶液与过量CO2反应的离子方程式为______________________________。
(4) “过滤2”的母液经再生处理可返回“溶出”工序循环使用,再生的方法是______________________________________。
17. (15分)五味子丙索具有良好的抗肝炎病毒活性,其中间体H的一种合成路线如下:
(1) A中含氧官能团的名称为________和________。
(2) B→C的反应类型为________。
(3) F的分子式为C10H11NO5,E→F发生还原反应,写出F的结构简式:________。
(4) D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________________。
① 能发生银镜反应、水解反应且能与FeCl3溶液发生显色反应;
② 分子中有4种不同化学环境的氢。
(5) 已知:① Ar—NHSOAr—OH,Ar—为芳烃基;
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
14
18. (12分)黄铁矾法是硫酸体系中除铁的常用方法,黄铵铁矾是黄铁矾中的一种[化学式可表示为(NH4)xFey(SO4)z(OH)w,摩尔质量为480 g·mol-1]。
(1) 除去MnSO4酸性溶液中的Fe2+可向溶液中加入MnO2,充分搅拌,然后用氨水调节溶液的pH为1~3,升温到95 ℃,静置即可形成黄铵铁矾沉淀。 MnO2氧化Fe2+的离子方程式为____________________________________;静置形成黄铵铁矾过程中溶液的pH________(填“增大”“减小”或“不变”)。
(2) 依据下列实验和数据可确定黄铵铁矾的化学式。
Ⅰ. 称取黄铵铁矾2.400 g,加入足量NaOH溶液充分反应后过滤,向滤液中加入足量盐酸酸化的BaCl2溶液,得到沉淀2.330 g 。
Ⅱ. Mim Ristic等曾对黄铵铁矾进行热分解实验,其结果可用右图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3、H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。
根据以上实验及图中数据确定黄铵铁矾的化学式(写出计算过程)。
19. (15分)实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如下:
14
(1) “酸浸”时,用硫酸而不用盐酸,这是因为____________________(从浸取产物的溶解性考虑)。
(2) “制铜氨液”,即制取[Cu(NH3)4]SO4溶液时,采用8 mol·L-1氨水,适量30%H2O2,并通入O2,控制温度为55 ℃。温度不宜过高,这是因为________。
(3) “沉CuNH4SO3”时可用如下装置(夹持、加热仪器略):
① 制取SO2的化学方程式为______________________。
② “沉CuNH4SO3”时,反应液需控制在45 ℃,合适的加热方式是________。
③ 反应完成的实验现象是______________________________。
(4) 设计以“Cr(OH)3、Fe(OH)3”的混合物为原料,制取K2Cr2O7的实验方案:将Cr(OH)3、Fe(OH)3的混合物加入烧杯中,加适量的水调成浆状,________,冰水洗涤及干燥。
(已知:① 碱性条件下,H2O2可将+3价的Cr氧化为CrO;酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;+6价的Cr在溶液pH<5时,主要以Cr2O存在;在pH>7时,主要以CrO存在。② 部分物质溶解度曲线如右图所示。③ 实验中必须使用的试剂:KOH溶液、10%H2O2溶液、稀盐酸)
14
图1
20. (14分)沼气的主要成分是CH4,还含有CO2、H2S等。 Jo De Vrieze等设计了利用膜电解法脱除沼气中的CO2和H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图1所示。
(1) 需控制电解槽中阴极室pH>7,其目的是______________________________。
(2) 阳极室逸出CO2和________(填化学式);H2S在阳极上转化为SO而除去,其电极反应式为________。
(3) 在合成塔中主要发生的反应为:
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g);ΔH1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g);ΔH2
调节n(H2)/n(CO2)=4,充入合成塔,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图2所示;不同压强时,CO2的平衡转化率如图3所示:
① 反应CO2(g)+CH4(g)2CO(g)+2H2(g)的ΔH=__________(用ΔH1、ΔH2表示)。
② 图2中,200~550 ℃时,CO2的物质的量分数随温度升高而增大的原因是________。
③ 图3中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是____________________;在压强为10MPa时,当温度在200~800 ℃范围内,随温度升高,CO2的平衡转化率始终减小,其原因是____________________________。
21. (12分)【选做题】本题包括A、B两小题,请选定其中一小题作答。若多做,则按A小题评分。
A. [物质结构与性质]
CuSCN是一种生物防腐涂料,可用CuSO4、NaSCN、Na2SO3作原料,并用乙二醇或DMF作分散剂进行制备。
(1) Cu+基态核外电子排布式为____________________。
14
(2) NaSCN中元素S、C、N的第一电离能由大到小的顺序为________;Na2SO3中SO的空间构型为________(用文字描述)。
(3) 乙二醇(HOCH2CH2OH)与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为________________________。
(4) DMF()分子中碳原子的轨道杂化类型为________;1 mol DMF分子中含有σ键的数目为________。
B. [实验化学]
乙酸苄酯是一种有馥郁茉莉花香气的无色液体,沸点为213 ℃,密度为1.055 g·cm-3,实验室制备少量乙酸苄酯的反应如下:
实验步骤如下:
步骤1:三颈烧瓶中加入30 g(0.28 mol)苯甲醇、30 g乙酸酐(0.29 mol)和1 g无水CH3COONa,搅拌升温至110 ℃,回流4~6 h(装置如图)。
步骤2:反应物降温后,在搅拌下慢慢加入15%的Na2CO3溶液,直至无气泡放出为止。
步骤3:将有机相用15%的食盐水洗涤至中性。分出有机相,向有机相中加入少量无水CaCl2处理得粗产品。
步骤4:在粗产品中加入少量硼酸,减压蒸馏(1.87 kPa),收集98~100 ℃的馏分,即得产品。
(1) 步骤1中,加入无水CH3COONa的作用是________________,合适的加热方式是________。
(2) 步骤2中,Na2CO3溶液需慢慢加入,其原因是__________________________。
14
(3) 步骤3中,用15%的食盐水代替蒸馏水,除可减小乙酸苄酯的溶解度外,还因为__________;加入无水CaCl2的作用是________________________。
(4) 步骤4中,采用减压蒸馏的目的是__________________________。
14
2020届高三模拟考试试卷(一)(南京、盐城)
化学参考答案及评分标准
1. C 2. D 3. A 4. C 5. B 6. B 7. C 8. D 9. A 10. C 11. C 12. A 13. AD 14. BD 15. BC
16. (12分)
(1) CaCO3 、MgO[或Mg(OH)2](各1分,共2分)
(2) ① 2Al+2NaOH+2H2O===2NaAlO2+3H2↑(2分)
② Na2CO3浓度大,有利于溶出反应向生成CaCO3方向移动,促进铝的溶出 (2分)
AlO以水合铝酸钙形式重新进入固相[或过量浓NaOH与原料中含钙化合物作用生成Ca(OH)2,Ca(OH)2与NaAlO2作用生成水合铝酸钙](2分)
(3) AlO+CO2+2H2O===Al(OH)3↓+HCO(2分)
(4) 在不断搅拌下加入适量的生石灰[或熟石灰,答NaOH暂不扣分],然后过滤去渣(2分)
17. (15分)
(1) (酚)羟基 (1分) 羧基(1分)
(2) 取代反应(2分)
(3) (3分)
18. (12分)
14
(1) MnO2+4H++2Fe2+===Mn2++2Fe3++2H2O(2分) 减小(2分)
(2) 由z==2(2分)
y=×2=3(2分)
18 g·mol-1×x+56 g·mol-1×3+96 g·mol-1×2+17 g·mol-1×w=480 g·mol-1
由化合价代数和为0:x×(+1)+3×(+3)+2×(-2)+w×(-1)=0
解得x=1,w=6(2分)
[或=,减少的必为NH3和H2O,即每480 g黄铵铁矾受热分解,此阶段中释放1 mol NH3和0.5 mol H2O,推得x=1;由电荷守恒:x+3y=2z+w,w=6]
化学式为NH4Fe3(SO4)2(OH)6(2分)
19. (15分)
(1) 硫酸可将CaO转化为CaSO4渣而除去(2分)
(2) 温度过高会加速NH3的挥发、加速H2O2的分解、“铜氨液”会分解生成Cu(OH)2(答出一点即可)(2分)
(3) ① Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(2分)
② 45 ℃的水浴加热(2分)
③ 上层清液由深蓝色逐渐变为几乎无色(2分)
(4) 在不断搅拌下加入适量KOH溶液,再加入过量的10%H2O2溶液,维持pH大于7,充分反应后,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤(5分)
20. (14分)
(1) 将H2S转化为HS-(S2-),部分CO2转化为HCO(CO)(2分)
(2) O2(2分) H2S+4H2O-8e-===10H++SO(2分)
(3) ① 2ΔH2-ΔH1(2分)
② ΔH1<0,ΔH2>0,温度升高时,反应Ⅰ向左移动增加的CO2的量大于反应Ⅱ向右移动减少的CO2的量(2分)
③ 增大压强,反应Ⅱ不移动,反应Ⅰ向正反应方向移动(2分)
反应Ⅰ中CO2减小的平衡转化率始终大于反应Ⅱ中CO2增大的平衡转化率(或反应Ⅰ、Ⅱ中CO2平衡时的净转化率呈减小趋势)(2分)
14
21A. (12分)
(1) [Ar]3d10或1s22s22p63s23p63d10(2分)
(2) N、C、S(2分) 三角锥形(2分)
(3) HOCH2CH2OH与H2O之间可以形成氢键(2分)
(4) sp2和sp3(2分) 11 mol(2分)
21B. (12分)
(1) 催化剂(2分) 油浴(或沙浴)(2分)
(2) 以免大量CO2泡沫冲出(2分)
(3) 乙酸苄酯与水的密度几乎相同不容易分层(2分) 除去有机相中的水(2分)
(4) 防止常压蒸馏时,乙酸苄酯未达沸点前就已发生分解(2分)
14