- 2021-07-05 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年宁夏银川一中高二上学期期末考试化学试题 Word版
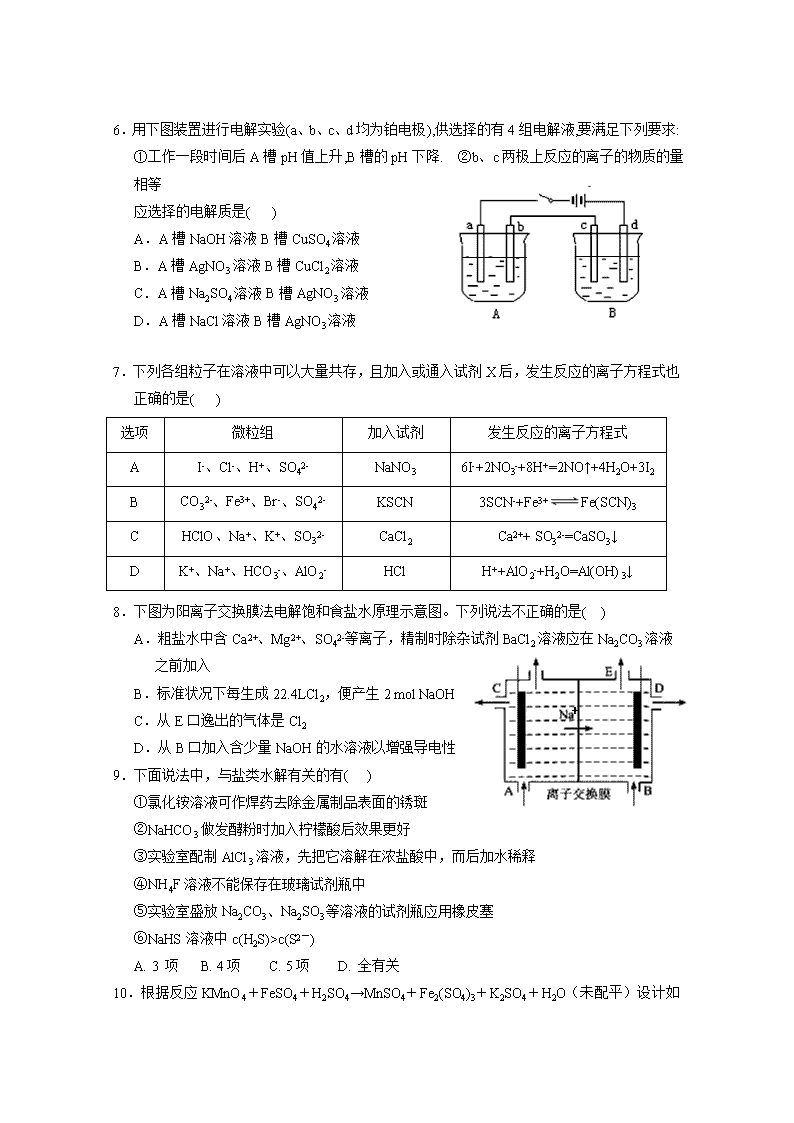
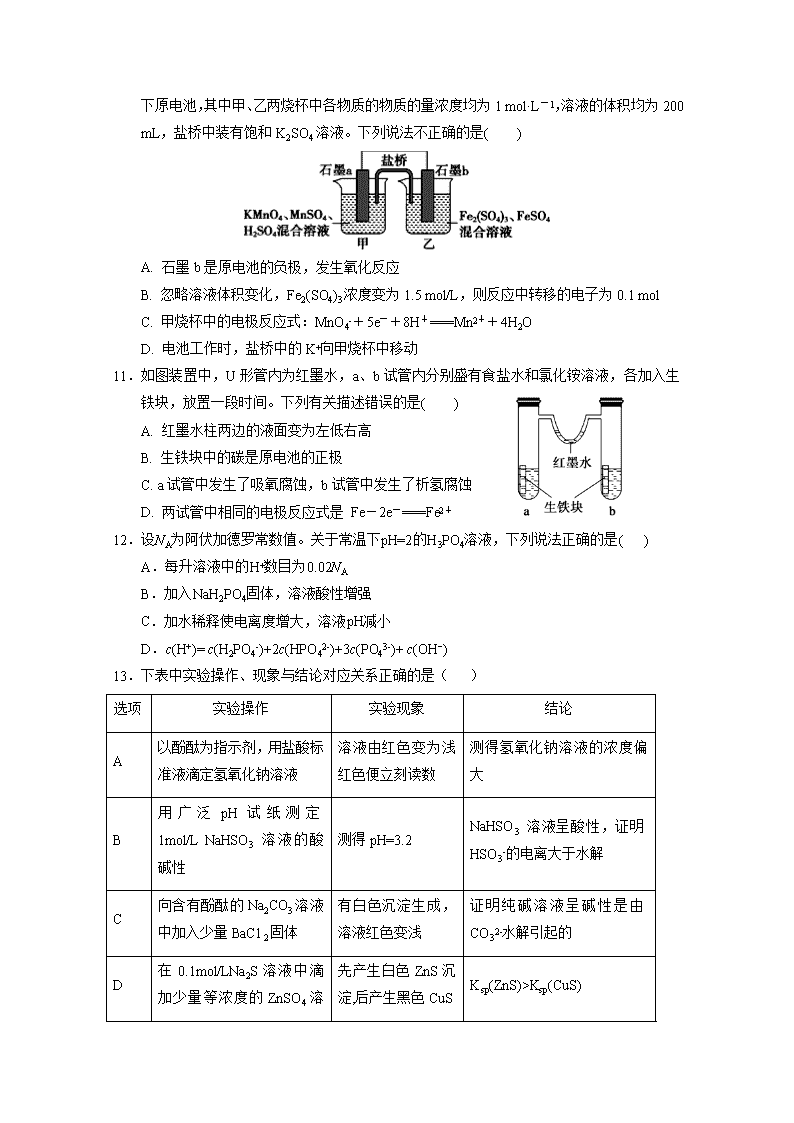
银川一中2019/2020学年度(上)高二期末考试 化 学 试 卷 可能用到的相对原子质量:H—1 O—16 C—12 N—14 Na—23 Cu—64 Ag—108:] 一、选择题:(每小题只有一个正确答案,每小题2分,共50分) 1.下列说法正确的是( ) A.强酸和强碱一定是强电解质,不论其水溶液浓度大小,都能完全电离 B.强电解质溶液的导电能力一定比弱电解质强 C.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强 D.强电解质不一定都是离子化合物 2.在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该溶质的固体物质的是( ) A. 亚硫酸钠 B. 硫酸铁 C. 氯化铝 D. 高锰酸钾 3.下列有关Fe3+的除杂,说法不正确的是( ) A.用加热的方法可除去KNO3溶液中混有的Fe3+ B.工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7—8, 可除去Fe3+ C.FeSO4溶液中的Fe2+极易被氧化为Fe3+,可加铁粉除去杂质Fe3+ D.MgCl2溶液中混有FeCl3杂质,可加Na2CO3除去FeCl3杂质 4.化学与生活生产密切相关,下列说法中不正确的是( ) A. 电化学腐蚀和化学腐蚀都是金属被氧化的过程,伴随有电流产生 B. 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 C. 用锡焊接的铁质器件,焊接处容易生锈 D. 电冶铝工业中用石墨作电极,用冰晶石作助熔剂 5.下列方程式书写正确的是( ) A.Na2S显碱性原因:S2-+2H2OH2S+2OH- B.泡沫灭火器的原理:Al3++3HCO3- Al(OH)3↓+3CO2↑ C.HCO3−的电离方程式:HCO3-+H2OH3O++CO32- D.NH4Cl溶于D2O中:NH4++D2ONH3·D2O+H+ 6.用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求: ①工作一段时间后A槽pH值上升,B槽的pH下降. ②b、c两极上反应的离子的物质的量相等 应选择的电解质是( ) A.A槽NaOH溶液B槽CuSO4溶液 B.A槽AgNO3溶液B槽CuCl2溶液 C.A槽Na2SO4溶液B槽AgNO3溶液 D.A槽NaCl溶液B槽AgNO3溶液 7.下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是( ) 选项 微粒组 加入试剂 发生反应的离子方程式 A I-、Cl-、H+、SO42- NaNO3 6I-+2NO3-+8H+=2NO↑+4H2O+3I2 B CO32-、Fe3+、Br-、SO42- KSCN 3SCN-+Fe3+Fe(SCN)3 C HClO、Na+、K+、SO32- CaCl2 Ca2++ SO32-=CaSO3↓ D K+、Na+、HCO3-、AlO2- HCl H++AlO2-+H2O=Al(OH)3↓ 8.下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( ) + A.粗盐水中含Ca2+、Mg2+、SO42-等离子,精制时除杂试剂BaCl2溶液应在Na2CO3溶液之前加入 B.标准状况下每生成22.4LCl2,便产生2 mol NaOH C.从E口逸出的气体是Cl2 D.从B口加入含少量NaOH的水溶液以增强导电性 9.下面说法中,与盐类水解有关的有( ) ①氯化铵溶液可作焊药去除金属制品表面的锈斑 ②NaHCO3做发酵粉时加入柠檬酸后效果更好 ③实验室配制AlCl3溶液,先把它溶解在浓盐酸中,而后加水稀释 ④NH4F溶液不能保存在玻璃试剂瓶中 ⑤实验室盛放Na2CO3、Na2SO3等溶液的试剂瓶应用橡皮塞 ⑥NaHS溶液中c(H2S)>c(S2-) A. 3 项 B. 4项 C. 5项 D. 全有关 10.根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O (未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( ) A. 石墨b是原电池的负极,发生氧化反应 B. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol C. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O D. 电池工作时,盐桥中的K+向甲烧杯中移动 11.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( ) A. 红墨水柱两边的液面变为左低右高 B. 生铁块中的碳是原电池的正极 C. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 D. 两试管中相同的电极反应式是 Fe-2e-===Fe2+ 12.设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( ) A.每升溶液中的H+数目为0.02NA B.加入NaH2PO4固体,溶液酸性增强 C.加水稀释使电离度增大,溶液pH减小 D.c(H+)= c(H2PO4-)+2c(HPO42-)+3c(PO43-)+ c(OH−) 13.下表中实验操作、现象与结论对应关系正确的是( ) 选项 实验操作 实验现象 结论 A 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 溶液由红色变为浅红色便立刻读数 测得氢氧化钠溶液的浓度偏大 B 用广泛pH试纸测定1mol/L NaHSO3 溶液的酸碱性 测得pH=3.2 NaHSO3 溶液呈酸性,证明HSO3-的电离大于水解 C 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 有白色沉淀生成,溶液红色变浅 证明纯碱溶液呈碱性是由CO32-水解引起的 D 在0.1mol/LNa2S溶液中滴加少量等浓度的ZnSO4 先产生白色ZnS沉淀,后产生黑色CuS Ksp(ZnS)>Ksp(CuS) 溶液,再加入少量等浓度的CuSO4溶液 沉淀 a b 14.关于下列装置的叙述中正确的是( ) A. 用此装置给铁镀铜,镀件应放在b电极 B. 用此装置给铁镀铜,反应一段时间后溶液中铜离子浓度基本不变 C. 用此装置电解精炼铜,反应一段时间后溶液中铜离子浓度基本不变 D. 用此装置电解精炼铜,粗铜应放在a电极 15.一定温度下,水存在H2OH++OH-的平衡,下列叙述一定正确的是( ) A. 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 B. 将水加热,Kw增大,pH减小 C. 向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低 D. 向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变 16.利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( ) A.若X为碳棒,开关K置于N处,为外加电源的阴极保护法, 可减缓铁的腐蚀 B.若X为碳棒,开关K置于N处,X极发生氧化反应 C. 若X为锌棒,开关K置于M处,为牺牲阳极的阴极保护法, 可减缓铁的腐蚀 D.若X为锌棒,开关K置于M处,铁极发生氧化反应 17.欲使NH4Cl稀溶液中c(NH4+)/c(Cl-)比值增大,可在溶液中(恒温并忽略溶液体积的变化)加入少量下列物质中的( ) ①通入HCl;②H2SO4;③NH4Cl固体;④NH4NO3固体 ⑤Ba(OH)2固体 A.②或③或④ B.①或②或④ C.②或③或⑤ D.①或③或⑤ 18.25℃时,Ksp[Mg(OH)2]=10-12,Ksp(MgF2)=10-10。下列说法正确的是( ) A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 B. 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 C. 25℃时,向浓度均为0.1mol•L-1的NaOH和NaF的混合溶液中逐滴滴加MgCl2溶液,先生成Mg(OH)2沉淀 D. 25℃时,Mg(OH)2固体在20mL 0.01 mol•L-1氨水中的Ksp比在20mL 0.01 mol•L-1 NH4Cl溶液中的Ksp小 19. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS) 是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( ) A.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)查看更多