- 2021-07-05 发布 |
- 37.5 KB |
- 55页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017届二轮复习无机化工流程专题练习课件(共55张)(全国通用)
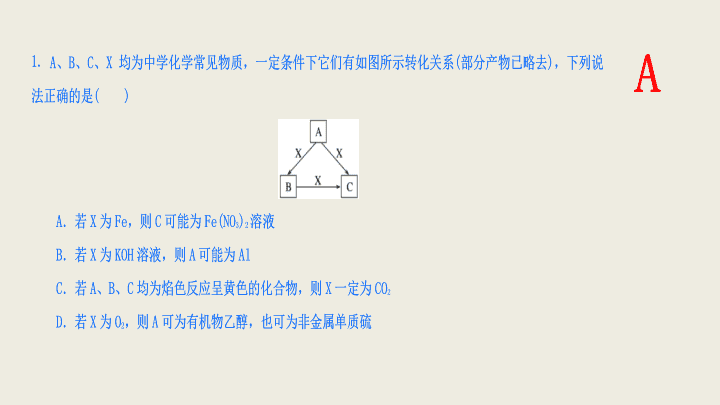
2017 届高考化学二轮总复习 无机化工流程 专题练习 A 【 解析 】 若 A 为 Al 、 X 为 KOH , Al 与 KOH 反应只能生成 KAlO 2 , B 项错;若 A 、 B 、 C 均为焰色反应呈黄色的化合物,则三者中都含有钠元素,则 X 可能为 CO 2 、 SO 2 、 H 2 S 等, C 项错;如果 A 为 S ,则 S 与 O 2 反应只能生成 SO 2 , D 项错。 【 答案 】A C C B 【 解析 】 稀盐酸不能与 Ba(NO 3 ) 2 反应, A 项不符合;硫酸钠、碳酸钠都不能与 CuO 和 Fe 反应,也不能使石蕊溶液变红, C 、 D 项都不符合。 【 答案 】B B (2) 吸收塔中吸收剂 X 是 ________________________ ,有关反应的离子方程式是 ________________________ ; (3) 温度超过 673 K 时,捕集器中捕集到的物质的相对分子质量为 325 ,该物质的分子式为 ________________ 。 (4) 从副产物 FeCl 3 溶液中获得 FeCl 3 ·6H 2 O 的方法是 _______________________ ; (5) 用 FeCl 3 溶液 (32% ~ 35%) 腐蚀印刷线路板的废液中含 FeCl 3 、 FeCl 2 和 CuCl 2 。用化学方法回收废液中铜的方法是 __________________________( 用反应式表示并简述操作要点 ) 。 【 解析 】 (1)FeCl 3 是强酸弱碱盐,能水解生成 Fe(OH) 3 胶体, Fe(OH) 3 胶体可吸附并沉降水中悬浮的杂质,用作净水剂。 (2) 铁屑与氯气在反应炉中发生放热反应,反应炉中的温度很高,所以尾气中含有 Cl 2 和 FeCl 3 ,用吸收剂 FeCl 2 溶液可吸收此尾气得到 FeCl 3 溶液。 (3)FeCl 3 的相对分子质量为 162.5 ,所以捕集器中相对分子质量为 325 的物质为 Fe 2 Cl 6 。 (4)FeCl 3 水解生成的 HCl 易挥发,直接在空气中加热 FeCl 3 溶液不能得到 FeCl 3 ·6H 2 O ,为了抑制 FeCl 3 水解,可在 HCl 气氛中加热浓缩 FeCl 3 溶液,然后冷却结晶。 【 答案 】 (1)FeCl 3 + 3H 2 O Fe(OH) 3 ( 胶体 ) + 3HCl , Fe(OH) 3 胶体能吸附并沉降水中悬浮的物质 (2)FeCl 2 溶液 2Fe 2 + + Cl 2 ===2Fe 3 + + 2Cl - (3)Fe 2 Cl 6 (4) 在 HCl 气氛中加热浓缩 FeCl 3 溶液,然后冷却结晶 (5) 加过量铁粉,发生反应 CuCl 2 + Fe===FeCl 2 + Cu ,过滤,分离得到的固体再与盐酸反应以溶解残留的铁,过滤得到铜 ( 或过滤、洗涤、干燥后,用磁铁吸去铁可得到铜 ) 7. 合金是建造航空母舰的主体材料。 (1) 航母升降机可由铝合金制造。 ①铝元素在周期表中的位置是 __________________________________________ 工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为 ________ ; ② Al - Mg 合金焊接前用 NaOH 溶液处理 Al 2 O 3 膜,其化学方程式为 _____________________________________ , 焊接过程中使用的保护气为 ________( 填化学式 ) ; (2) 航母舰体材料为合金钢。 ①舰体在海水中发生的电化学腐蚀主要为 ________ ; ②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为 ________ ; (3) 航母螺旋桨主要用铜合金制造。 【 解析 】 本题考查元素周期表、金属的腐蚀、化学方程式的书写、质量分数的计算、金属的冶炼和物质成分的判断。 (1) ①铝土矿中的 Al 2 O 3 与 NaOH 反应生成 NaAlO 2 通入 CO 2 可生成氢氧化铝。② Al 2 O 3 与 NaOH 反应生成 NaAlO 2 和 H 2 O ;为防止合金被氧化,需要加惰性气体,如 Ar 等。 (2) ①海水为中性,舰体中的钢发生吸氧腐蚀。② CaO 能与生铁中的 SiO 2 反应生成 CaSiO 3 和 CO 2 ,从而降低生铁中硅的含量。 (3) ①白色沉淀为 Al(OH) 3 可得 Cu 的质量分数为: (80.0 g - 27 g·mol - 1 ×39.0 g/78 g·mol - 1 )/80.0 g×100% = 83.1% 。②根据题目所给图可以看出, Al 3 + 在 pH = 3.4 时开始转化为沉淀,说明合金中含 Al ;在 pH 为 7.0 、 8.0 时过滤沉淀,说明 pH 7.0 到 8.0 范围内生成沉淀,根据图可以看出 Ni 2 + 在这个范围内转化为沉淀,说明合金中含 Ni 。 【 答案 】 (1) ①第三周期第 ⅢA 族 CO 2 ② Al 2 O 3 + 2NaOH===2NaAlO 2 + H 2 O Ar( 其他合理答案均可 ) (2) ①吸氧腐蚀 ② CaCO 3 或 CaO (3) ① 83.1% ② Al 、 Ni 8. 轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块 ( 主要成分为 MgCl 2 ,含 Fe 2 + 、 Fe 3 + 、 Mn 2 + 等杂质离子 ) 为原料制备轻质碳酸镁的工艺流程如下: 已知生成氢氧化物沉淀的 pH 见下表: 物质 开始沉淀 沉淀完全 Fe(OH) 3 2.7 3.7 Fe(OH) 2 7.6 9.6 Mn(OH) 2 8.3 9.8 Mg(OH) 2 9.9 11.1 注: Fe(OH) 2 沉淀呈絮状,不易从溶液中除去。 (1) “氧化”一步中发生反应的离子方程式为 __________________________________ ; (2) “调节 pH ”一步应调节溶液的 pH = 9.8 ,其目的是 ___________________________________________ ; (3) “热解”一步温度控制在 75 ℃左右,其原因是 __________________________________ ; (4) 从“过滤 2 ”步骤中得到的滤液中能回收的盐类物质主要有 __________( 填化学式 ) ; (5) 轻质碳酸镁的成分为碱式碳酸镁 [MgCO 3 ·Mg(OH) 2 ·3H 2 O] ,则“热解”一步发生反应的离子方程式为 _____________________________________________ 。 【 解析 】 由于卤块主要成分为氯化镁,其中含有 Fe 3 + 、 Fe 2 + 、 Mn 2 + 等杂质离子,通过生产流程最后得到轻质碳酸镁,因此加盐酸溶解后,溶液中主要有 Mg 2 + 、 Fe 3 + 、 Fe 2 + 、 Mn 2 + 和 Cl - 等,加次氯酸钠主要是将 Fe 2 + 氧化为 Fe 3 + ,由各种氢氧化物生成沉淀的 pH 可知,加入烧碱的目的主要是把溶液中的 Fe 3 + 和 Mn 2 + 转化为沉淀,而 Mg 2 + 留存溶液中,加入碳酸氢铵的目的是生成轻质碳酸镁沉淀。 (1) 离子反应为 ClO - + 2H + + 2Fe 2 + ===2Fe 3 + + Cl - + H 2 O 。 (2) 调节 pH = 9.8 的目的是使溶液中的 Fe 3 + 和 Mn 2 + 生成对应的氢氧化物沉淀而除去,而 Mg 2 + 不生成沉淀留存在溶液中。 (3) 加热温度至 75 ℃是为了提高碳酸氢铵和氯化镁溶液反应速率,但如果温度过高会导致碳酸氢铵分解。 (1) 滤渣的成分是 ________( 填化学式 ) ; (2)Zn 2 (OH) 2 CO 3 与硝酸反应的离子方程式为 ______________________________________________ ; (3) 酸溶过程锌与硝酸反应生成 NH 的离子方程式为 ___________________________________________ ; 10. 金属冶炼和处理常涉及氧化还原反应。 (1) 由下列物质冶炼相应金属时采用电解法的是 ________ ; a . Fe 2 O 3 b . NaCl c . Cu 2 S d . Al 2 O 3 (2) 辉铜矿 (Cu 2 S) 可发生反应 2Cu 2 S + 2H 2 SO 4 + 5O 2 ===4CuSO 4 + 2H 2 O ,该反应的还原剂是 ________ ,当 1 mol O 2 发生反应时,还原剂所失电子的物质的量为 ________mol ,向 CuSO 4 溶液中加入镁条时有气体生成,该气体是 ________ ; 【 解析 】 此题考查了金属的冶炼、氧化还原反应、电解精炼和原电池知识。 (1) 金属冶炼时,金属活动性顺序表中铝及其前面的金属一般采用电解法,故选 bd ; (2) 分析题给方程式: 2Cu 2 S + 2H 2 SO 4 + 5O 2 ===4CuSO 4 + 2H 2 O , Cu 元素和 S 元素的化合价均升高, O 元素的化合价降低,故还原剂是 Cu 2 S ;当 1 mol O 2 发生反应时,氧化剂氧气得到 4 mol 电子,则同时还原剂所失电子也为 4 mol ; CuSO 4 溶液由于 Cu 2 + 水解呈酸性,故加入镁条放出氢气; (3) 分析电解精炼银的装置,其中粗银应做阳极,故连接电源正极,是 a 极; b 极是阴极,若生成红棕色的 NO 2 气体,则是硝酸根放电: 2H + + NO 3 - + e - ===NO 2 + H 2 O ; (4) 处理银器时,食盐水的作用是做电解质溶液 ( 或导电 ) 。 【 答案 】 (1)bd (2)Cu 2 S 4 H 2 (3)a 2H + + NO 3 - + e - ===NO 2 + H 2 O (4) 做电解质溶液 ( 或导电 ) (4) 黄铜矿熔炼后得到的粗铜含少量 Fe 、 Ag 、 Au 等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: ________________________________________________ ; (5) 下表中,对陈述 Ⅰ 、 Ⅱ 的正确性及其有无因果关系的判断都正确的是 ________( 填字母 ) 。 选项 陈述 Ⅰ 陈述 Ⅱ 判断 A 铜绿的主要成分是碱式碳酸铜 可用稀盐酸除铜器表面的铜绿 Ⅰ 对; Ⅱ 对;有 B 铜表面易形成致密的氧化膜 铜容器可以盛放浓硫酸 Ⅰ 对; Ⅱ 对;有 C 铁比铜活泼 铆在铜板上的铁钉在潮湿空气中不易生锈 Ⅰ 对; Ⅱ 对;有 D 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 硫酸铜溶液可用作游泳池的消毒剂 Ⅰ 错; Ⅱ 对;无 【 解析 】 (1) 铜的质量百分含量: CuFeS 2 (34.8%) , Cu 5 FeS 4 (63.5%) , Cu 2 S(80%) , CuCO 3 ·Cu(OH) 2 (57.6%) 。 (2)Cu 2 O 、 Cu 2 S 的 Cu 由+ 1 被还原为 0 价,作氧化剂; Cu 2 S 的 S 由- 2 价被氧化为+ 4 价,作还原剂。 (3) 处理 SO 2 尾气一般为循环制备硫酸,和用氨水吸收,最后可得到 (NH 4 ) 2 SO 4 等有价值的化学品。 (5) 稀盐酸可以与 Cu(OH) 2 和 CuCO 3 反应,而且稀盐酸不能与 Cu 反应。所以稀盐酸可以除铜器表面的铜绿 [CuCO 3 ·Cu(OH 2 )] , A 正确。铜表面不能形成致密氧化膜;铜和浓硫酸在常温下是反应的,生成硫酸铜、 SO 2 和水,反应很慢,反应过程中放热,随着反应的进行,速率会越来越快,所以不能用铜制容器装浓硫酸, B 错误。因为 Fe 比 Cu 活泼,所以 Fe - Cu 形成的原电池中, Fe 作负极,更容易被氧化生锈, C 错误。蓝色硫酸铜晶体受热转化为白色硫酸铜粉末,有新物质生成,属于化学变化; CuSO 4 可用作消毒剂,但与前者没有因果关系, D 正确。综上所述,答案选 A 、 D 。 【 答案 】 (1)Cu 2 S (2)Cu 2 S 、 Cu 2 O (3) 形成酸雨 硫酸、硫酸铵 (4) 电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应, Cu 失去电子,使 Cu 单质变为 Cu 2 + 进入溶液中, Cu - 2e - ===Cu 2 + ;阴极上发生还原反应, Cu 2 + 得到电子在阴极上析出 Cu 单质, Cu 2 + + 2e - ===Cu ,从而达到精制 Cu 的目的 (5)AD 【 解析 】 (1) 硝酸具有氧化性,会氧化 Fe 2 + ,盐酸会引入 Cl - 杂质,故应加入稀硫酸。 (2) 由表格中的数据可知 pH = 5.4 时, Fe(OH) 3 和 Al(OH) 3 沉淀完全;由于开始时向软锰矿中加入了过量的硫酸,所以滤液 A 酸性很强,需要加碱性物质,使溶液 pH = 5.4 。 (3) 表格中 MnS 的溶度积最大,将 MnS 加入到含有 Cu 2 + 、 Zn 2 + 、 Fe 2 + 的溶液中,能够使溶度积更小的物质沉淀。 【 答案 】 (1) 稀硫酸 MnO 2 + 2Fe 2 + + 4H + ===Mn 2 + + 2Fe 3 + + 2H 2 O (2)Fe(OH) 3 、 Al(OH) 3 cd (3) 使溶液中的 Cu 2 + 、 Zn 2 + 、 Fe 2 + 转化为沉淀 (2) 高温反应后,石墨中氧化物杂质均转变为相应的氯化物,气体 Ⅰ 中的碳氧化物主要为 ____________ ,由气体 Ⅱ 中某物质得到水玻璃的化学反应方程式为 ____________________ ; (3) 步骤①为:搅拌、 ________________ ,所得溶液 Ⅳ 中的阴离子有 ________________ ; (4) 由溶液 Ⅳ 生成沉淀 Ⅴ 的总反应的离子方程式为 ________________________ , 100 kg 初级石墨最多可获得 Ⅴ 的质量为 ________kg 。; (5) 石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注 【 解析 】 (1) 向反应器中通入 Cl 2 前,通一段时间 N 2 的主要目的是排净反应器中的空气,作为保护气,防止石墨在高温下被氧化。 (2) 初级石墨中的氧化物杂质主要是 SiO 2 、 Al 2 O 3 、 Fe 2 O 3 和 MgO ,经高温反应后,均转变为相应的氯化物,则氧元素与碳 ( 过量 ) 在高温下结合为 CO ,故气体 Ⅰ 中的碳氧化物主要为 CO,80 ℃冷凝气体 Ⅰ ,由于 SiCl 4 的沸点为 57.6 ℃,金属氯化物的沸点均高于 150 ℃,故气体 Ⅱ 为 SiCl 4 。 SiCl 4 与 NaOH 溶液反应得到 Na 2 SiO 3 、 NaCl 和 H 2 O ,其化学方程方式为 SiCl 4 + 6NaOH===Na 2 SiO 3 + 4NaCl + 3H 2 O 。 (3) 由 (2) 知,固体 Ⅲ 为 AlCl 3 、 FeCl 3 、 MgCl 2 , 加入过量 NaOH 溶液, Al 3 + 转变为 AlO ,而 Fe 3 + 、 Mg 2 + 转化为 Fe(OH) 3 、 Mg(OH) 2 沉淀,故步骤①为:搅拌、过滤,所得溶液 Ⅳ 中的 Z 阴离子有 AlO 、 OH - 、 Cl - 。 (4) 溶液 Ⅳ 中加入乙酸乙酯,消耗了 OH - ,促进 AlO 的水解,最终转化为 Al(OH) 3 沉淀, 14. 我国有丰富的锆英石资源,其主要成分是 ZrSiO 4 ,还含有 Al 2 O 3 、 SiO 2 、 Fe 2 O 3 等杂质,生产锆的流程之一如下: 已知:锆 (Zr) 合金是核反应堆燃料棒的包裹材料,二氧化锆 (ZrO 2 ) 可以制造耐高温纳米陶瓷。 (1) 上述流程中高温气化的反应是氧化还原反应 ( 碳转化成 CO) ,其中氧化剂是 ________ ,转移 1.204×10 24 个电子时,生成 SiCl 4 ________g ; (2) 写出 ZrCl 4 与水反应的化学方程式: ____________________________ ; 写出 ZrOCl 2 ·8H 2 O 在 900 ℃条件下分解的化学方程式: _________________________________________ ; (3) 下列关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 ________ ; A . 1 nm = 10 - 10 m B .锆合金的硬度比纯锆要高 C .二氧化锆纳米陶瓷是新型无机非金属材料 (4) 一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇 (Y 2 O 3 ) 的氧化锆 (ZrO 2 ) 晶体,在熔融状态下能传导 O 2 - 。在熔融电解质中, O 2 - 向 ________( 填“正”或“负” ) 极移动。电池的负极反应式为 ________________________ 。 15. 重铬酸钾 (K 2 Cr 2 O 7 ) 是工业上重要的氧化剂 , 实验室利用铬铁矿 ( 主要成分为 FeO·Cr 2 O 3 ) 模拟工业生产制备重铬酸钾的主要工艺如下 : 回答下列问题 : (1) 铬铁矿中的 SiO 2 和 Al 2 O 3 在反应器中与纯碱共热反应转变为可溶性盐 , 写出 Al 2 O 3 与碳酸钠反应的化学方程式 : ;查看更多