- 2021-07-05 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第2讲 镁、铝及其重要化合物-热点模型3 一折一拐总关情:无机图像分析
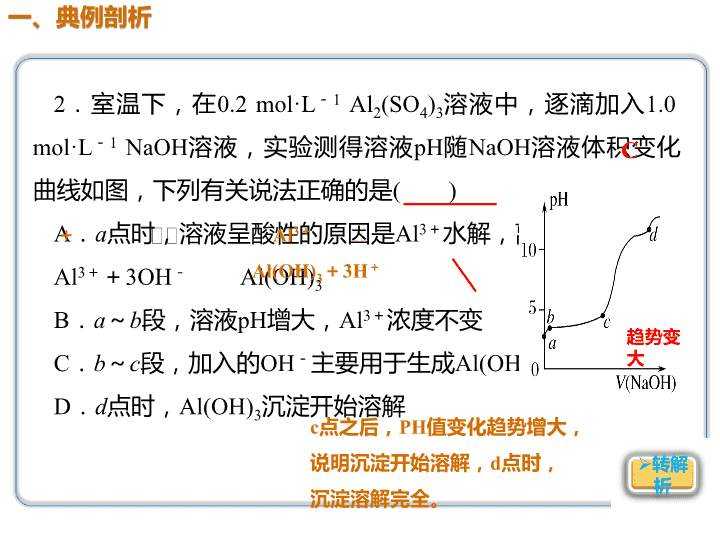
2.室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化 曲线如图,下列有关说法正确的是( ) A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为: Al3++3OH- Al(OH)3 B.a~b段,溶液pH增大,Al3+浓度不变 C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀 D.d点时,Al(OH)3沉淀开始溶解 C A l 3 + + 3 H 2 O Al(OH)3+3H+ 趋势变 大 c点之后,PH值变化趋势增大, 说明沉淀开始溶解,d点时, 沉淀溶解完全。 解析 A项,a点时,即为Al2(SO4)3溶液,由于Al3+ 水解:Al3++3H2O Al(OH)3+3H+,溶液呈酸性,错误;B项,a~b 段,主要是滴入的NaOH溶液中和了水解生成的H+, c(H+)减小,溶液pH增大,另外,一方面,c(H+)减小 一定程度上促进了Al3+的水解,另一方面溶液体积增 大,故c(Al3+)减小,错误;C项,b~c段,pH变化缓 慢,主要发生反应:Al3++3OH-===Al(OH)3↓,正确; D项,c点后pH变化较快的一段,为Al3+沉淀完全, Al(OH)3未溶解而c(OH-)增大的过程,d点前pH变化较 缓慢的一段反应为:Al(OH)3+OH-===AlO2-+2H2O, 故d点时,Al(OH)3已完全溶解,错误。 4.(2018·衡阳模拟)将一定质量的镁铝混合物投入200 mL硫 酸中,固体全部溶解后,向所得溶液中加入5 mol·L-1的 NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V 的变化如图所示: 则下列说法不正确的是( ) A.镁和铝的总质量为9 g B.最初20 mL NaOH溶液用于中和过量的硫酸 C.硫酸的物质的量浓度为2.5 mol·L-1 D.生成的氢气在标准状况下的体积为11.2 L D 镁、 铝 元素 守恒 特殊点选择: 沉淀最高点时,溶液中只 有Na2SO4 守恒可算酸的浓度 [说明] 前两“看”较直观,难度较小。第三 “看”难度大些,只有在正确书写出变化过 程中的反应方程式并理清化学方程式中化学 计量数与题目相关量的数量关系才能顺利破 题。 解答图像题思维模板查看更多