- 2021-07-05 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习苏教版共价键和配位键学案
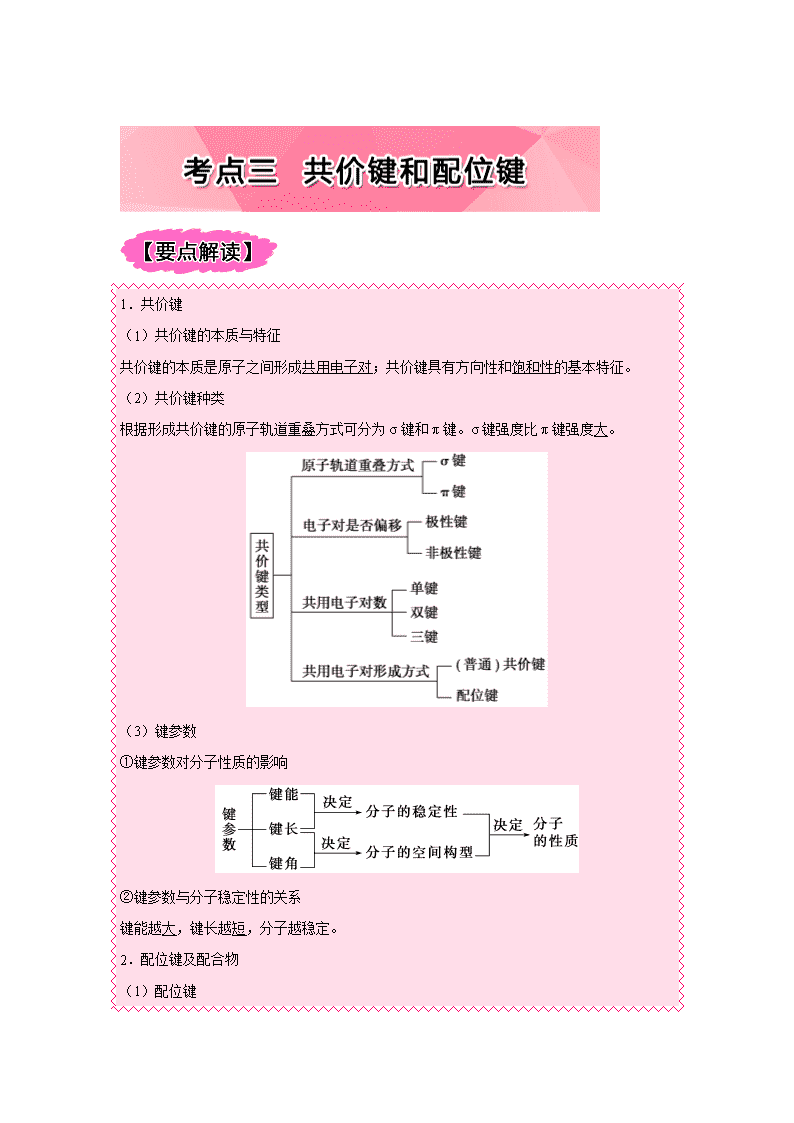
1.共价键 (1)共价键的本质与特征 共价键的本质是原子之间形成共用电子对;共价键具有方向性和饱和性的基本特征。 (2)共价键种类 根据形成共价键的原子轨道重叠方式可分为 σ 键和 π 键。σ 键强度比 π 键强度大。 (3)键参数 ①键参数对分子性质的影响 ②键参数与分子稳定性的关系 键能越大,键长越短,分子越稳定。 2.配位键及配合物 (1)配位键 由一个原子提供弧电子对与另一个接受弧电子对的原子形成的共价键。 (2)配位键的表示方法 如 A→B:A 表示提供孤电子对的原子,B 表示接受共用电子对的原子。 (3)配位化合物 ①组成: ②形成条件: Error! 【重难点指数】★★★ 【重难点考向一】σ 键、π 键的判断 【典型例题 1】 (1)【2015·高考全国卷Ⅰ,37 (3)节选】CS2 分子中,共价键的类型有________。 (2)【2014·高考全国卷Ⅰ,37(3)节选】1 mol 乙醛分子中含有的 σ 键的数目为________。 【答案】(1)σ 键和 π 键 (2)6NA 【重难点考向二】键参数的应用 【典型例题 2】 (1)【2015·高考全国卷Ⅰ,37 (2)节选】碳在形成化合物时,其键型以共价键为主,原 因是________________。 (2)【2014·高考全国卷Ⅰ,37(2)节选】O、N、S 与氢元素形成的二元共价化合物分子 中,既含有极性共价键、又含有非极性共价键的化合物是________________(填化学式,写 出两种)。 【答案】(1)C 有 4 个价电子且半径较小,难以通过得或失电子达到稳定结构 (2)H2O2、N2H4 【名师点睛】(1)通过物质的结构式,可以快速有效地判断键的种类及数目;判断成键方式 时,需掌握:共价单键全为 σ 键,双键中有一个 σ 键和一个 π 键,三键中有一个 σ 键和两 个 π 键。 (2)σ 键比 π 键稳定。 1.下列关于丙烯(CH 3—CH =CH2)的说法正确的 ( ) A.丙烯分子中 3 个碳原子都是 sp3 杂化 B.每个丙烯分子有 7 个 σ 键,1 个 π 键 C.丙烯分子是存在非极性键和极性键的极性分子 D.丙烯分子为手性分子 【答案】C 2.关于共价键,下列说法不正确的是 ( ) A.按共用电子对是否偏移,可以把共价键划分为极性键和非极性键 B.按原子轨道的重叠方式,分为 σ 键和 π 键 C.按共用电子对的提供方式,分为配位键和普通共价键 D.所有分子中都含有共价键 【答案】D 【解析】A.共价键划按照组成共价键的原子是否相同分为极性键和非极性键,相同原子形 成的共价键没有共用电子对的偏移,为非极性键,不同原子形成的共价键有共用电子对的偏 移,为极性键,故 A 正确;B.σ 键按键轴方向采用头碰头的方式重叠,π 键则是平行键轴 方向采用肩并肩的方式重叠,因此可以将共价键按原子轨道的重叠方式,分为 σ 键和 π 键, 故 B 正确;C.配位键由某个原子单方面提供共用电子对,另一个原子提供空的原子轨道成 键。普通共价键则是由双方原子各提供一个电子形成一对共用电子对,故 C 正确;D.稀有 气体分子没有共价键,故 D 错误。故选 D。 3.乙酸分子结构中,含有的 σ 键和 π 键的个数分别是 ( ) A.7、1 B.6、2 C.3、5 D.4、4 【答案】A 【解析】分子中含有 1 个 C=O、3 个 C﹣H、1 个 C﹣C、1 个 C﹣O、1 个 O﹣H 键,其中 C=O 含有 σ 键、π 键,其它都为 σ 键,则分子中含有 7 个 σ 键、1 个 π 键.故选 A. 4.以下微粒含配位键的是 ( ) ①N2H+5 ②CH4 ③OH- ④NH+4 ⑤Fe(CO)5 ⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2]OH ⑨B(OH)4]- A.①②④⑦⑧ B.③④⑤⑥⑦⑨ C.①④⑤⑥⑦⑧⑨ D.全部 【答案】C 【解析】①氢离子提供空轨道,N2H4 氮原子提供孤电子对,所以能形成配位键,N2H5+含有 配位键,故①正确;②甲烷中碳原子满足 8 电子稳定结构,氢原子满足 2 电子稳定结构,无 空轨道,无孤电子对,CH4 不含有配位键,故②错误; ③OH-电子式为 ,无空 轨道,OH-不含有配位键,故③错误;④氨气分子中氮原子含有孤电子对,氢离子提供空轨 道,可以形成配位键,NH4+含有配位键,故④正确;⑤Fe(CO)5 中 Fe 原子提供空轨道,CO 提供孤对电子,可以形成配位键,故⑤正确;⑥SCN-的电子式 ,铁离子提供 空轨道,硫原子提供孤电子对,Fe(SCN)3 含有配位键,故⑥正确;⑦H3O+中 O 提供孤电子 对,H+提供空轨道,二者形成配位键,H3O+含有配位键,故⑦正确;⑧Ag+有空轨道,NH3 中的氮原子上的孤电子对,可以形成配位键,Ag(NH3)2]OH 含有配位键,故⑧正确; ⑨B(OH)4]-离子中氧原子含有孤电子对,硼原子含有空轨道,B3+与 OH-之间形成配位键,所 以含有配位键,故⑨正确。故选 C。 5.A、B、C、D、E、F、G 是前四周期(除稀有气体)原子序数依次增大的七种元素,A 的原子核外电子只有一种运动状态;B、C 的价电子层中未成对电子数都是 2;B、C、D 同 周期;E 核外的 s、p 能级的电子总数相筹;F 与 E 同周期且第一电离能比 E 小;G 的+1 价 离子(G+)的各层电子全充满。回答下列问题: (相关问题用元素符号表示) (1)写出 E 的基态原子的电子排布式________________________。 (2)B 与 C 可形成化合物 BC 和 BC2,BC2 属于__________(填“极性”、“非极性”)分子, 1 mol BC 含有 π 键为____________________mol。 (3)由元素 A、C、G 组成的离子 G(A 2C)4]2+在水溶液中显天蓝色,不考虑空间结构, G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。 (4)测定 A、D 形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是 _______。 (5)由元素 A、B、F 组成的原子个数比 9 : 3 : 1 的一种物质,分子中含三个相同的原子团, 其结构简式为________________,分子中 F 原子的杂化方式为__________,该物质遇水爆 炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。 【答案】(1)1s22s22p63s2 (2)非极性 2 (3) (4)HF 分子之间存在氢键,形成缔合分子 (5)Al(CH3)3 sp2 杂化 Al(CH3)3 +3H2O = Al(OH)3↓+3CH4↑ (1)E 为 Mg 元素,基态原子的电子排布为 1s22s22p63s2; (2)B(C)与 C(O)可形成化合物 BC(CO)和 BC2(CO2),CO2 结构式为 O=C=O,电 荷中心重合,为非极性分子,CO 的结构式为 C≡O,含有 2molπ 键; (3)Cu(H2O)42+,水与铜离子形成 4 个配位键,结构为 ; (4)测定 A、D 形成的化合物 HF 的相对分子质量时,实验测定值一般高于理论值的原因 是 HF 分子之间存在氢键,形成缔合分子; (5)由元素 H、C、Al 组成的原子个数比 9:3:1 的一种物质,分子中含三个相同的原子 团,其结构简式为 Al(CH3)3,根据价层电子对互斥理论计算电子对数为 3+(3-3×1)/2=3,杂 化类型为 sp2,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为 Al(CH3)3 +3H2O = Al(OH)3↓+3CH4↑。查看更多