- 2021-07-05 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】河北省石家庄市辛集市第二中学2020-2021学年高一上学期10月月考试卷(解析版)
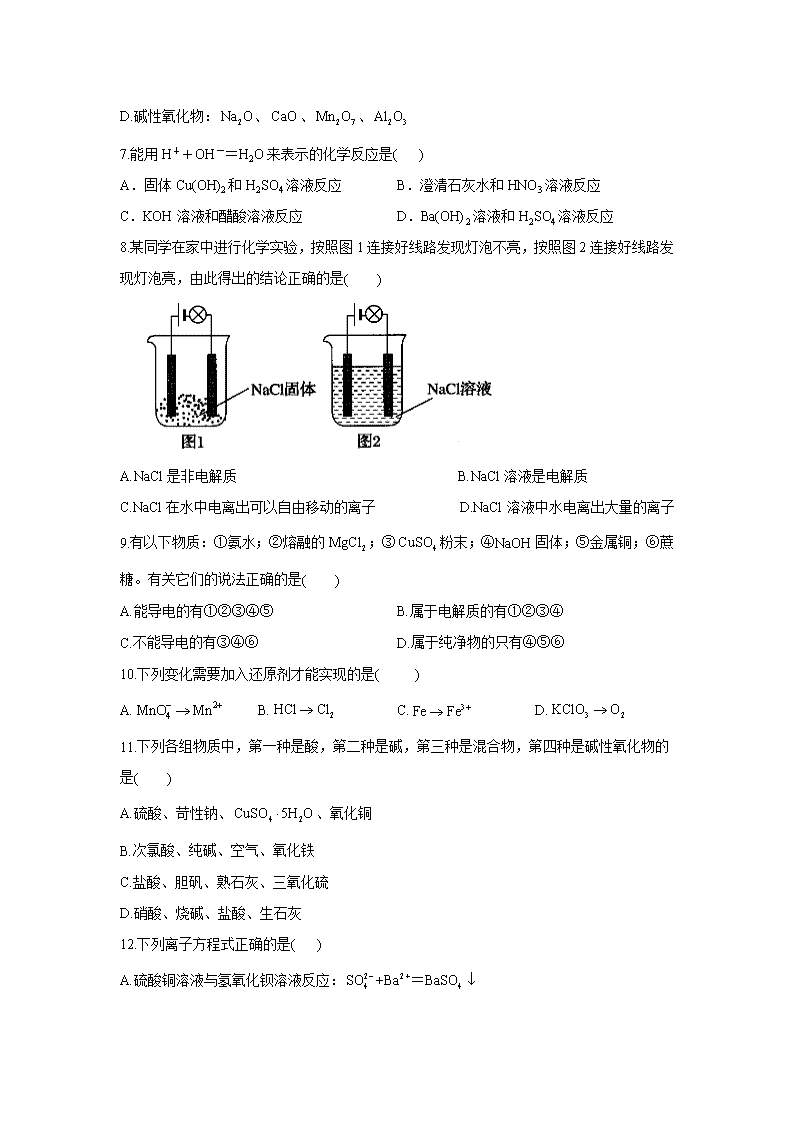
河北省石家庄市辛集市第二中学2020-2021学年高一上学期10月月考试卷 一、单选题 1.分类是科学研究的重要方法,下列物质分类不正确的是( ) A.化合物:干冰、冰水混合物、烧碱、小苏打 B.同素异形体:活性炭、、石墨、金刚石 C.非电解质:乙醇、四氯化碳、氯气、葡萄糖 D.混合物:漂白粉、纯净矿泉水、盐酸、大理石 2.下列与胶体性质无关的是( ) A.河流入海口处形成沙洲 B.冶金厂常用高压电除去烟尘 C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 D.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 3.当光束通过下列分散系:①含尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水, 能观察到有丁达尔效应的是( ) A.①② B.②③ C.①④ D.②④ 4.下列物质中,属于电解质的是( ) ①熔融态铁 ②液氯 ③ ④NaCl固体 ⑤ ⑥NaCl溶液 A.①② B.②③④ C.③④ D.全部 5.下列各组离子中,能在溶液中大量共存的一组是( ) A. B. C. D. 6.下列物质的分类合理的是( ) A.氧化物:、、、 B.碱:NaOH、KOH、、 C.铵盐:、、、 D.碱性氧化物:、、、 7.能用H++OH-=H2O来表示的化学反应是( ) A.固体Cu(OH)2和H2SO4溶液反应 B.澄清石灰水和HNO3溶液反应 C.KOH溶液和醋酸溶液反应 D.Ba(OH)2溶液和H2SO4溶液反应 8.某同学在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( ) A.NaCl是非电解质 B.NaCl溶液是电解质 C.NaCl在水中电离出可以自由移动的离子 D.NaCl溶液中水电离出大量的离子 9.有以下物质:①氨水;②熔融的;③粉末;④NaOH固体;⑤金属铜;⑥蔗糖。有关它们的说法正确的是( ) A.能导电的有①②③④⑤ B.属于电解质的有①②③④ C.不能导电的有③④⑥ D.属于纯净物的只有④⑤⑥ 10.下列变化需要加入还原剂才能实现的是( ) A. B. C. D. 11.下列各组物质中,第一种是酸,第二种是碱,第三种是混合物,第四种是碱性氧化物的是( ) A.硫酸、苛性钠、、氧化铜 B.次氯酸、纯碱、空气、氧化铁 C.盐酸、胆矾、熟石灰、三氧化硫 D.硝酸、烧碱、盐酸、生石灰 12.下列离子方程式正确的是( ) A.硫酸铜溶液与氢氧化钡溶液反应: B.碳酸氢钠溶液中滴加氢氧化钠溶液 C.碳酸钙溶解于盐酸中: D.过氧化钠与水的反应: 13.下列各选项中的两组物质在溶液中的反应,可用同一离子方程式表示的是( ) A.NaOH与HCl;与HCl B.与;与 C.与硝酸溶液;与硝酸 D.硝酸与石灰石;醋酸与石灰石 14.已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+,Sn2++2Fe3+=2Fe2++Sn4+,由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是 ( ) A. Sn2+ 、Fe2+、Ce3+ B. Sn2+、Ce3+、Fe2+ C. Ce3+、Fe2+ 、Sn2+ D. Fe2+、Sn2+、Ce3+ 15.下列反应的离子方程式书写不正确的是( ) A.金属钠与水: B.氯化钠溶液与硝酸银溶液: C.稀盐酸与碳酸钙: D.稀硫酸与氢氧化钡溶液: 16.下列关于氧化还原反应的叙述中正确的是( ) A.失去电子的反应是还原反应 B.作氧化剂的物质不能是还原剂 C.发生氧化反应的物质是氧化剂 D.失去电子的物质是还原剂 17.下列化学反应中溴元素仅被氧化的是( ) A. B. C. D. 18.的氧化性依次减弱。在水溶液中不可能发生的是( ) A. B. C. D. 19.离子方程式中的不可能来自下列物质中的( ) ①HCl ② ③ ④ ⑤ A.①③ B.①④⑤ C.②④⑤ D.①⑤ 20.磷单质在反应中( ) A.被氧化 B.被还原 C.既被氧化又被还原 D.既未被氧化又未被还原 21.下列说法中正确的是( ) A.氧化还原反应必定有氧元素参加反应 B. 的反应为氧化还原反应 C.氧化还原反应过程中所有元素的化合价均有变化 D.1个Fe原子参加化学反应时,转移的电子数一定是3个 22.铊(Tl)盐与氰化钾(KCN)被列为A级危险品.已知下列反应在一定条件下能够发生: ① ② ③ 下列离子氧化性比较顺序正确的是( ) A.TI3+>Fe3+>Ag+ B.Fe3+>Ag+>TI3+ C.Tl+>Ag+>Fe2+ D. 23.下列实验现象与氧化还原反应有关的是( ) ①碳酸钠溶液中加入氯化钙溶液产生沉淀 ②铜粉在空气中加热变为黑色粉末 ③石灰石溶于盐酸产生无色、无味的气体 ④氢气在空气中完全燃烧产生淡蓝色火焰 A.①② B.②③ C.②④ D.③④ 24.在下列条件下,一定能大量共存的离子组是( ) A.无色透明的水溶液中:K+、Mg2+、I﹣、 B.在强碱溶液中:Na+、K+、、 C.有存在的溶液中:Na+、Mg2+、Ca2+、H+ D.在强酸溶液中:、、、Cl﹣ 25.有4瓶常用溶液:①溶液,②NaCl溶液,③溶液,④溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序是( ) A.④③①② B.①③④② C.④①③② D.①④②③ 二、填空题 26、填空题 ① Cu ② ③ ④ 液氨 ⑤液态 HCl ⑥ 熔融 ⑦ 蔗糖 ⑧ NaOH溶液 ⑨冰水混合物 ⑩固体 (1)上述物质中属于电解质的是 _____ (填序号,下同),属于非电解质是 __________ ,既是电解质又能导电的是 ____ 。 (2)常温下,② ⑨ ⑩这三种物质相互作用可生成一种新物质,该反应_______(“是”或“不是”)氧化还原反应。 (3)写出下列反应的离子方程式 A.物质③ 与稀硫酸溶液反应的离子方程式: B.物质⑩与⑤ 溶液反应的离子方程式: 27、回答下列问题 有以下反应: ① ② ③ ④ ⑤ (1)上述反应中不属于氧化还原反应的有________________(填序号,下同)。 (2)只作氧化剂的是________________,只作还原剂的是________________。 (3)属于氧化还原反应,但其中的既不被氧化,又不被还原的是________________。 (4)二氧化碳通入氢氧化钠溶液(离子方程式)_________________。 (5)用双线桥法表示下列氧化还原反应的电子转移: 2KClO3 === 2KCl + 3O2 【参考答案】 1.答案:C 解析:氯气为单质,不是化合物,不是非电解质。 2.答案:D 解析: 3.答案:C 解析:试题分析:能发生丁达尔效应的是胶体分散系。①属于胶体,②属于溶液③属于纯净物④属于胶体,所以答案选C。 4.答案:C 解析:单质和混合物既不是电解质也不是非电解质,化合物中一般酸、碱、盐、水、金属氧化物属于电解质,故C正确。 5.答案:C 解析:A. 都与发生反应,在溶液中不能大量共存,故A错误; B.之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误; C.之间不发生反应,在溶液中能够大量共存,故C正确; D.之间发生反应,在溶液中不能大量共存,故D错误; 6.答案:A 解析:、、、中各种物质都只含两种元素,且其中一种元素是氧元素,所以都是氧化物,故A正确;碳酸钠电离产生钠离子与碳酸根离子,属于盐,故B错误;属于碱,故C错误;属于酸性氧化物,属于两性氧化物,故D错误。 7.答案:B 解析:A. 氢氧化铜为沉淀,应保留化学式,硫酸是溶于水的强酸,氢氧化铜和溶液反应,离子方程式为:,故A错误; B. 澄清石灰水和溶液反应是溶于水的强碱和强酸反应生成可溶于水的盐和水,可以用来表示,故B正确; C. 醋酸是弱酸,应保留化学式,和氢氧化钾溶液,离子方程式为: ,故C错误; D. 与溶液之间发生酸碱中和反应,离子方程式为:,故D错误; 故选B. 8.答案:C 解析:电解质导电是有条件的,即水溶液或熔融状态下能电离出自由移动的离子,图1灯泡不亮,因为没有提供电解质导电的条件,A项错误;电解质是化合物,属于纯净物,B项错误;图2灯泡亮,说明存在自由移动的离子,即在氯化钠溶液中,氯化钠电离出自由移动的离子,C项正确;水是弱电解质,电离出的和量很小,D项错误。 9.答案:C 解析:能导电必须符合含有自由移动的离子或电子,故为①②⑤;电解质是在水溶液或熔融状态下能够导电的化合物,故为②③④;不能导电的有③④⑥;属于纯净物的有②③④⑤⑥。 10.答案:A 解析:还原剂失去电子,化合价升高。如果变化需要加入还原剂才能实现,这说明该物质一定是得到电子的,化合价一定是降低的。A中Mn元素的化合价降低,A符合题意。B中氯元素的化合价升高,需要加入氧化剂。C中铁元素的化合价也是升高的,需要加入氧化剂。D中氧元素的化合价升高,且氯酸钾分解即可以生成氧气,不需要加入氧化剂或还原剂。 11.答案:D 解析:在溶液中电离出来的阳离子全部是的化合物叫作酸;在溶液中电离出来的阴离子全部是的化合物叫作碱;由两种或两种以上成分组成的物质叫作混合物;能跟酸反应生成盐和水的氧化物叫作碱性氧化物。A组中是纯净物,不是混合物,A项错误。B组中纯碱不是碱,B项错误。C组中胆矾不是碱,三氧化硫不是碱性氧化物,熟石灰是纯净物,C项错误。D组中硝酸是酸;烧碱是碱;盐酸属于混合物;生石灰与酸反应:,生石灰是碱性氧化物,D项正确。 12.答案:D 解析:A. 硫酸铜和氢氧化钡反应除了生成硫酸钡沉淀外,还会生成氢氧化铜沉淀,A错误; B. 碳酸氢钠和氢氧化钠反应生成碳酸钠和水,B错误; C. 碳酸钙难溶于水,不能拆,C错误; D. 过氧化钠与水的反应: ,D正确。 故选:D。 13.答案:B 解析:氢氧化钠是可溶性强电解质(拆开)、氢氧化铜是难溶性弱电解质(不拆),离子方程式表达不同,A项错误;与生成硫酸钡沉淀和氯化钠;与生成硫酸钡沉淀和氢氧化钠,本质都是钡离子与硫酸根离子反应生成硫酸钡沉淀,B项正确;是可溶性强电解质(拆开)、是难溶性强电解质不拆),离子方程式表达不同,C项错误;石灰石分别与醋酸、硝酸反应,醋酸是弱电解质(不拆),硝酸是强电解质(拆开),离子方程式表达不同,D项错误。 14.答案:A 解析:根据反应:Ce4++Fe2+=Fe3++Ce3+,还原性是Fe2+>Ce3+,根据反应:Sn2++2Fe3+=2Fe2++Sn4+,还原性是Sn2+>Fe2+,所以还原性顺序是:Sn2+>Fe2+>Ce3+. 故选A. 15.答案:D 解析:A. 金属钠与水,离子方程式:,故A正确; B. 氯化钠溶液与硝酸银溶液,离子方程式:,故B正确; C. 稀盐酸与碳酸钙,离子方程式:,故C正确; D. 稀硫酸与氢氧化钡溶液,离子方程式:,故D错误; 16.答案:D 解析:失去电子的物质是还原剂,发生氧化反应,故A错误,D正确;作氧化剂的物质也可能是还原剂,例如反应中,氯气既是氧化剂又是还原剂,故B错误;得到电子的物质是氧化剂,发生还原反应,故C错误。 17.答案:A 解析:中Br元素化合价升高,被氧化,A正确; 中Br元素化合价降低,被还原,B错误;中Br元素化合价既有升高又有降低,溴元素既被氧化又被还原,C错误;中Br元素化合价不变,D错误。 18.答案:D 解析:根据氧化还原反应规律,氧化剂的氧化性强于氧化产物的氧化性。的氧化性强于,反应可以发生,A正确;的氧化性强于,反应可以发生,B正确;的氧化性强于,反应可以发生,C正确;的氧化性强于,反应不能发生,D错误。 19.答案:C 解析:根据离子方程式可知该物质能完全电离出氢离子,因此可以是强酸,例如盐酸和硝酸,由于硫酸钡比碳酸钡还难溶,所以不能是硫酸和硫酸氢钠,碳酸是弱酸,不能完全电离,所以也不可能是碳酸,故选C。 20.答案:C 解析:磷元素的化合价由反应前的0价,一部分升高为中的+1价,被氧化;另一部分降低为中的-3价,被还原,故选C项。 21.答案:B 解析:氧化还原反应过程中必有电子的转移,但不一定有氧元素参加反应,如在中燃烧就是氧化还原反应,但并无氧元素参与,A项错误;与反应生成了单质,氧元素的化合价有变化,因此该反应是氧化还原反应,B项正确;氧化还原反应过程中不一定所有元素化合价均有变化,如与NaOH反应时,只有氯元素化合价有变化,而Na、O、H元素的化合价没有变化,C项错误;Fe与反应时,1个Fe原子参与反应,转移的电子数为3,而Fe与盐酸反应时,1个Fe原子反应只转移2个电子,D项错误。 22.答案:D 解析:在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性。 23.答案:C 解析:碳酸钠溶液中加人氯化钙溶液发生反应:,属于复分解反应,无化合价升降,是非氧化还原反应;石灰石溶于盐酸发生反应:,无化合价升降,属于非氧化还原反应;铜粉在空气中加热,发生反应,氢气在空气中完全燃烧发生反应:,两者均属于有单质参加的化合反应,都属于氧化还原反应。 24.答案:B 解析:A.无色透明不存在 C.有和 Ba2+反应 D.能使石蕊变红的溶液,显酸性: ClO﹣ 不存在 25.答案:C 解析:硫酸铜溶液为蓝色,所以硫酸铜可以首先被鉴别出来,然后利用硫酸铜和氯化钡反应,把氯化钡溶液鉴别出来,把剩余两液体分别滴入到氯化钡溶液中,无现象时所加溶液为氯化钠溶液,有沉淀时所加溶液为硫酸钠溶液。所以这四种物质先后被鉴别出来的顺序为:硫酸铜溶液、氯化钡溶液、硫酸钠溶液、氯化钠溶液或者是硫酸铜溶液、氯化钡溶液、氯化钠溶液、硫酸钠溶液,即:④①③②或者④①②③。 26、答案:(1)③⑤⑥⑨⑩;②④⑦;⑥⑨ (2)不是 (3)A. B. CaCO3 +2H+ = Ca2+ + CO2 + H2O 27、答案:(1)①⑤ (2)④ ③ (3)② (4) 解析:(1)①⑤中没有元素化合价的变化,是非氧化还原反应;②③④中有元素化合价发生变化,属于氧化还原反应。 (2)反应②中水既不是氧化剂,也不是还原剂;反应③中,水中氧元素的化合价从-2价升高到0价,失去电子,水作还原剂,被氧化;反应④中,水中氢元素的化合价从+1价降低到0价,得到电子,水作氧化剂,被还原。 (3)反应②是氧化还原反应,但水既不被氧化,又不被还原。 (4)NaOH和均是强电解质,应拆成离子形式,由此可写出对应的离子方程式。 查看更多