- 2021-07-05 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习鲁科版3-高考专题讲座(一)气体的制法及其性质探究教案
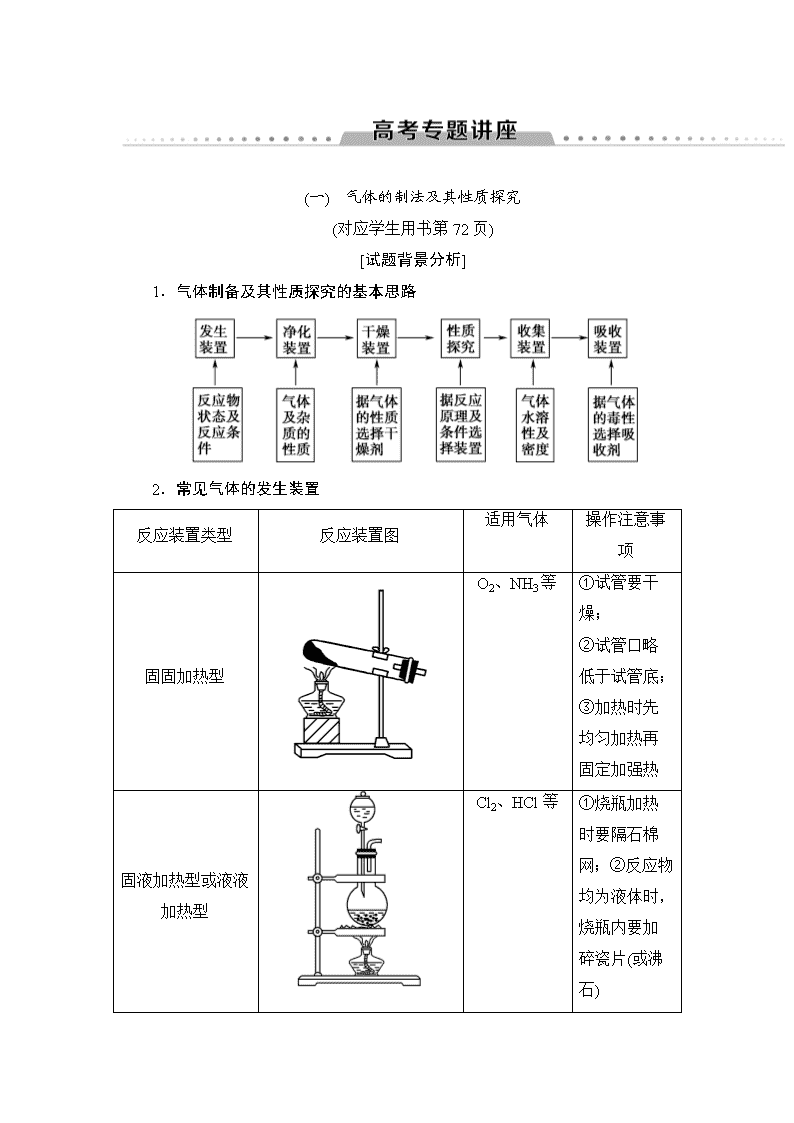
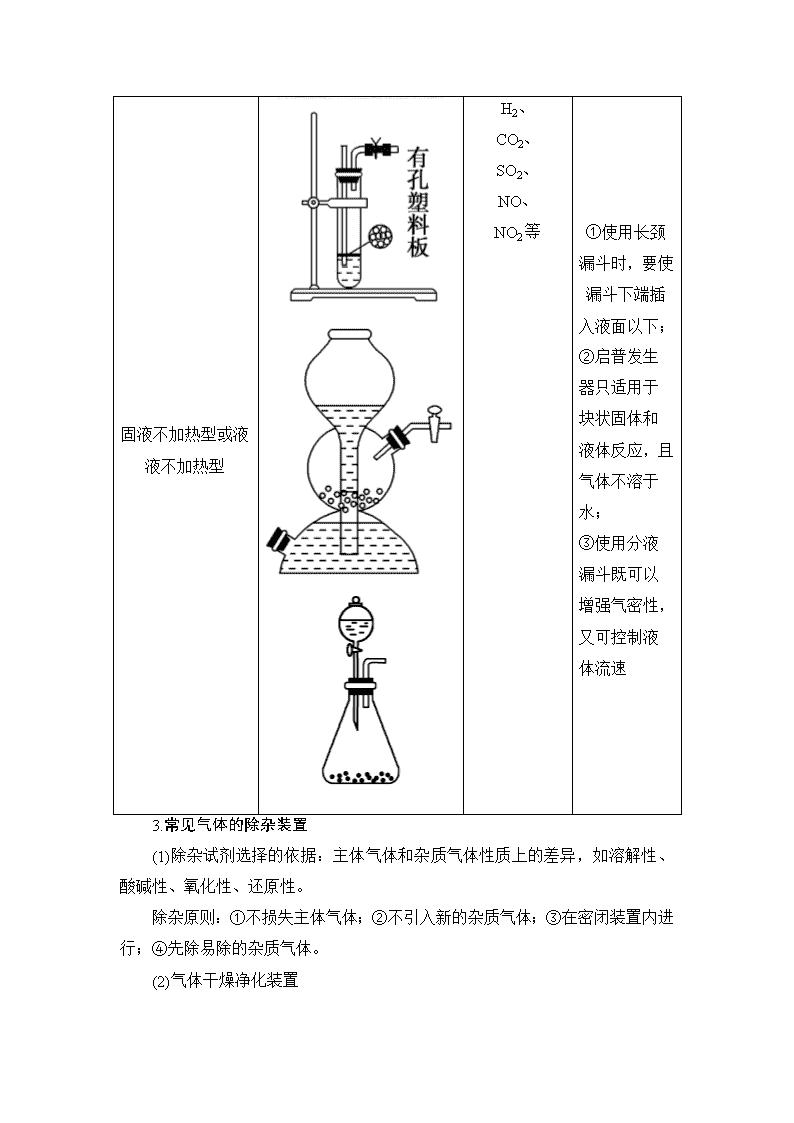
(一) 气体的制法及其性质探究 (对应学生用书第72页) [试题背景分析] 1.气体制备及其性质探究的基本思路 2.常见气体的发生装置 反应装置类型 反应装置图 适用气体 操作注意事项 固固加热型 O2、NH3等 ①试管要干燥; ②试管口略低于试管底; ③加热时先均匀加热再固定加强热 固液加热型或液液加热型 Cl2、HCl等 ①烧瓶加热时要隔石棉网;②反应物均为液体时,烧瓶内要加碎瓷片(或沸石) 固液不加热型或液液不加热型 H2、 CO2、 SO2、 NO、 NO2等 ①使用长颈漏斗时,要使漏斗下端插入液面以下; ②启普发生器只适用于块状固体和液体反应,且气体不溶于水; ③使用分液漏斗既可以增强气密性,又可控制液体流速 3.常见气体的除杂装置 (1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。 除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。 (2)气体干燥净化装置 类型 液态干燥剂 固态干燥剂 固态干燥剂 固体加热 装置 Ⅰ Ⅱ Ⅲ Ⅳ 常见干燥剂 浓H2SO4 (酸性、强氧化性) 无水氯化钙(中性) 碱石灰(碱性) 除杂试剂Cu、CuO、Mg等 4.常见气体的收集方法 (1)排水法:收集难溶于水的气体,如O2、H2、N2、NO、CO、C2H4等。 (2)排液法:收集难溶于所选溶液的气体,如Cl2用排饱和食盐水法收集。 (3)向上排空气法:收集气体密度比空气的大且相差较大,即相对分子质量大于29,如Cl2、CO2、NO2等。 (4)向下排空气法:收集气体密度比空气的小且相差较大,即相对分子质量小于29,如CH4、H2、NH3等。 5.尾气处理分析 对有毒、有害的气体必须用适当的方法予以吸收或点燃变为无毒、无害的气体,再排放到空气中。 (1)用水吸收的是:NH3、HCl(注意防倒吸)。 (2)用烧碱溶液吸收的是:Cl2、HCl、H2S、SO2、NO2。 (3)用硫酸铜溶液或醋酸铅溶液吸收的是:H2S。 (4)用点燃法除去的是:CO、H2、CH4。 (5)用收集法除去的是:NO。 [试题分类探究] 气体的发生、净化、收集和尾气处理的分析 1.(2018·聊城模拟)下列有关实验装置的说法中正确的是________(填序号)。 图1 图2 图3 图4 图5 (1)用图1装置可制取干燥纯净的NH3 (2)用图2装置可制备SO2 (3)用图3装置可制备NO (4)用图4装置进行H2、NH3、CO2、Cl2、HCl、NO2等气体的收集,但不能用于NO气体收集 (5)用图5装置当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 (6)用图6装置可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气,并防止倒吸 图6 (7)用图7装置进行H2、O2、Cl2、SO2、NH3、CO2等气体的干燥 图7 图8 (8)用图8装置进行Cl2、NO、SO2、N2的收集 【解析】 (1)NH3应用向下排空气法收集; (3)NO不能用排空气法收集; (5)不能防止倒吸,因为苯比水的密度小,在上层; (6)SO2为酸性气体不能用碱石灰干燥; (7)Cl2、SO2、CO2为酸性气体,不能用碱石灰干燥; (8)Cl2、SO2可溶于水,不能用排水法收集。 【答案】 (2)(4) 2.用下列装置制取并收集NO2气体,其中最合理的是( ) C [铜与浓硝酸反应的产物是NO2,其密度比空气的大,因此应利用向上排空气法收集NO2气体,导气管应长进短出,这样才能将装置中的空气排尽,且能防止倒吸,只有C项符合。] 3.完成表格。 序号 原物质 所含杂质 除杂质试剂 ① N2 O2 ② CO CO2 ③ CO2 CO ④ CO2 HCl ⑤ Cl2 HCl、H2O ⑥ SO2 HCl ⑦ CH4 乙烯 ⑧ NH3 CO2、H2O 【答案】 ①灼热的Cu网 ②NaOH溶液 ③灼热的CuO ④饱和NaHCO3溶液 ⑤饱和食盐水、浓H2SO4 ⑥饱和NaHSO3溶液 ⑦溴水 ⑧碱石灰 (1)气体除杂的注意事项 ①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如氯化氢气体、CO2、SO2等,水蒸气要在最后除去。 ②除杂选用方法时要保证杂质完全除掉,如除CO2最好用NaOH不用Ca(OH)2溶液。有时候为了保证气体除尽,还要验证一步,如验证混合气体中既有CO2,又有SO2,通常用品红溶液检验SO2,然后用溴水或酸性KMnO4溶液除去SO2,再用品红溶液检验是否除尽,最后用澄清石灰水检验CO2。 (2)集气装置的创新——排液集气装置 装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。若将广口瓶中的液体更换,还可以收集以下气体。 ①饱和食盐水——收集Cl2。 ②饱和NaHCO3溶液——收集CO2。 ③饱和NaHS溶液——收集H2S。 ④四氯化碳——收集HCl或NH3。 装置(Ⅱ)储气式集气。气体从橡胶管进入,可将水由A瓶排入B瓶,在瓶A中收集到气体。 常见仪器的连接 4.为了净化和收集由盐酸和大理石制得的CO2气体,从图中选择合适的装置并连接。 其中连接顺序合理的是( ) A.a—a′→d′—d→e B.c—c′→d—d′→g C.b—b′→d—d′→g D.d—d′→c—c′→f B [CO2气体中含HCl气体,可用饱和NaHCO3溶液除去。] 5.NH4NO3热分解十分复杂。在一定条件下:3NH4NO32NH3↑+2NO↑+2NO2↑+3H2O(不考虑2NO2N2O4),现要选用下列装置(部分夹持装置省略),通过实验验证反应产物: 已知:①液化温度:NO2(21 ℃)、NO(-152 ℃); ②NH3与灼热的氧化铜反应得到N2和Cu; ③在无催化剂的条件下NOx不能与灼热的铜反应; ④NO2能使湿润的淀粉碘化钾试纸变蓝。 (1)所选择装置的连接顺序(按左→右连接,填各装置数字)为________________________。 (2)实验开始应先向装置⑧中通入______________,再________。 (3)为验证NO,可在③中通入________________________________________ _____________________________________________________________。 (4)装置⑤的作用是_____________________________________________ _____________________________________________________________。 (5)填表: 验证产物 装置代号 相应装置中的现象 NH3 NO NO2 H2O 【解析】 ⑧为加热装置,由题意3NH4NO32NH3↑+2NO↑+2NO2↑+3H2O,为了更好地检验产物中是否含有NO,在加热前先通入一定量的N2,排净装置中的空气(或O2)。加热得到NH3、NO、NO2和H2O,利用装置⑦中无水硫酸铜检验生成的水,装置⑥吸收水蒸气,装置①检验NO2,装置④使二氧化氮液化,二氧化氮气体变成液态,装置③中通入一定量的氧气,无色气体变成红棕色,说明含有NO气体,装置②中NH3与CuO在加热的条件下反应得到N2、Cu和H2O,装置⑤尾气处理,防止污染空气,所以装置的连接顺序为⑧→⑦→⑥→①→④→③→②→⑤。 【答案】 (1)⑧→⑦→⑥→①→④→③→②→⑤ (2)一定量的N2 点燃酒精灯(或加热) (3)一定量的氧气 (4)尾气处理,防止污染空气 (5) 验证产物 装置代号 相应装置中的现象 NH3 ② 黑色粉末变成红色 NO ③ 无色气体变成红棕色 NO2 ①④ ①中淀粉碘化钾试纸变蓝,④中红棕色气体变成无色且管内有液体 H2O ⑦ 无水硫酸铜变蓝 ―→―→―→―→ 说明:(1)注意两处的防倒吸问题,一是气体发生和气体的除杂之间,二是气体收集或性质验证与尾气处理之间,为了防倒吸,常加一质安全瓶。 (2)H2O(g)的检验一般在最前检验,防止引入。 (3)防倒吸装置。 (4)防堵塞安全装置。 (5)防污染安全装置。 以气体性质验证和物质制备为目的的综合实验探究 [典例导航] (2016·全国Ⅰ卷,T26) 【答案】 (1)①A 2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O(或B NH3·H2ONH3↑+H2O) ②dcfei (2)①红棕色气体慢慢变浅 ②8NH3 +6NO27N2+12H2O ③Z中NaOH溶液产生倒吸现象 ④反应后气体分子数减少,Y管中压强小于外压 (1)氨气通入水中易产生倒吸的原因是_______________________________ _____________________________________________________________。 (2)氨气能否用浓H2SO4干燥?________。 (3)NO与NH3在催化剂条件下反应的化学方程式为____________________ _____________________________________________________________。 (4)装置中NaOH溶液的作用是_____________________________ _____________________________________________________________。 (5)浓氨水与CaO作用的方程式为______________________________ _____________________________________________________________。 【答案】 (1)NH3极易溶于水 (2)否 (3)6NO+4NH35N2+6H2O (4)吸收NO2,防污染 (5)NH3·H2O+CaO===NH3↑+Ca(OH)2 [对点训练] 1.(2017·全国Ⅰ卷,T10)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( ) A.①②③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 B [A项,若③中为焦性没食子酸溶液,则进入④中的气体还会有水蒸气,错误;B项,若在④处收集气体点燃,发出“噗”声,则证明制取的氢气较纯,可以加热管式炉,正确;C项,为了防止生成的W被氧化,反应结束时应先停止加热,待管式炉冷却后再关闭活塞K,错误;D项,二氧化锰与浓盐酸反应制取氯气需要加热,而启普发生器不能加热,错误。] 2.(2018·潍坊模拟)兴趣小组同学利用如图所示装置(夹持装置已略去)探究SO2的性质,并制取一种常用食品抗氧化剂焦亚硫酸钠(Na2S2O5)。 【导学号:95160070】 请回答下列问题:(实验前已除去装置中的空气) (1)打开分液漏斗活塞,发现其中的液体不能流下,应采取的操作是_____________________________________________________________ _____________________________________________________________。 (2)关闭K2、K3,打开K1,观察到装置C中发生的现象是 ___________________________________________。 (3)装置D和F的作用是_______________________________________。 (4)关闭K1、K3,打开K2。一段时间后E中有Na2S2O5晶体析出,装置E中发生反应的化学方程式为____________________________________________ _____________________________________________________________。 (5)设计实验验证Na2S2O5晶体在空气中已被氧化_________________ _____________________________________________________________。 【解析】 (1)使用分液漏斗时应取下分液漏斗上口的玻璃塞,使分液漏斗内的压强等于大气压强,保证液体顺利流下。(2)装置A中生成SO2,装置C中发生反应:H2O+SO2+Na2S===H2S+Na2SO3、SO2+2H2S===3S↓+2H2 O,现象是有淡黄色沉淀生成。(3)装置D和F的作用是吸收SO2,防止污染空气。(4)装置E中Na2SO3与SO2反应生成Na2S2O5。(5)若Na2S2O5晶体在空气中已被氧化,则生成Na2SO4,可以利用稀盐酸和BaCl2溶液检验SO。 【答案】 (1)拔掉分液漏斗上口的玻璃塞(或使分液漏斗玻璃塞上的凹槽或小孔对准瓶颈处的小孔) (2)有淡黄色沉淀生成 (3)吸收SO2,防止污染空气 (4)SO2+Na2SO3===Na2S2O5 (5)取少量Na2S2O5晶体于试管中,加适量水溶解,再滴加足量盐酸,振荡,无沉淀产生,排除Ag+的干扰,再滴入BaCl2溶液,有白色沉淀生成,证明Na2S2O5晶体在空气中已被氧化 (1)操作先后流程 ①装配仪器时:先下后上,先左后右。 ②加入试剂时:先固后液。 ③实验开始时:先检查装置气密性,再加药品,然后点燃酒精灯。 ④净化气体时:一般先除去有毒、有刺激性气味的气体,后除去无毒、无味的气体,最后除水蒸气。 ⑤防倒吸实验:往往是最后停止加热或停止通气。,⑥防氧化实验:往往是最后停止通气。 ⑦仪器拆卸的一般过程:从右到左,自上而下,先拆主体,后拆部件。 (2)有气体参与实验中的注意事项 ①爆炸:可燃性气体的点燃、不纯气体受热、气体导管堵塞导致。,②炸裂:玻璃仪器的骤冷骤热、受热不均等导致。 ③倒吸:气体在用液体吸收或与液态试剂反应时,由于极易溶解或反应导致。 ④堵塞:生成的蒸气易凝结、生成气体的同时产生粉尘等导致。,⑤空气污染:生成的气体有毒,缺少尾气处理措施或措施不当导致。查看更多