- 2021-07-05 发布 |
- 37.5 KB |
- 18页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习考前增分静悟:化学识图能力再提升课件(18张)(全国通用)
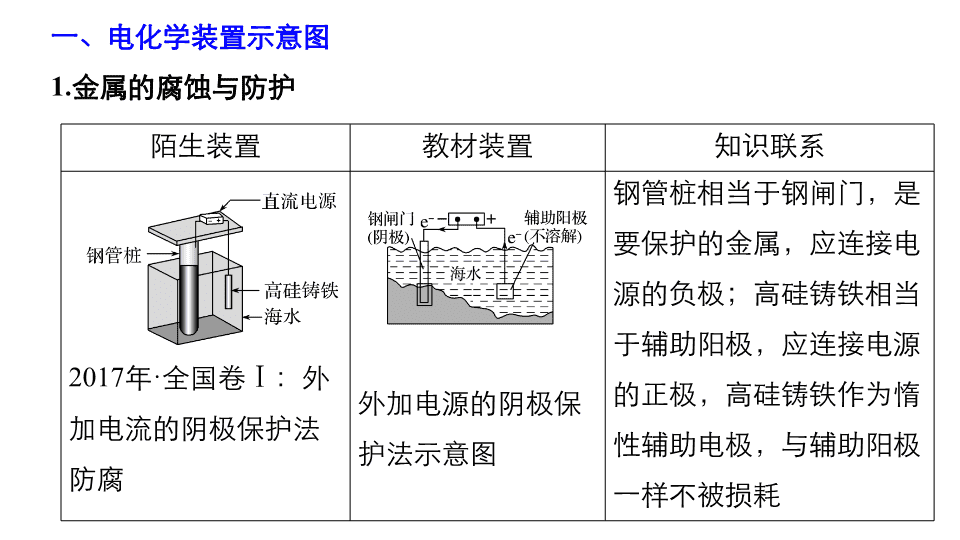
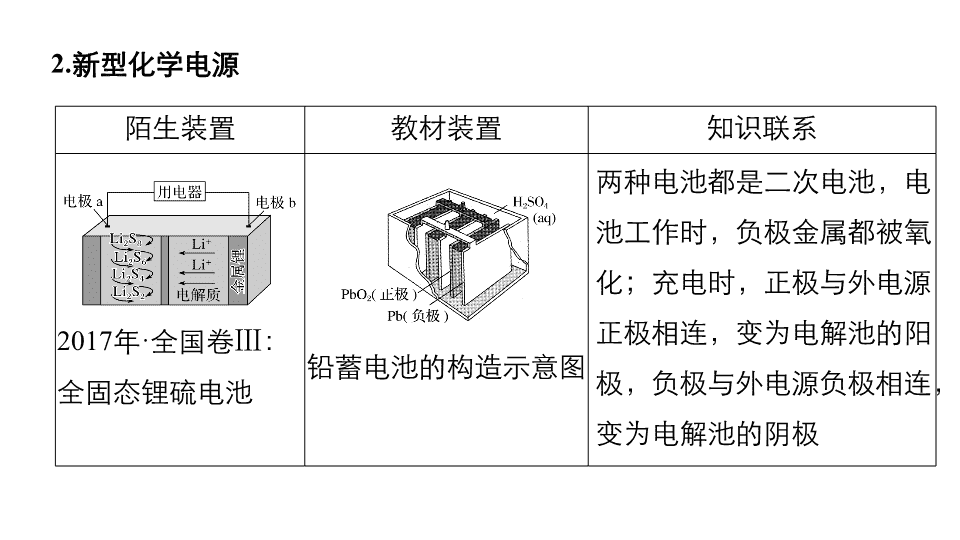
专题四 化学识图能力再提升 第四篇 考前静悟 一、电化学装置示意图 1. 金属的腐蚀与防护 陌生装置 教材装置 知识联系 2017 年 · 全国卷 Ⅰ :外加电流的阴极保护法防腐 外加电源的阴极保护法示意图 钢管桩相当于钢闸门,是要保护的金属,应连接电源的负极;高硅铸铁相当于辅助阳极,应连接电源的正极,高硅铸铁作为惰性辅助电极,与辅助阳极一样不被损耗 2. 新型化学电源 陌生装置 教材装置 知识联系 2017 年 · 全国卷 Ⅲ :全固态锂硫电池 铅蓄电池的构造示意图 两种电池都是二次电池,电池工作时,负极金属都被氧化;充电时,正极与外电源正极相连,变为电解池的阳极,负极与外电源负极相连,变为电解池的阴极 3. 电解原理的应用 陌生装置 教材装置 知识体系 2016· 全国卷 Ⅰ 三室式电渗析法处理含 Na 2 SO 4 废水 阳离子交换膜法电解饱和食盐水 氯碱工业中,利用阳离子交换膜既能防止氯气与氢气混合爆炸,又能防止氯气与生成的 NaOH 反应,影响产品的纯度。电渗析法是运用多种离子交换膜,使离子有选择性的定向移动,即可达到物质分离的目的 二、坐标曲线图 1. 单曲线 2. 对比曲线 如:铁的浸出率结果如下图: (1) (2)(2017· 全国卷 Ⅰ , 13) 常温下将 NaOH 溶液滴加到己二酸 (H 2 X) 溶液中,混合溶液的 pH 与离子浓度变化的关系如图所示。 3. 多曲线 (2017· 全国卷 Ⅱ , 12) 如:改变 0.1 mol·L - 1 二元弱酸 H 2 A 溶液的 pH ,溶液中的 H 2 A 、 HA - 、 A 2 - 的物质的量分数 δ(X) 随 pH 的变化如图所示。 三、物质转化关系图 1. 熟悉教材中的工艺流程 (1) 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得 FeCl 3 溶液,准备采用下列步骤: 分析过程 废液加入过量铁粉过滤,滤液中的主要成分为 FeCl 2 ,滤渣为 Cu 和过量的铁,再加盐酸溶解过量的铁,得 FeCl 2 溶液和单质铜,并将 FeCl 2 合并后用 Cl 2 氧化,实现了 FeCl 3 再生回收利用。 (2) 镁及其合金是一种用途很广的金属材料,目前世界上 60% 的镁是从海水中提取的。主要步骤如下: 分析过程 海水中首先加入生石灰沉淀 Mg 2 + ,过滤得到 Mg(OH) 2 ,将沉淀分离,加入盐酸溶解,变成氯化镁溶液,完成 Mg 2 + 的富集;再经过蒸发结晶、过滤得到氯化镁晶体,在 HCl 气流中脱水干燥得到无水氯化镁;最后电解熔融的无水氯化镁制得金属镁和氯气。 (3) 卤块的主要成分是 MgCl 2 ,此外还含有 Fe 3 + 、 Fe 2 + 、 Mn 2 + 等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。 生成氢氧化物沉淀的 pH 物质 开始沉淀 沉淀完全 Fe(OH) 3 2.7 3.7 Fe(OH) 2 7.6 9.6 Mn(OH) 2 8.3 9.8 Mg(OH) 2 9.6 11.1 Fe 2 + 氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为 Fe 3 + ,生成 Fe(OH) 3 沉淀除去。 分析过程 卤块溶于水,加入氧化剂 ( 如氯水 ) ,将 Fe 2 + 氧化为 Fe 3 + ,加 MgO 调 pH ,沉淀 Fe(OH) 3 和 Mn(OH) 2 ,滤液的主要成分是 MgCl 2 ,用碱性物质 ( 氨水 ) 沉淀 Mg 2 + 生成 Mg(OH) 2 ,加水煮沸使 Mg(OH) 2 充分沉淀。 (4) 以铝土矿 ( 主要成分为 Al 2 O 3 ,含 SiO 2 和 Fe 2 O 3 等杂质 ) 为原料制备铝的工艺流程中,其中一种酸溶流程如下: 部分金属离子在实验条件下开始沉淀和完全沉淀的 pH 如下表: 金属离子 Fe 3 + Al 3 + 开始沉淀时 pH 1.9 3.3 沉淀完全时 pH 3.2 5.2 分析过程 铝土矿 (Al 2 O 3 、 SiO 2 、 Fe 2 O 3 ) ,经盐酸反应后所得物 (Al 3 + 、 Fe 3 + 、 SiO 2 ) ,滤渣 1 是 SiO 2 ,结合表格信息,经调节 pH 后所得物 [Al 3 + 、 Fe(OH) 3 ] ,滤渣 2 是 Fe(OH) 3 。滤液 2 是 Al 3 + ,经加入氨水后所得物 [ Al(OH) 3 、 NH 4 Cl ] ,滤液是 NH 4 Cl ,滤渣是 Al(OH) 3 ,经灼烧后得 Al 2 O 3 ,经电解后得 Al 。 2. 高考真题示例 (1)(2017· 全国卷 Ⅰ , 27)Li 4 Ti 5 O 12 和 LiFePO 4 都是锂离子电池的电极材料,可利用钛铁矿 ( 主要成分为 FeTiO 3 ,还含有少量 MgO 、 SiO 2 等杂质 ) 来制备,工艺流程如下: 分析过程 一、看反应原料和产物。反应原料为 FeTiO 3 、 MgO 、 SiO 2 ,产物为 Li 4 Ti 5 O 12 和 LiFePO 4 。根据元素守恒可知原料中 FeTiO 3 为主原料, MgO 、 SiO 2 为杂质需要从主线中分离出去。 二、看流程图,从图中可观察到有一条支线和两条主线。支线的作用是分离酸浸后的难溶物。由两条主线结合题设提供的信息,可知 FeTiO 3 中的 Ti 元素转移到 Li 4 Ti 5 O 12 中。元素的化合价在整个过程中未发生变化,所以得到 Li 4 Ti 5 O 12 的反应路线主要是溶液中的反应和最后的固体反应,未涉及氧化还原反应。得到 LiFePO 4 的反应路线, Fe 元素的化合价先升高后降低,涉及两步氧化还原反应。 三、将反应原料带入反应路线中。酸浸后滤渣为难溶于酸的 SiO 2 。滤液 ① 中含有的离子为 H + 、 Cl - 、 Fe 2 + 、 Mg 2 + 、 。滤液经过水解并过滤分别得到的沉淀物 TiO 2 · x H 2 O 和滤液 ② 作为上下两条主线的反应原料。在两条主线中分别经历的反应和分离过程以图示的形式分析如下: (2)(2018· 全国卷 Ⅰ , 7) 磷酸亚铁锂 (LiFePO 4 ) 电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下: 分析过程 明确流程中元素的转化关系,正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶时,碳不与硫酸、硝酸反应,硝酸将亚铁离子氧化为铁离子,过滤后滤渣是炭黑,滤液中含有 Li + 、 、 Fe 3 + ,加入碱液时 Fe 3 + 转化为氢氧化铁沉淀,滤液中加入碳酸钠时 Li + 转化为沉淀。查看更多